超声检查新技术在慢性肾脏病诊断中的应用
刘春蕊 综述 杨 斌 审校
慢性肾脏病(CKD)是指各种原因引起的肾脏结构或功能异常持续时间超过3个月,主要包括原发性肾小球疾病和继发于多种系统性疾病的肾脏损害,是临床常见疾病,症状较隐匿,若病因持续存在,最终进展为终末期肾病(ESRD)[1]。早期准确诊断、有效治疗,对于逆转肾脏疾病进展、降低肾功能衰竭的发生率具有重要意义。目前,肾组织活检是确定肾脏病理改变的唯一方法,但该法有创,不宜重复操作和动态监测病变发展过程。超声检查是CKD患者首选的影像学检查方法。常规超声可实时动态监测肾脏形态结构和血流动力学的变化,但其缺点是对操作者的技术依赖性较高,特异度和准确性不高。三维超声、超声造影(CEUS)、弹性成像等新技术是在传统二维超声检查的基础上获得更全面、更准确的肾脏结构和功能信息,扩大了传统超声检查的范围,弥补了常规超声检查的不足,为CKD的早期诊断提供了新的思路。本文就超声检查新技术在CKD中的应用现状及研究前景作一综述。
常规超声
正常成人肾脏纵断面呈椭圆形,冠状断面呈蚕豆形,其长、宽、厚的超声测值分别为10~12 cm、5~7 cm和3~5 cm,肾实质厚为1.5~2.5 cm。CKD在二维超声声像图取决于原发疾病的性质,进展到ESRD,其声像图特点是双肾外形不规则,各径线值缩小,肾皮质变薄,皮髓质分界不清,皮质回声增加。区别于急性肾损伤时肾脏体积不同程度增大,肾皮质增厚,皮髓分界清,肾乳头肿胀,回声明显减低。研究认为CKD患者肾脏皮质厚度变薄更能反映肾脏损伤程度[2]。尿毒症患者中有糖尿病较无糖尿病的肾脏明显较大。CKD的彩色多普勒超声(CDFI)表现为肾内血流稀疏,血流色彩减少的程度与肾脏损害程度呈正比,频谱示肾动脉阻力指数(RI)>0.7和肾内各动脉RI>0.65(排除其他疾病,如高血压等),频谱呈小慢波,加速时间延迟,严重时仅有收缩期峰,而舒张期峰消失,呈单峰[3]。
三维超声
三维超声是对二维超声的补充。主要技术有三维彩色血管能量成像(3D-CPA)、三维超声体积自动测量技术(VOCAL)和实时三维超声造影(RT3DCEUS)。三维超声能够显示较完整、直观的肾脏解剖形态和肾脏动静脉血流,其缺点是操作时间长、操作复杂、图像质量易受影响。影响三维超声测量准确性和重复性的主要因素是重建图像的质量。只要边界清晰,三维超声体积测量具有很好的重复性和准确性,相比于二维超声,其测量的误差较小[4]。
3 D-CPA可重建肾内血管树的空间立体图像,显示器官血管形态、数量及分布情况等。VOCAL技术可定量分析肾内血流灌注情况,主要参数有血管指数(VI)、血流指数(FI)及血管血流指数(VFI),其中,VI反应了血流容积分布,FI反映了平均血流速度,VFI则根据血流速度评估肾血流灌注的情况。RT3D-CEUS实时获得病灶造影过程的三维灌注信息,信息量大且不受脏器活动度的影响,但目前临床应用较少,主要用于肾肿瘤、肾外伤的评价(图1)。
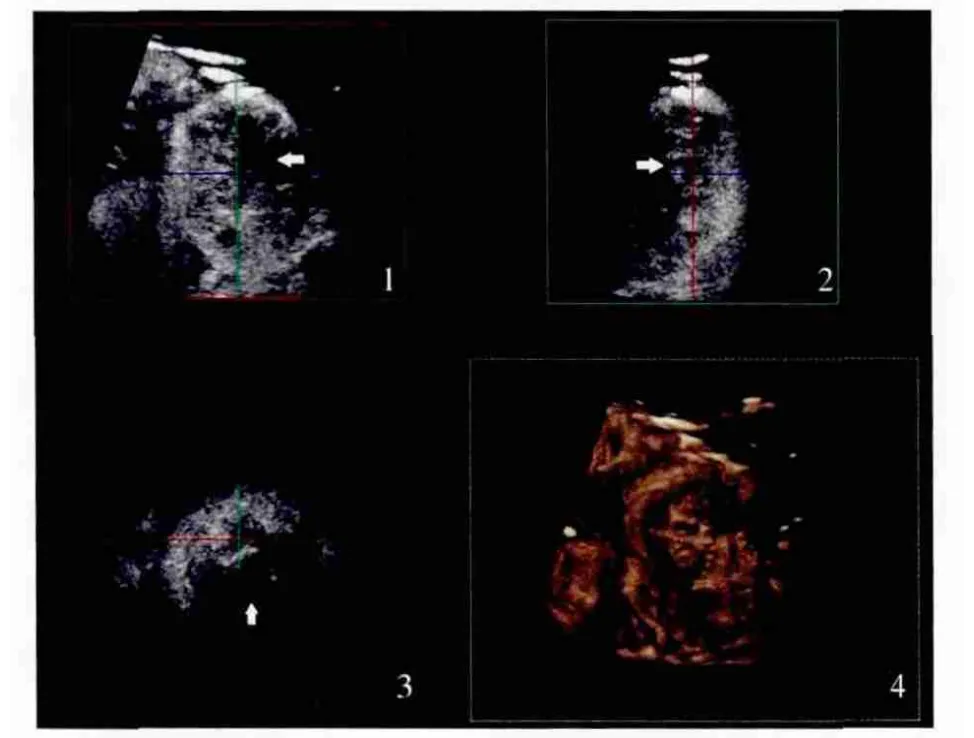
图1 肾脏实时三维超声造影
肾脏体积缩小是不可逆的肾功能损害的标志。三维超声实现了安全、准确、敏感地测量肾脏体积。Kim等[5]研究发现三维超声测量肾脏体积可重复性较二维较好,而且三维超声的标准化体积与肾小球滤过率(GFR)之间的相关性较二维超声较好。Riccabona等[6]在前瞻性评估三维超声对无急性肾功能不全的婴幼儿及儿童肾积水的肾脏相对大小的测量,与二维超声、MR尿路造影测量结果比较,认为三维超声能准确用于无急性肾功能不全的肾实质体积和肾相对大小评估。Cansu等[7]对106例高血压所致的肾病和65例健康对照分别行3D-CPA检查,VOCAL 定量分析肾体积(RV)、VI、FI、VFI,研究发现GFR正常组和 GFR减低组的 RV、VI、FI、VFI差异具有统计学意义,且RV、VI与GFR有明显的相关性。
超声造影(CEUS)
CDFI对微小动脉和微小缓慢的血流敏感度较低,并存在角度依赖性,在CKD的早期诊断和肾功能评价有一定地局限性。CEUS是近年来应用广泛的一种新型的诊断手段。其原理是通过静脉注射微泡,增加超声波的背向散射信号,从而增加血流的散射回声。超声造影剂无肾毒性,较CT和MRI造影剂安全,过敏反应发生率低。CEUS时间强度曲线(TIC)分析的引入有助于定量分析肾移植术后、肾弥漫性病变等肾内血流感兴趣区(ROI)的灌注情况。在肾肿瘤鉴别诊断,肾外伤、肾血管性病变等疾病的诊断中具有独特的诊断价值,但在CKD患者的早期诊断和病情评估的应用目前还处于探索阶段[8-9]。
正常肾脏实时CEUS:增强从肾门开始,沿血流方向肾主动脉、段动脉、叶间动脉、弓形动脉、小叶间动脉向外周扩散,肾皮质增强随之从肾被膜向肾锥体方向增强,然后肾髓质从皮质侧向内髓增强。随着微泡在循环中聚集减低,增强逐渐消退。TIC定量分析的参数有:到达时间(AT),达峰时间(TTP),峰值强度(PI),曲线下面积(AUC),曲线上升率等。
CEUS发现CKD患者增强程度减低,增强缓慢。Tsuruoka等[10]使用 Sonazoid超声造影剂对 85例CKD患者和5例健康对照行CEUS发现,CKD患者肾皮质和髓质的增强程度较对照组减低。分析TIC曲线,曲线上升率减小,TTP延长,PI降低,皮髓质增强减退较早。CKD患者的CEUS增强程度减低反映了肾小管周围毛细血管的灌注异常。Ma等[11]研究糖尿病并发肾功能不全的CKD患者A组(CKD 1期和CKD 2期)、B组(CKD 3期和CKD 4期)分别行CEUS,分析TIC曲线,发现A、B组上升支斜率比对照组减小,AT、TTP明显延长,AI、PI明显降低;组A中的AUC有增加趋势,而组B上升支、下降支和总的AUC都降低,并且AUC和GFR有明显的相关性。Dong等[12]使用二代造影剂SonoVue对41例临床怀疑CKD的患者和45例健康对照分别行双肾CEUS,前瞻性研究轻度肾损害(CKD 1和2期)肾皮质灌注情况发现,TIC曲线的形状无明显改变,但AUC、DPI及曲线上升率明显改变。
在对移植肾的血流灌注评价和早期免疫排斥反应诊断中,CEUS 优于常规 CDFI。Schwenger等[13]对26例肾移植受者分别使用CEUS和CDFI进行前瞻性研究发现,CEUS评估的肾血流量与肌酐水平相关性较高,而且对肾血流量测定的灵敏度、特异度和准确性均高于CDFI。Benozzi等[14]通过对39例肾移植受者术后5、15、30天分别使用CDFI和CEUS对比发现,两者均可早期发现肾移植功能不全,但对于急性肾小管坏死和急性免疫排斥反应CEUS的价值更高,主要表现在CEUS评估的局部肾血流量减低,造影剂通过时间明显缩短,TTP明显延长。
CKD患者常合并肾血管病变,CEUS检查在肾血管病变的诊断具有其独特的优势,特异度和敏感度较高[3,8,15-16]。(1)动脉粥样硬化性肾动脉狭窄(ARAS)患者的CDFI表现为狭窄处血流显呈“五彩镶嵌”,狭窄处峰值流速(PSV)增加,但肾动脉狭窄严重时,狭窄段流速可表现为正常或降低,准确性降低。CEUS可清晰显示主肾动脉和副肾动脉,直观观察双肾动脉起始处或肾内动脉有无造影剂充盈缺损,通过定量分析TIC曲线来评价不同程度肾动脉狭窄时的肾血流灌注情况。研究发现常规超声联合超声造影,与血管造影诊断的一致性较高[16]。(2)肾病综合征常伴发肾静脉血栓,肾门处肾静脉内有点状血栓充填,肾内静脉血流缺乏或减少,肾内动脉阻力升高。CEUS表现为肾动脉、肾皮质增强时间延迟,肾静脉无增强和动-静脉渡越时间延长等,是目前诊断肾静脉血栓的较好方法[3]。血管造影是诊断肾血管疾病的“金标准”,为有创检查,MR血管成像和CT血管成像检查过程需大量造影剂,对于已有肾功能不全的CKD患者应慎用。超声检查诊断准确、操作便利,造影剂无肾毒性及重复性好,在肾血管性疾病中具有独特的诊断价值。但由于肾动脉位置较深,相对较细,易受肠道气体和肥胖等多种因素的影响,超声检查也存在一定局限性[8,15]。
CEUS对于经皮肾穿刺活检后的严重并发症诊断价值也较高[17]。常规超声对穿刺后并发肾小裂伤、肾实质内的小血肿和活动性出血诊断价值常较低,而CEUS可动态观察穿刺点处有无造影剂溢出或血肿形成,其准确性和敏感度较高。肾小裂伤、肾实质内的小血肿和肾周血肿的超声造影常表现为穿刺点附近始终无造影剂进入的无增强区,与周围正常强化的肾组织呈显著对比。活动性出血时CEUS示造影剂自穿刺点呈弥散样、细线样溢出至肾周围的无增强区,形成不规则的异常增强区,而且其消退较正常肾实质缓慢(图2)。肾内动-静脉瘘是穿刺活检后的严重并发症,CEUS提示其最早增强且持续时间长,诊断率较高。CT薄层扫描和多方位重建对于穿刺活检后的损伤部位、范围、程度及血肿容积的估算准确性更高。但由于CT检查费用高、有放射性及造影剂碘油的肾毒性,对于穿刺活检后的随访检查有一定的局限性。
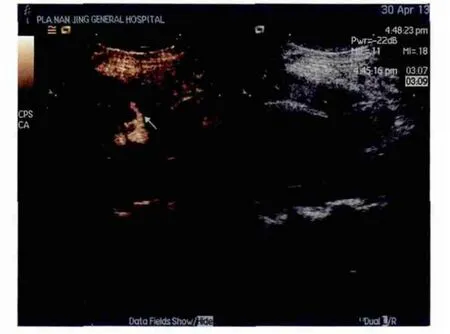
图2 活动性出血的超声造影表现
此外,CEUS在反流性肾病的诊断中具有独特的优势。将超声造影剂通过尿道注入充盈的膀胱内,造影剂微泡产生的强散射可清晰显示,一旦尿液内的微泡返流进入输尿管,并超过输尿管下1/3段,甚至在肾盂内也可见到微泡强反射回声,即可诊断尿液返流[3](图 3)。
超声弹性成像(UE)

图3 反流性肾病的超声造影表现
超声弹性技术是近年来新发展的一种无创性评估组织弹性特征的新型成像方法。超声弹性技术可分为实时组织弹性成像(RTE)、瞬时弹性成像(TE)、声辐射力脉冲成像(ARFI)和超声剪切力成像(SSI)。弹性成像技术定量评价肾脏弹性是通过测量剪切波速度(SWV),SWV与组织的弹性系数的平方根成比例。MR弹性成像技术和UE技术都是基于此,但后者由于可以在超声引导下实现可视化测量,这一点优于MR。受肾脏解剖位置影响以及对肾脏的可视化操作,ARFI和SSI较适合肾组织的弹性成像。目前广泛应用的超声触诊组织量化技术(VTQ)就是基于ARFI,其准确、可重复性高,操作依赖性低,对肾脏组织弹性评价的研究前景可观[9,18-21]。
研究发现正常人的SWV和年龄、性别明显相关,但是与身高、体重和腹围无明显相关[22-23]。CKD患者中SWV和eGFR、尿素氮、肌酐相关。不同皮质深度的SWV差异有统计学意义,但不同病理类型的CKD患者其SWV无差异,且除CKD 5期患者外,SWV和CKD的分期无相关性。CKD患者肾皮质区域SWV较正常偏低,随着CKD病变程度加重,肾皮质SWV减低(图4)。

图4 声触诊组织量化技术在慢性肾脏病中的应用
研究发现肾弹性值与移植肾损伤的病理改变之间存在一定关系[19,24-27]。Arndt等[24]对 57 例移植肾受者使用Fibroscan设备行TE检查发现,肾实质硬度和间质纤维化之间有明显相关性,与eGFR成负相关,移植肾损伤0~1级和2、3级患者肾硬度有明显差异。Stock等[25]对18个肾移植受者进行ARFI检查,显示ARFI值与肾纤维化程度之间呈中度正相关,且与肾活检间质纤维化分级(2007年新版BANFF分级法)也呈正相关,通过弹性测定可准确诊断程度较重的纤维化,而对于早期纤维化较难鉴别。然而 Syversveen等[26]利用 ARFI技术对30例肾移植受者进行弹性测定,并与肾活检肾间质纤维化分级(BANFF 97分级法)对比显示,未发生肾间质纤维化的移植肾和肾间质纤维化的移植肾之间SWV无明显差别,观察者内部和两个观察者之间的变异度较大。Grenier等[27]使用SSI对49例接受肾活检的肾移植受者研究显示,肾硬度和间质纤维化之间无明显相关性。但是肾皮质硬度与肾慢性病变和基础病总BANFF评分之间相关。Grenier[19]提出可能解释肾硬度改变,和间质纤维化之间存在相关性,但是肾脏皮质硬度的程度并不反映特异性的肾内改变如间质纤维化,但是反映肾脏微小损伤,特别是慢性病变。
UE在CKD动物模型的研究为进一步在临床应用这项技术提供依据。Derieppe等[28]在肾小球硬化大鼠模型中,采用SSI评价肾皮质弹性改变并预测间质纤维化的病理程度,研究发现肾功能不全加重将引起肾皮质SSI弹性测值增加,肾硬度的增加值与血清学指标显示的肾功能失调的程度高度相关。但SSI测值与BANFF分级不相关。
小结与展望
三维超声、CEUS及UE技术在CKD诊疗的研究不断深入,应用范围愈加广泛,成为目前超声诊断最有应用前景的研究方向。
(1)三维超声能够显示较完整、直观的肾脏解剖形态及肾动静脉血流的空间分布,其缺点是操作时间长、操作复杂、图像质量易受影响。三维超声的准确性直接取决于二维图像的质量,容易受到操作手法及图像采集、融合、重建方法的影响。未来发展的前景在于发展电子门控方法(如呼吸),采用机器人操作,更快地采集、分析和显示数据,发展新的计算法,提高重建图像的质量等。(2)CEUS的特点是操作便捷、实时动态、造影剂安全不良反应少和可重复性高,在肾脏疾病诊断、肾活检合并症、肾血管病变等方面有其独特的优势,其局限性在于容易受到呼吸移动影响,造影剂的浓度、ROI位置及面积的选择均会影响其定量分析CKD患者血流灌注情况的敏感度、准确性和可重复性。未来靶向超声造影会是最有前景的超声诊断及辅助治疗方式。肾脏疾病的发生和发展均与基因异常表达有关,基因治疗将可能成为治疗肾脏疾病的有效手段,然而基因治疗领域仍存在许多问题导致治疗效果不甚理想,超声所用的微泡造影剂的出现,有力地推进了基因治疗的迅速发展,微泡受到超声波刺激后产生空化效应和声孔效应,使细胞膜通透性明显提高[29],基因进入组织细胞,增强其在细胞内的转染和表达,为肾脏疾病的治疗提供一种新型有效的思路和方法。(3)UE技术的发展为实现无创性评估和可视化测量肾脏组织的弹性参数。但由于肾脏位置和结构的特异性,肾脏弹性值不仅和肾间质纤维化相关,操作上探头对腹壁的压力,肾组织内的各向异性、血管生成、尿液压力都会对弹性值产生影响[30]。
相信随着临床实践和科研发展,常规超声的普遍应用结合超声检查新技术地不断推广,超声检查技术在CKD的早期发现、并发症诊断、病情评估和预后监测的应用更为广泛。
1 Stevens PE,Levin A;Kidney Disease:Improving Global Outcomes ChronicKidney Disease Guideline DevelopmentWork Group Members.Evaluation and management of chronic kidney disease:synopsis of the kidney disease:improving global outcomes 2012 clinical practice guideline.Ann Intern Med,2013,158(11):825-830.
2 Beland MD,Walle NL,Machan JT,et al.Renal cortical thickness measured at ultrasound:is it better than renal length as an indicator of renal function in chronic kidney disease?Am J Roentgenol,2010,195(2):w146-149.
3 杨斌.超声检查在肾脏疾病诊断中的应用和体会.肾脏病与透析肾移植杂志,2008,17(5):446-447.
4 Rankin RN,FensterA,DowneyDB,etal.Three-dimensional sonographic reconstruction:techniques and diagnostic applications.Am J Roentgenol,1993,161(4):695-702.
5 Kim HC,Yang DM,Jin W,et al.Relation between total renal volume and renal function:Usefulness of 3D sonographic measurements with a matrix array transducer.Am J Roentgenol,2010,194(2):W186-192.
6 Riccabona M,Fritz GA,Schöllnast H,et al.Hydronephrotic Kidney:Pediatric Three-dimensional US for Relative Renal Size Assessment—Initial Experience.Radiology,2005,236(1):276-283.
7 Cansu A,Kupeli A,Kul S,et al.Evaluation of the relationship between renal function and renal volume-vascular indices using 3D power Doppler ultrasound.Eur J Radiol,2014,83(7):1080-1085.
8 Herrmann SM,Textor SC.Diagnostic criteria for renovascular disease:where are we now?Nephrol Dial Transplant,2012,27(7):2657-2663.
9 Koizumi Y,Hirooka M,Kisaka Y,et al.Liver fibrosis in patients with chronic hepatitis C:noninvasive diagnosis by means of real-time tissue elastography—establishmentof the method for measurement.Radiology,2011,258(2):610-617.
10 Tsuruoka K,Yasuda T,Koitabashi K,et al.Evaluation of renal microcirculation by contrast-enhanced ultrasound with Sonazoid as a contrast agent.Int Heart J,2010,51(3):176-182.
11 Ma F,Cang Y,Zhao B,et al.Contrast-enhanced ultrasound with SonoVue could accurately assess the renal microvascular perfusion in diabetic kidney damage.Nephrol Dial Transplant,2012,27(7):2891-2898.
12 Dong Y,Wang WP,Cao J,et al.Early assessment of chronic kidney dysfunction using contrast-enhanced ultrasound:a pilot study.Brit J Radiol,2014,87(1042):20140350.
13 Schwenger V,Korosoglou G,Hinkel UP,et al.Real-time contrastenhanced sonography of renal transplant recipients predicts chronic allograft nephropathy.Am J Transplant,2006,6(3):609-615.
14 Benozzi L,Cappelli G,Granito M,et al.Contrast-enhanced sonography in early kidney graft dysfunction.Transplant Proc,2009,41(4):1214-1215.
15 Zubarev AV.Ultrasound of renal vessels.Eur Radiol,2001,11(10):1902-1915.
16 李超伦,王文平,何婉媛,等.高机械指数灰阶谐波超声造影评价肾动脉狭窄的初步研究.中华超声影像学杂志,2010,19(5):400-403.
17 Waldo B,Korbet SM,Freimanis MG,et al.The value of post-biopsy ultrasound in predicting complications after percutaneous renal biopsy of native kidneys.Nephrol Dial Transplant,2009,24(8):2433-2439.
18 Gietka-Czernel M,Kochman M,BujalskaK,etal.Real-time ultrasound elastography-a new tool for diagnosing thyroid nodules.Endokrynol Pol,2010,61(6):652-657.
19 Grenier N,Gennisson JL,Cornelis F,et al.Renal ultrasound elastography.Diagn Interv Imaging,2013,94(5):545-550.
20 Arda K,Ciledag N,Aktas E,et al.Quantitative assessment of normal soft-tissue elasticity using shear-wave ultrasound elastography.AJR Am J Roentgenol,2011,197(3):532-536.
21 Sandrin L,Fourquet B,Hasquenoph JM,et al.Transient elastography:a new noninvasivemethod forassessmentofhepaticfibrosis.Ultrasound Med Biol,2003,29(12):1705-1713.
22 Guo LH,Xu HX,Fu HJ,et al.Acoustic radiation force impulse imaging for noninvasive evaluation of renal parenchyma elasticity:preliminary findings.PLoS One,2013,8(7):e68925.
23 傅宁华,杨斌,姚春晓,等.声触诊组织定量分析评估慢性肾病患者肾脏弹性.中华医学超声杂志 (电子版),2010,(12):65-67.
24 Arndt R,Schmidt S,Loddenkemper C,et al.Noninvasive evaluation of renal allograft fibrosis by transient elastography-a pilot study.Transpl Int,2010,23(9):871-877.
25 Stock KF,Klein BS,Vo Cong MT,et al.ARFI-based tissue elasticity quantification in comparison to histology for the diagnosis of renal transplant fibrosis.Clin Hemorheol Microcirc,2010,46(2-3):139-148.
26 Syversveen T,Brabrand K,Midtvedt K,et al.Assessment of renal allograft fibrosis by acoustic radiation force impulse quantification-a pilot study.Transplant Int,2011,24(1):100-105.
27 Grenier N,Poulain S,Lepreux S,et al.Quantitative elastography of renal transplants using supersonic shear imaging:a pilot study.Eur Radiol,2012,22(10):2138-2146.
28 Derieppe M,Delmas Y,Gennisson JL,et al.Detection of intrarenal microstructural changes with supersonic shear wave elastography in rats.Eur Radiol,2012,22(1):243-250.
29 Sirsi SR,Borden MA.Advances in ultrasound mediated gene therapy using microbubble contrast agents.Theranostics,2012,2(12):1208-1222.
30 Gennisson JL,Grenier N,Combe C,et al.Supersonic shear wave elastography of in vivo pig kidney:influence of blood pressure,urinary pressure and tissue anisotropy.Ultrasound Med Biol,2012,38(9):1559-1567.

