单克隆免疫球蛋白病相关C3肾炎的临床病理分析
张丽华 程 震 徐 峰 张 涛 章海涛 葛永纯 周 岩 曾彩虹 胡伟新 唐 政 刘志红
C3肾炎是由补体旁路途径异常激活导致的一种肾小球肾炎,最早于1974年由Verroust等报道描述,2010年由Fakhouri正式提出命名,已成为近年肾脏病领域的研究热点之一[1-2]。其病理特征为免疫荧光以C3沉积为主、免疫球蛋白阴性或很少量沉积(C3免疫荧光强度比其他免疫分子强度≥++),光镜下可见肾小球系膜增生性病变、膜增生性病变、肾小球内皮系膜增生性病变甚至肾小球轻微病变,电镜下电子致密物主要沉积于系膜区、内皮下,部分可伴上皮下、肾小球基膜内非连续性沉积。C3肾炎与致密物沉积病(DDD)统称C3肾病。
C3肾炎的发病考虑与补体调节蛋白的基因变异或抗体产生导致补体旁路异常激活相关,但具体分子机制尚不明确[1-2]。近年国外文献报道,单克隆免疫球蛋白病亦可异常激活补体旁路途径,诱发 C3 肾炎[3-5]。但国内尚无相关报道,为提高对此疾病的认识,我们总结分析7例单克隆免疫球蛋白病相关的C3肾炎患者的临床及病理特点。
对象和方法
研究对象 回顾性2004年3月至2015年5月分析南京军区南京总医院肾脏科住院并行肾活检的患者。入选标准:(1)免疫荧光以C3沉积为主、免疫球蛋白阴性或很少量沉积(C3免疫荧光强度比其他免疫分子强度≥2+),电镜电子致密物沉积于肾小球毛细血管袢内皮下和/或系膜区、偶伴上皮侧沉积;(2)血清单克隆免疫球蛋白阳性。排除标准:致密物沉积病、自身免疫性疾病与感染后肾小球肾炎。
临床指标 记录患者的性别、年龄、病程、临床表现及实验室检查,包括血常规、血清肌酐(SCr)、血清白蛋白(Alb),球蛋白(Glo),自身抗体、补体C3、C4,血清免疫固定电泳、血游离轻链,C3肾炎因子、血清H因子、抗H因子抗体,骨髓细胞学及活检结果;尿液检查包括24h尿蛋白定量(正常值<0.4 g/24h),尿沉渣红细胞计数(>10万/ml定义为镜下血尿)。
肾脏病理 所有患者均行经皮肾穿刺活检术,肾组织行光镜、免疫病理及电镜检查。光镜组织常规行 HE、PAS、PASM-Masson、Masson 三色染色,免疫荧光直接法观察肾组织IgG、IgA、IgM、C3、C1q沉积强度及部位。穿刺标本光镜检查所需肾小球数均>10个。电镜观察所取肾组织以3.75%的冷戊二醛固定,1%四氧化锇后固定,超薄切片厚度70~90 nm,醋酸铀、柠檬酸铅双染色,置于Hitachi7500透射电镜下观察。
肾组织κ、λ轻链染色 冰冻切片,干燥;小牛血清封闭10 min,滴加一抗κ轻链(1∶100,兔抗人,A0100,Dako),λ 轻链(1 ∶100,兔抗人,A0101,Dako)室温孵育1h:PBS洗3次,滴加FITC标记的猪抗兔二抗,室温孵育30 min。水洗、吹干、甘油封片,荧光显微镜下观察。
病理指标定义 慢性肾小管间质病变指肾小管萎缩、基膜增厚,肾间质纤维化。病变程度按皮质区病变范围分为轻度(≤25%)、中度(26% ~50%)及重度(>50%)。急性肾小管间质病变是指肾小管上皮细胞及刷状缘脱落,病变分轻、中和重度,定义同前。
结 果
一般临床资料 2004年3月~2015年5月经肾活检诊断为C3肾炎同时伴血清单克隆免疫球蛋白阳性者共7例,男性5例,女性2例,肾活检时的年龄为44~65岁(平均年龄55.4岁),肾脏病病程3~67月。尿蛋白定量1.0~7.3 g/24h,镜下血尿6例,SCr升高3例,血压升高6例,贫血4例,临床资料见表1。所有患者 ANA、ds-DNA、ENA多肽谱及传染病四项均为阴性。
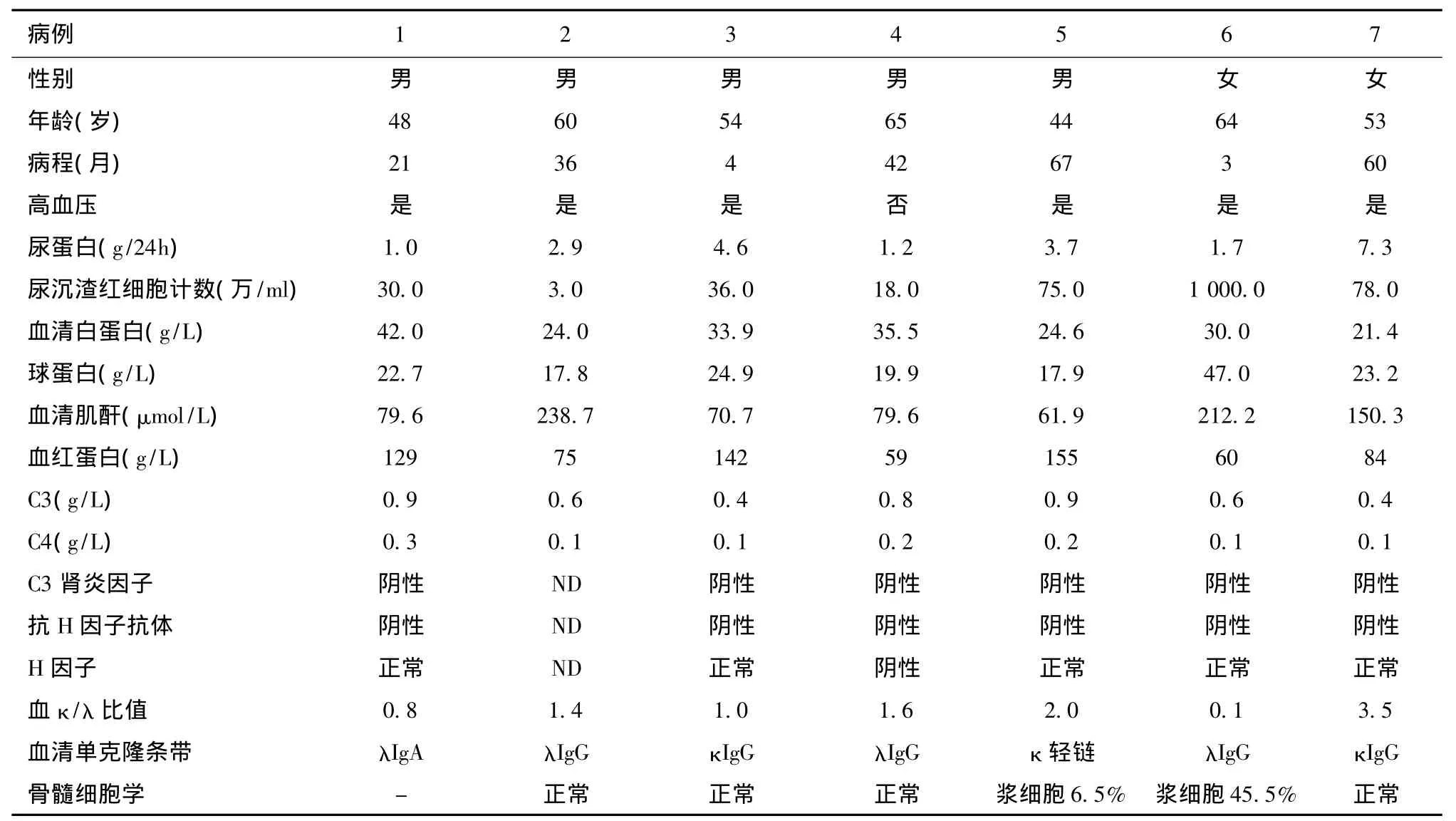
表1 7例患者肾活检时临床表现及实验室检查结果
补体及补体相关检查 C3水平下降4例,C4水平均正常,6例患者完善了C3肾炎因子、血清H因子及抗H因子抗体检查,结果均阴性(表1)。
单克隆球蛋白及血液系统相关评估 血清检测出的单克隆免疫球蛋白类型:λ型IgG 3例,κ型IgG 2例,λ型IgA 1例,κ轻链1例。所有患者均行血游离轻链检查,比值异常者2例。行骨髓细胞学检查者6例,其中浆细胞比例升高者 2例,分别为6.5%、45.5%(表1)。
肾活检病理
光镜 7例患者光镜均呈膜增生样病变,表现为肾小球系膜细胞及基质中重度增生,其中1例呈结节样变,2例伴新月体(表2)。特殊染色PASM-Masson下观察到内皮下及系膜区嗜复红物沉积者5例(图1A)。肾小管间质均表现为轻度慢性化病变,例6、例7伴中度急性病变,表现为肾小管上皮细胞刷状缘脱落、小管炎及间质较多炎性细胞浸润。

表2 7例患者肾活检病理情况
免疫荧光 6例仅见C3呈颗粒状弥漫分布于肾小管毛细血管袢及系膜区,1例伴IgG、IgM及C1q可疑阳性沉积(图1B)。患者肾组织κ、λ轻链染色均为阴性。
超微结构 电镜下观察到肾小球系膜区增宽、基质样物质增多,电子致密物无特殊结构,主要沉积于内皮下及系膜区(图1C),多数患者足突节段融合。2例患者内皮细胞病变明显,内皮下区域增宽、疏松,其中1例内皮下细小空泡、淋巴单核细胞浸润,1例为内皮下大量不定形物质沉积、基膜结构消失(图1D)。
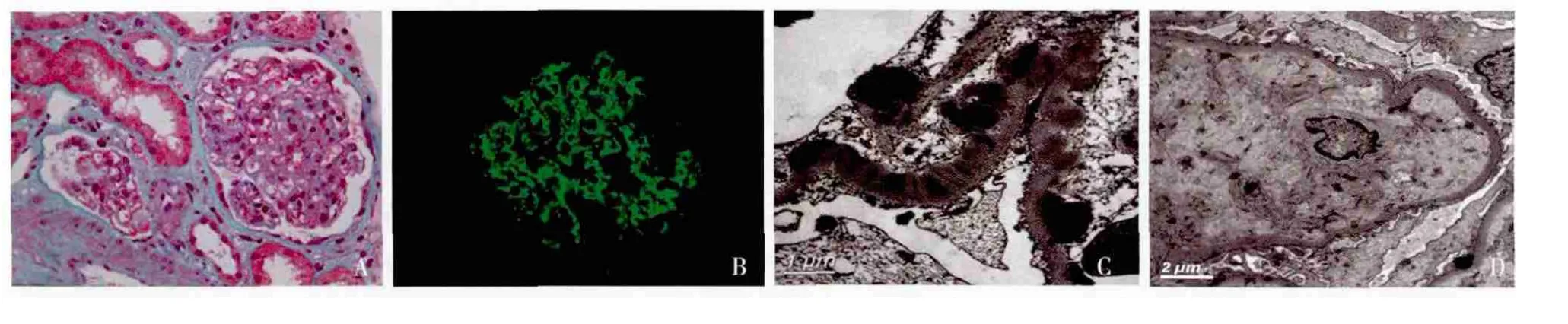
图1 A:肾小球内皮下、基膜内及系膜区较多嗜复红物沉积 (Masson三色,×400);B:C3++,呈颗粒状弥漫沉积于肾小球系膜区及血管袢(IF,×400);C:肾小球内皮下大量、基膜内及上皮侧少量电子致密物沉积(EM);D:肾小球内皮下大量不定形物质沉积、基膜结构消失(EM)
治疗及随访 行肾活检后,浆细胞异常的2例患者(例5、例6)接受沙利度胺联合地塞米松治疗,例5因合并肥胖、糖耐量减退、股骨头坏死,予沙利度胺100 mg/d、地塞米松减量至40 mg/月,治疗后肾脏病长期缓解,例6活检时肾功能已受损,血清尿素氮升高,因此仅予小剂量激素(地塞米松4 mg/隔日)联合沙利度胺100 mg/d治疗,后快速进展至终末期肾病;余5例患者接受雷公藤多苷和(或)糖皮质激素治疗,1例失随访,3例尿检改善,4例肾功能稳定(表3)。

表3 7例患者的治疗方案及疗效
讨 论
本研究对单克隆免疫球蛋白相关的C3肾炎的临床特征、血液学评估、肾脏病理及治疗随访进行了详尽描述,在国内属首次报道。本研究与Zand等[6]报道的病例相比,发病年龄、尿检、补体及肾活检病理相似,单克隆免疫球蛋白类型方面国内外存在不同(表4)。两组均有个别患者电镜下观察内皮细胞病变明显,内皮下区域增宽、疏松、大量不定形物质沉积、基膜结构消失,提示补体旁路途径调节异常除导致C3肾炎外,可能同时导致不典型溶血尿毒综合征。
单克隆免疫球蛋白导致C3肾病的具体机制尚不明确。早在1999年Jokiranta等[7]就报道发现,单克隆λ轻链可结合H因子的恒定区、从而抑制H因子活性、激活补体旁路途径。Bridoux等[3]报道的6例单克隆免疫球蛋白疾病相关的C3肾病的患者中,有1例血清抗H因子抗体阳性,Ladan等[6]统计的单克隆免疫球蛋白相关的C3肾炎中,有2例患者血清C3肾炎因子阳性。以上提示单克隆免疫球蛋白部分结构可能能与补体调节蛋白相结合,从而干扰补体旁路途径。

表4 本研究与文献报道的比较
梅奥临床中心Hill等[8]提出单克隆免疫球蛋白导致的肾脏病理损害类型,主要取决于单克隆免疫球蛋白的种类、分子结构及理化性质,其导致肾小球膜增生性病变可能的机制有:(1)直接机制:单克隆免疫球蛋白沉积于系膜区及血管袢,模拟免疫复合物,激活补体经典途径,其特征性免疫荧光为系膜区及血管袢可见单克隆免疫球蛋白沉积,同时可伴补体沉积;(2)间接机制:部分单克隆免疫球蛋白可能模拟补体调节蛋白或C3转化酶抗体,进而激活补体旁路途径,导致旁路途径的补体成分沉积于肾小球,诱发C3肾病。
关于单克隆免疫球蛋白相关的C3肾炎的治疗及预后报道不一。本研究中例5接受沙利度胺联合地塞米松化疗后尿检改善、肾功能稳定,例6尿检及肾功能均无改善,SCr进行性升高,考虑与患者浆细胞比例高、疾病活动明显相关。接受雷公藤多苷和(或)激素治疗5例患者中,1例失随访,3例尿检均改善,4例肾功能稳定。Zand等[6]报道的10例患者中,2例接受针对单克隆免疫球蛋白病化疗后(1例接受地塞米松联合硼替佐米,1例接受利妥昔单抗+环磷酰胺+长春新碱)血尿、蛋白尿及肾功能改善,4例接受激素加免疫抑制剂(硫唑嘌呤1例、环磷酰胺2例、霉酚酸酯1例)治疗后3例蛋白尿改善、肾功能稳定、1例快速进展至终末期肾病,4例接受保守治疗后2例尿检无缓解但肾功能稳定、2例肾功能恶化。Hill等[8]报道3例慢性粒细胞白血病导致的单克隆免疫蛋白相关的肾小球肾炎患者(C3肾炎2例、膜增生性肾炎1例)在接受氮芥及激素治疗后,尿检及肾功能均改善。
由此可见,免疫抑制治疗对部分此类患者有效,考虑可能与免疫抑制剂能够抑制肾小球局部的细胞增生及免疫炎症反应有关。但免疫抑制治疗并不能阻滞疾病发病的源头即单克隆免疫球蛋白病,因此依据此病的发病机制,笔者建议该病治疗的关键应为针对单克隆免疫球蛋白病。
小结:单克隆免疫球蛋白是C3肾炎发病的一重要诱因,临床医师应加强对此病的认识,完善相关检查,避免漏诊。该病好发于中老年患者,肾脏病理主要表现肾小球膜增生样病变,治疗及预后尚不明确,免疫抑制治疗有一定的疗效,但治疗的关键应为针对单克隆免疫球蛋白病。
1 Fakhouri F,Frémeaux-Bacchi V,Noël LH,et al.C3 glomerulopathy:a new classification.Nat Rev Nephrol,2010,6(8):494-499.
2 Pickering M,Cook HT.Complement and glomerular disease:new insights.Curr Opin Nephrol Hypertens,2011,20(3):271-277.
3 Bridoux F,Desport E,Frémeaux-Bacchi V,et al.Glomerulonephritis with isolated C3 deposits and monoclonal gammopathy:a fortuitous association?Clin J Am Soc Nephrol,2011,6(9):2165-2174.
4 Sethi S, Zand L, Leung N, et al. Membranoproliferative glomerulonephritis secondary to monoclonal gammopathy.Clin J Am Soc Nephrol,2010,5(5):770-782.
5 Sethi S,Sukov WR,Zhang Y,et al.Dense deposit disease associated with monoclonal gammopathy of undetermined significance.Am J Kidney Dis,2010,56(5):977-982.
6 Zand L,Kattah A,FervenzaFC,etal.C3 glomerulonephritis associated with monoclonal gammopathy:a case series.Am J Kidney Dis,2013,62(3):506-514.
7 Jokiranta TS,Solomon A,Pangburn MK,et al.Nephritogenic lambda lightchain dimer:a unique human miniautoantibody against complement factor H.J Immunol,1999,163(8):4590-4596.
8 HillPA,Firkin F,DwyerKM,etal.Membranoproliferative glomerulonephritis in association with chronic lymphocytic leukaemia:a report of three cases.Pathology,2002,34(2):138-143.

