饲料胆碱含量对斜带石斑鱼生长性能、体成分、肝脏胆碱含量及脂肪代谢酶活性的影响
覃笛根 董晓慧,2* 谭北平,2 杨奇慧 迟淑艳
刘泓宇1 章 双1 陈效儒3
(1.广东海洋大学水产学院,水产动物营养与饲料实验室,湛江524088;2.南海生物资源开发与利用协同创新中心,广州510275;3.通威股份有限公司,成都610041)
饲料胆碱含量对斜带石斑鱼生长性能、体成分、肝脏胆碱含量及脂肪代谢酶活性的影响
覃笛根1董晓慧1,2*谭北平1,2杨奇慧1迟淑艳1
刘泓宇1章 双1陈效儒3
(1.广东海洋大学水产学院,水产动物营养与饲料实验室,湛江524088;2.南海生物资源开发与利用协同创新中心,广州510275;3.通威股份有限公司,成都610041)
本试验旨在研究饲料胆碱含量对斜带石斑鱼生长性能、体成分、肝脏胆碱含量及脂肪代谢酶活性的影响,并确定斜带石斑鱼对饲料中胆碱的需要量。在基础饲料中分别添加0、680、1 361、2 041、2 721和4 082 mg/kg的氯化胆碱,配制6种试验饲料,试验饲料中胆碱实际含量分别为8.1(对照)、602.5、1 119.0、1 511.5、1 970.0和4 029.0 mg/kg,投喂360尾平均体重为(87.85±0.04) g的斜带石斑鱼10周。每种饲料设3个重复,每个重复放养20尾鱼。结果表明:1 119.0 mg/kg组的特定生长率、蛋白质效率最高,饲料系数最低;对照组的成活率显著低于其他各添加组(P<0.05)。饲料胆碱含量对全鱼水分和粗蛋白质含量无显著影响(P>0.05);4 029.0 mg/kg组的全鱼粗脂肪含量显著高于对照组(P<0.05);对照组的全鱼粗灰分含量与各胆碱添加组差异不显著(P>0.05)。肝脏胆碱含量随饲料胆碱含量的增加呈先升高后稳定趋势,且在1 511.5 mg/kg组有最大值。随饲料胆碱含量的增加,肝脏脂蛋白脂酶和总脂酶活性呈上升趋势,肝脏脂肪酸合成酶活性先下降后趋于稳定;肝脏肝脂酶活性不受饲料胆碱含量的显著影响(P>0.05)。以特定生长率和肝脏胆碱含量为评价指标进行折线模型分析得出,斜带石斑鱼对饲料中胆碱的需要量分别为1 093.7和1 579.7 mg/kg饲料。
斜带石斑鱼;胆碱;生长;体组成;需要量;脂肪代谢
对绝大多数动物而言,胆碱是饲料中必不可少的维生素之一[1],可防止脂肪在肝脏中的异常蓄积,对动物脂肪的沉积和转运起着十分重要的作用,具有“抗脂肪肝因子”之称[2-3]。胆碱具有以下几个生理功能:1)胆碱是合成各种磷脂(卵磷脂、脑磷脂、神经磷脂)所必需的前体,构成细胞膜和脂蛋白,维持细胞正常结构和功能[4-5];2)在神经组织中,胆碱与神经传导密不可分,是合成乙酰胆碱的重要组成成分,在神经信号传递中起重要作用[6];3)胆碱在代谢中与蛋氨酸和甜菜碱类似,可提供生物化学过程所需的甲基[7]。
在小白鼠和其他动物的养殖试验中发现,胆碱缺乏会诱发脂肪肝,血浆脂类含量显著降低[8]。国外学者研究发现,投喂缺乏胆碱的饲料可导致鲟鱼(Acipensertransmontanus)血浆总脂、甘油三酯、总胆固醇和磷脂含量降低[6]。生长迟缓、饲料效率低、脂肪肝、高死亡率以及厌食等胆碱缺乏症在鲤(Cyprinuscarpio)[9]、湖鳟(Salvelinusnamaycush)[9]和虹鳟(Oncorhynchusmykiss)[9]等水产动物上均有报道。国内学者对罗非鱼(Oreochromisniloticus×O.aureus)和黄鳝(Monopterualbus)等进行了研究,当饲料中缺乏胆碱时,罗非鱼[10]和黄鳝[11]均出现了生长不良、厌食和肝脏脂肪含量升高等胆碱缺乏症。此外,饲料效率低、肝脏脂肪浸润以及血浆总脂、甘油三酯、胆固醇和磷脂含量降低等相关胆碱缺乏症在草鱼的研究中也有报道[12-13]。因此,对于大多数动物而言,胆碱是一种必需营养素。
斜带石斑鱼(Epinepheluscoioides)隶属鲈形目(Perciformes),鲈亚目(Perwidei),鳍科(Serranidae),石斑鱼属(Epinephelus),全世界约100多种,是暖水性中下层的肉食性名贵鱼类之一。石斑鱼分布于北太平洋的西部,我国常见于南海[14],因其营养丰富、肉质鲜嫩、生长快、经济价值高等优点而备受养殖户和消费者喜爱,被认为是精养条件下最具养殖前景的鱼类之一。尽管斜带石斑鱼的胆碱需要量已部分见诸报道[15],但仍缺乏较为系统的研究,不能全面反映其对胆碱的需求状况。
本试验主要探讨在饲料中添加胆碱(以氯化胆碱形式)对斜带石斑鱼生长、体成分、肝脏胆碱蓄积量以及相关脂肪代谢酶活性的影响,通过相关指标的测定,寻求斜带石斑鱼饲料中胆碱最适添加量,为胆碱在鱼类饲料中的合理使用提供依据。
1 材料与方法
1.1 试验饲料
本试验以脱维酪蛋白、白鱼粉和明胶为蛋白质源,玉米油和鱼油为脂肪源,玉米淀粉为糖源,微晶纤维素为填充剂配制基础饲料,其组成及营养水平见表1。在基础饲料中分别添加0、680、1 361、2 041、2 721和4 082 mg/kg的氯化胆碱(固体试剂,纯度≥98%),配制成6种试验饲料,试验饲料中胆碱含量(实测值)分别为8.1(对照)、602.5、1 119.0、1 511.5、1 970.0和4 029.0 mg/kg。所有原料粉碎后过60目筛,按配方比例混合均匀,少量组分采用逐级扩大法混合,然后加入预先混合好的鱼油和玉米油,将油脂微小颗粒手工搓散,放入V型立式混合机中混合均匀,缓慢加入所配饲料质量30%~40%的水后再次混匀,用F-26型双螺杆挤条机(华南理工大学)加工成粒径为3 mm的颗粒饲料,室温下待其风干至水分含量约为10%,封口袋分装并储存于-20 ℃冰箱中备用。
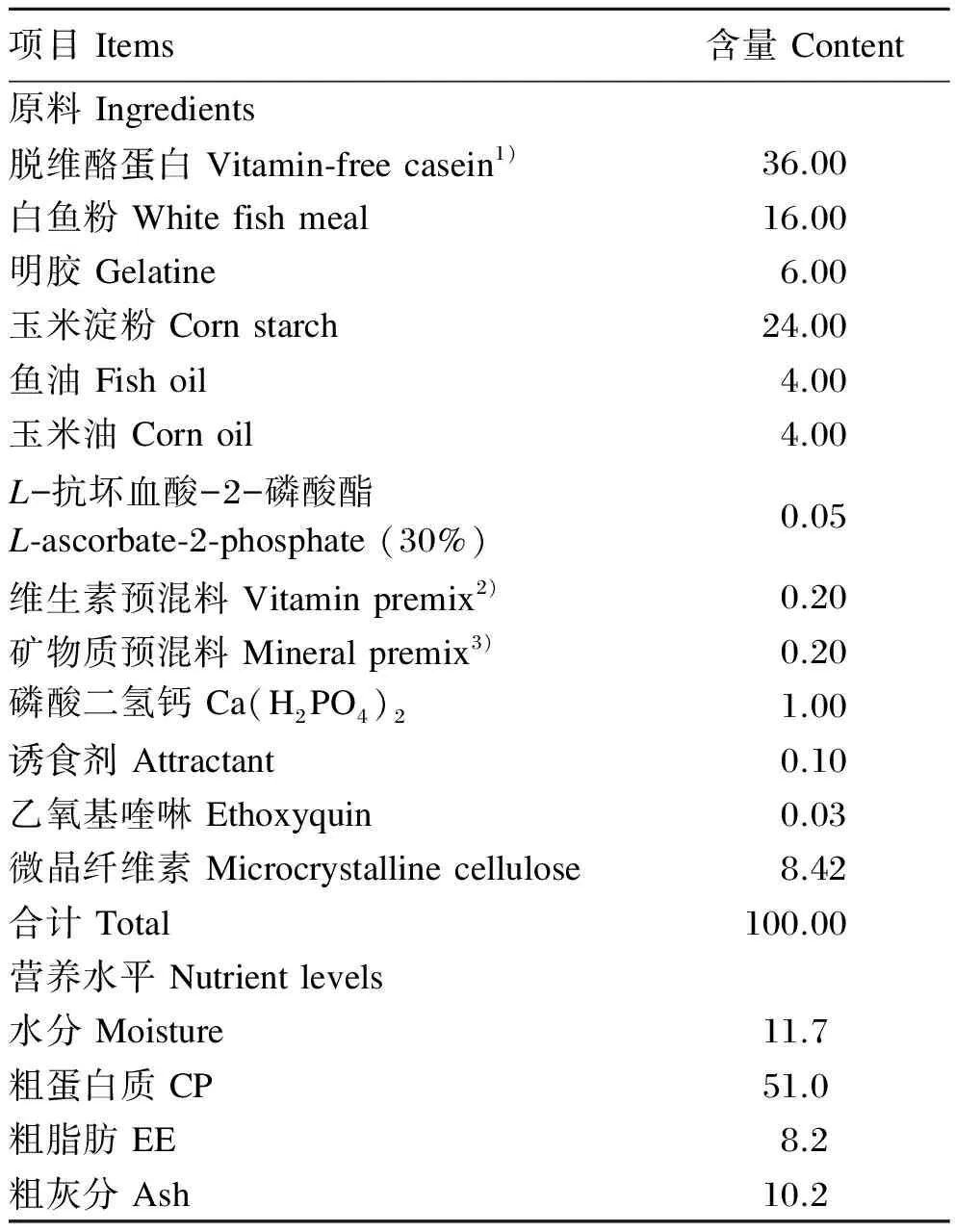
表1 基础饲料组成及营养水平(风干基础)
1)脱维酪蛋白(CP 94%)购自美国Sigma公司Vitamin-free casein (CP 94%) obtained from Sigma Co., USA。
2)维生素预混料为每千克饲料提供The vitamin premix provided the following per kg of the diet:硫胺素 thiamine 25.5 mg,核黄素 riboflavin 25 mg,吡哆醇 pyridoxine 50 mg,氰钴胺素 cyanocobalamine 0.1 mg,叶酸 folic acid 6.25 mg,泛酸钙 calcium pantothenate 61 mg,肌醇 inositol 800 mg,烟酸 niacin 201 mg,生物素 biotin 2.5 mg,VA 10 mg,VD 120 mg,VE 99 mg,VK 10 mg,纤维素 cellulose 589.65 mg。
3)矿物质预混料为每千克饲料提供The mineral premix provided the following per kg of the diet:KIO40.06 mg,CoCl2·6H2O 8.14 mg,CuSO4·5H2O 39.68 mg,柠檬酸铁 ferric citrate 27.42 mg,ZnSO4·7H2O 56.56 mg,MnSO4·7H2O 0.24 mg,Ca(PO4)2160 mg,MgSO4·H2O 24.86 mg,KCl 30.66 mg,NaSeO34 mg,沸石粉 zeolite powder 1 648.38 mg。
1.2 试验用鱼与养殖管理
试验用鱼购于海南省文昌市某石斑鱼苗场。试验开始前,以商业饲料(青岛七好饲料,含50%粗蛋白质)饱食投喂至所需规格,分组前1周改投基础饲料。
试验于广东海洋大学东海岛海洋生物研究基地的室内循环水养殖系统中进行。试验鱼禁食24 h后,挑选规格一致[平均体重(87.85±0.04) g]、体格健壮的斜带石斑鱼,根据试验设计,共设6个组,每个组设3个重复,每个重复1个1 m3玻璃钢桶,每桶放20尾鱼,饲养周期为10周。饲养期间,每天饱食投喂2次(08:30、16:30),根据天气和摄食情况调整投喂量。养殖期间不间断充气,水温(30.5±0.8) ℃,溶解氧浓度5~6 mg/L,盐度28~32,水体氨氮含量<0.2 mg/L;视水质情况每天换水或隔天换水,换水量为60%~70%。
1.3 样品采集及分析
1.3.1 样品采集
养殖试验结束禁食24 h后将各桶试验鱼全部捞出,以丁香酚(1∶10 000)麻醉,称重并计数,计算生长性能指标。每桶随机取10尾,分离肝脏,分装于防冻管中置于-80 ℃冰箱保存,用于肝脏胆碱含量和脂肪代谢酶活性测定;再从每桶中另随机取4尾,分装于封口袋中于-20 ℃保存,用于全鱼常规营养成分分析。
1.3.2 饲料和全鱼常规营养成分测定
饲料和全鱼常规营养成分测定采用AOAC(1995)[16]方法进行。其中,水分含量采用105 ℃干燥法测定;粗蛋白质含量采用凯氏定氮法测定;粗脂肪含量采用索氏抽提法测定;粗灰分含量采用550 ℃马福炉灼烧法测定。饲料和肝脏中胆碱含量测定参考Venugopal[17]的方法。
1.3.3 脂肪代谢酶活性测定
肝脏肝脂酶(hepatic lipase,HL)、脂蛋白脂酶(lipoprotein lipase,LPL)活性测定样品制备:称取肝脏组织适量,并记下其准确重量,按重量(g)∶体积(mL)=1∶9的比例加入9倍体积生理盐水,冰水浴条件下匀浆,制成10%组织匀浆液,2 500 r/min、4 ℃条件下离心15 min,小心吸取上清液分装,置于-80 ℃冰箱保存待测。
肝脏脂肪酸合成酶(fatty acid synthetase,FAS)活性测定样品制备:参考Utter等[18]的方法,并适当修正。在2 mL预冷的0.25 mol/L蔗糖与1 mmol/L乙二胺四乙酸二钠(EDTA-2Na)混合液中剪取1 g肝脏,匀浆后,12 000 r/min、4 ℃条件下离心60 min。小心吸取上清液,用0.25 mol/L蔗糖和1 mmol/L EDTA-2Na混合液稀释3倍后分装,置-80 ℃冰箱保存备测。
用南京建成生物工程研究所的试剂盒测定肝脏肝脂酶、脂蛋白脂酶和脂肪酸合成酶活性,测定方法严格参照说明书进行。按照以下公式计算总脂酶(total lipase,TL)活性:
总脂酶=肝脂酶+脂蛋白脂酶。
1.4 生长性能指标计算公式
成活率(survival rate,SR,%)=100×
终末鱼尾数/初始鱼尾数;
特定生长率(specific growth rate,SGR,%/d)=
100×(ln终末体重-ln初始体重)/试验天数;
饲料系数(feed conversion ratio,FCR)=
饲料摄入量/(终末体重-初始体重);
蛋白质效率(protein efficiency rate,PER)=
鱼体增重/(饲料摄入量×饲料粗蛋白质含量)。
1.5 数据处理
试验结果用平均值±标准差(mean±SD)表示,数据采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),组间若有显著性差异,再进行Duncan氏法多重比较检验,P<0.05表示差异显著,采用折线模型计算得出斜带石斑鱼对饲料中胆碱的需要量。
2 结 果
2.1 饲料胆碱含量对斜带石斑鱼生长性能的影响
由表2可知,对照组的成活率显著低于各胆碱添加组(P<0.05),各胆碱添加组之间差异不显著(P>0.05);1 119.0 mg/kg组的饲料系数最低,显著低于1 511.5和1 970.0 mg/kg组(P<0.05),与其他间差异不显著(P>0.05);1 119.0 mg/kg组的特定生长率最高,与1 511.5 mg/kg组差异不显著(P>0.05),但显著高于其他各组(P<0.05);1 119.0 mg/kg组的蛋白质效率最高,显著高于其他各组(P<0.05)。
饲料胆碱含量(x)与斜带石斑鱼特定生长率(y)的关系如图1所示,经折线模型拟合后得:y=0.000 2x+1.152 8(R2=0.996 3)和y=-0.000 1x+1.480 9(R2=0.918 4)。以特定生长率为评价指标,斜带石斑鱼对饲料中胆碱的需要量为1 093.7 mg/kg饲料。
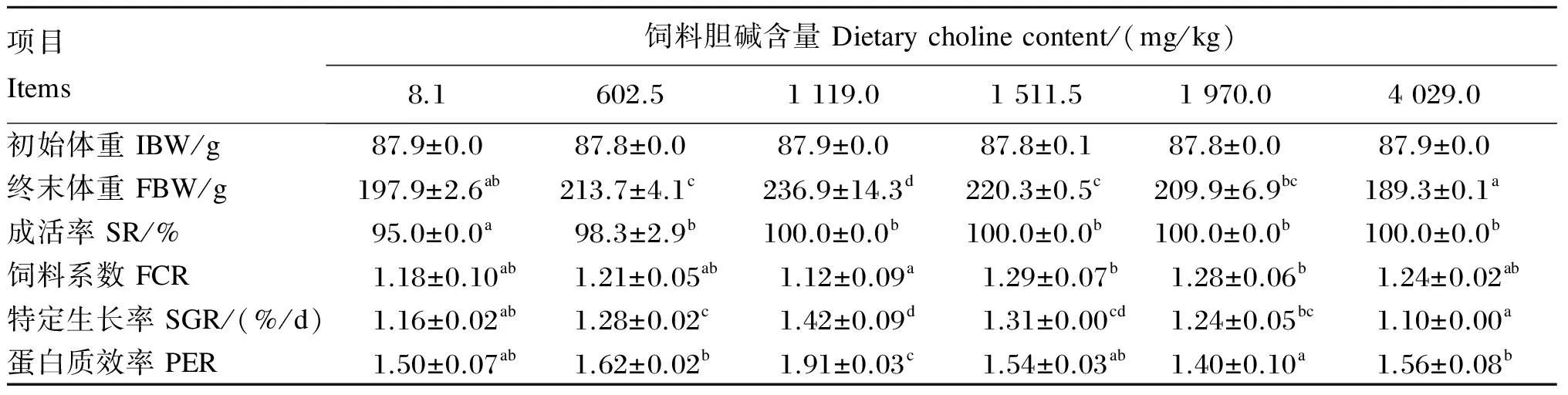
表2 饲料胆碱含量对斜带石斑鱼生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05). The same as below.

图1 饲料胆碱含量与斜带石斑鱼特定生长率关系的折线模型分析
2.2 饲料胆碱含量对斜带石斑鱼体成分和肝脏胆碱含量的影响
由表3可以看出,饲料胆碱含量对斜带石斑鱼全鱼水分和粗蛋白质含量无显著影响(P>0.05)。全鱼粗脂肪含量随饲料胆碱含量的增加基本呈上升趋势,在4 029.0 mg/kg组有最大值,且显著高于除1 511.5 mg/kg组以外的其他各组(P<0.05)。1 119.0 mg/kg组的全鱼粗灰分含量显著高于602.5 mg/kg组(P<0.05),与其他各组差异不显著(P>0.05)。随饲料胆碱含量的增加,肝脏胆碱含量先上升后趋于稳定,并在1 511.5 mg/kg组有最大值。当饲料胆碱含量超过1 511.5 mg/kg后,肝脏胆碱含量无显著变化(P>0.05)。
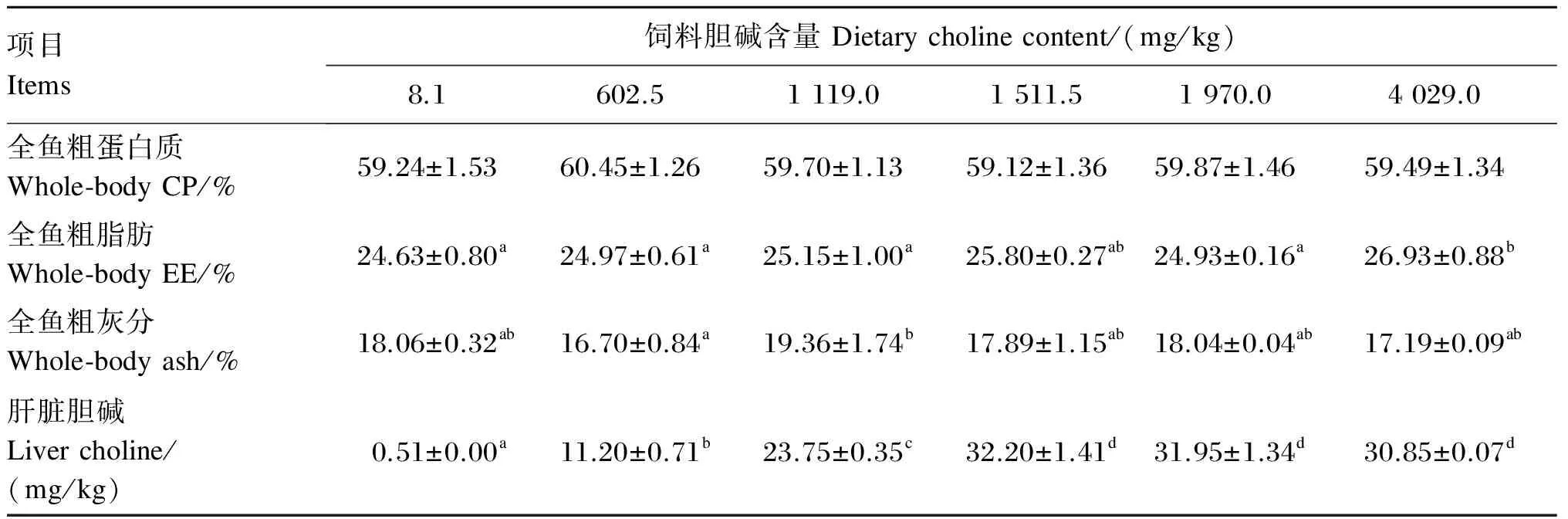
表3 饲料胆碱含量对斜带石斑鱼体成分和肝脏胆碱含量的影响(干物质基础)
饲料胆碱含量(x)与斜带石斑鱼肝脏胆碱含量(y)的关系如图2所示,经折线模型拟合后得:y=33.008(R2=1.000 0)和y=0.021 3x-0.639 2(R2=0.994 6)。以肝脏胆碱含量为评价指标,斜带石斑鱼对饲料中胆碱的需要量为1 579.7 mg/kg饲料。
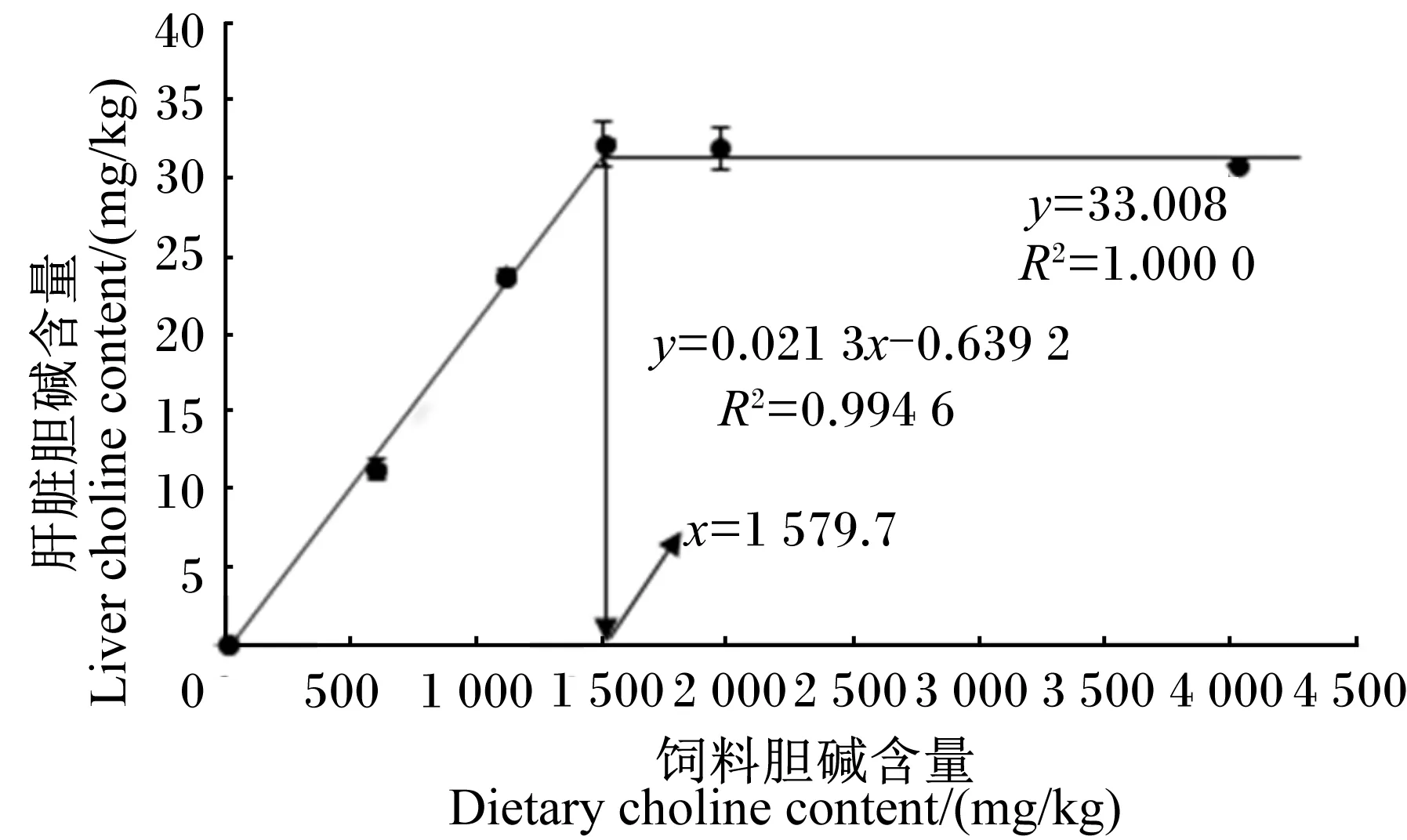
图2 饲料胆碱含量与肝脏胆碱含量关系的折线模型分析
2.3 饲料胆碱含量对斜带石斑鱼肝脏脂肪代谢酶活性的影响
由表4可以看出,肝脏脂蛋白脂酶和总脂酶活性随胆碱含量的增加呈先上升后降低趋势,与对照组相比,1 970.0 mg/kg组的脂蛋白脂酶和总脂酶活性增幅分别为74.48%和43.95%,差异显著(P<0.05);肝脏脂肪酸合成酶活性在602.5 mg/kg组有最大值,但随着胆碱的继续添加,脂肪酸合成酶活性呈下降趋势,在4 029.0 mg/kg组有最低值,较602.5 mg/kg组降幅达34.05%(P<0.05);尽管肝脏肝脂酶活性随饲料胆碱含量的增加而增加,但组间差异不显著(P>0.05)。
3 讨 论
3.1 饲料胆碱含量对斜带石斑鱼生长性能的影响
已有研究表明,胆碱对养殖动物生长具有重要的促进作用。Nesheim等[19]在产蛋鸡的研究中发现,在胆碱含量低的纯合饲粮中添加胆碱可显著提高产蛋鸡体重、产蛋水平,且降低肝脏脂肪含量。摄食添加胆碱的饲粮可显著降低黄羽肉鸡的死亡率[20],提高肉仔鸡的日增率和饲料转化率[21],在仔猪[22]的研究中也得出类似的结果。

3.2 饲料胆碱含量对斜带石斑鱼体成分和肝脏胆碱含量的影响
在本试验中,饲料胆碱含量对斜带石斑鱼全鱼的水分和粗蛋白质含量无显著影响,这与异育银鲫[30]、军曹鱼[27]的研究结果相同,但与大菱鲆(ScophthalmusmaximusL.)[32]的研究结果存在差异;全鱼粗脂肪含量随饲料胆碱含量的增加基本呈上升趋势,尽管在1 970.0 mg/kg组出现了下降趋势,但高剂量胆碱的添加仍然使全鱼粗脂肪含量上升,类似的结果在黄鲈[7]的研究中也有报道。在其他的研究中发现,饲料胆碱的添加显著降低草鱼(Ctenopharyngodonidella)[33]、大口黑鲈(Micropterussalmoide)[34]的全鱼粗脂肪含量,但军曹鱼[27]的全鱼粗脂肪含量不受饲料胆碱含量的影响。Craig[35]报道,饲料中添加胆碱可促进美国红鱼肝脏中脂肪动员并向肌肉转运。但到目前为止,饲料胆碱含量影响机体内脂肪分布的机理研究鲜有报道。
在本试验中,全鱼粗灰分含量随饲料胆碱含量的增加先上升后下降并趋于稳定,饲料胆碱含量在8.1~1 119.0 mg/kg之间时全鱼粗灰分含量显著上升,而当胆碱含量超过1 119.0 mg/kg后,全鱼粗灰分含量不再发生显著变化。另有研究发现,黄鲈全鱼粗灰分含量随饲料胆碱含量的增加显著降低[7],而星斑川鲽(Platichthysstellatus)[36]、建鲤[24]和团头鲂(Megalobramaamblycephala)[37]的全鱼粗灰分含量不受饲料胆碱含量的影响。

3.3 饲料胆碱含量对斜带石斑鱼肝脏脂肪代谢酶活性的影响
脂肪酸合成酶是脂肪酸合成过程中的关键酶,能催化丙二醛辅酶A(malonyl CoA)和乙酰辅酶A(acetyl coenzyme A)生成长链脂肪酸,从而合成甘油三酯。脂肪酸合成酶的多少和活性的高低对动物体脂沉积具有重要意义[39]。大量研究表明,机体组织中脂肪酸合成酶活性与脂肪调控间存在重要联系,脂肪酸合成酶的活性与体脂水平呈显著正相关[39-41]。对于鱼类而言,肝脏是脂肪酸合成的主要器官[42]。然而,胆碱对鱼类脂肪酸合成酶活性的影响鲜有报道,从本试验结果可以看出,肝脏脂肪酸合成酶活性随饲料胆碱含量的增加先降低后趋于稳定,表明胆碱可抑制肝脏脂肪酸合成酶的活性,在一定程度上可以抑制肝脏脂肪的合成。此外,胆碱对脂肪有亲合力,可促进脂肪以磷脂形式由肝脏通过血液输送出去或改善脂肪酸本身在肝脏中的利用,防止脂肪在肝脏里的异常积聚,但高剂量的胆碱势必会导致肝脏超负荷运转,导致肝脏损伤,因而致使脂肪分解相关酶的分泌量减少。
已有研究证实,肝脏是鱼类脂肪酸β-氧化代谢的重要部位,同时也是鱼类随营养状况而改变脂肪蓄积的主要调节性贮脂器官[39]。机体脂肪主要的分解酶是总脂酶,包括脂蛋白脂酶和肝脂酶。其中,脂蛋白脂酶存在于肝外组织毛细血管内表皮细胞,主要催化血浆中乳糜微粒(chylomicron,CM)和极低密度脂蛋白(very low density lipoprotein,VLDL)中的甘油三酯水解,产生甘油并释放出游离脂肪酸,在乳糜微粒和极低密度脂蛋白的降解中发挥重要作用[43];肝脂酶在肝脏中合成,可促进低密度脂蛋白胆固醇(low-density lipoprotein cholesterin,LDL-C)和乳糜微粒残粒进入肝细胞,并直接参与高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)的逆转运及其残粒的分解[44]。朱瑞俊等[33]在草鱼的研究中发现,氯化胆碱添加量为0.4%或0.6%时,肝脏肝脂酶活性显著高于对照组,0.6%氯化胆碱的添加可显著提高肝脏脂蛋白脂酶活性;另有研究发现,饲料中添加适量胆碱可显著提高吉富罗非鱼肝脏总脂酶的活性[45]。在本试验中,斜带石斑鱼肝脏脂肪酸合成酶活性的降低减慢了鱼类机体脂肪合成的速率,脂肪合成缓慢。此外,肝脏总脂酶活性随饲料胆碱含量的增加呈上升趋势,总脂酶活性的升高使血液中脂类物质的量减少,使得脂肪合成的原料减少;此外,高活性的总脂酶还可以促进肝脏脂肪的降解,在一定程度上防止肝脏脂肪的沉积。
4 结 论
① 饲料中适量胆碱的添加可提高斜带石斑鱼的生长性能,提高肝脏脂肪分解酶——总脂酶和脂蛋白脂酶的活性,降低鱼体脂肪沉积。
② 以特定生长率和肝脏胆碱含量为评价指标,通过折线回归模型得出斜带石斑鱼对饲料中胆碱的需要量分别为1 093.7和1 579.7 mg/kg饲料。
[1] NRC.Nutrient requirements of fish[S].Washington,D.C.:National Academic Press,1993.
[2] DING L Y,ZHANG L M,WANG J Y,et al.Effect of dietary lipid level on the growth performance,feed utilization,body composition and blood chemistry of juvenile starry flounder (Platichthysstellatus)[J].Aquaculture research,2010,41(10):1470-1478.
[3] ZEISEL S H.Choline:an important nutrient in brain development,liver function and carcinogenesis[J].Journal of the American College of Nutrition,1992,11(5):473-481.
[4] BLUSZTAJN J K.Choline,a vital amine[J].Science,1998,281(5378):794-795.
[5] MEHTA A K,SINGH B P,ARORA N,et al.Choline attenuates immune inflammation and suppresses oxidative stress in patients with asthma[J].Immunobiology,2010,215(7):527-534.
[6] HUNG S S O.Choline requirement of hatchery-produced juvenile white sturgeon (Acipensertransmontanus)[J].Aquaculture,1989,78(2):183-194.
[7] TWIBELL R G,BROWN P B.Dietary choline requirement of juvenile yellow perch (Percaflavescens)[J].The Journal of Nutrition,2000,130(1):95-99.
[8] LUCAS C G.Transmithylation and biosynthesis of the methyl group,progress in chemistry of fats and other lipids[M].London:Pergamon Press,1967.
[9] KETOLA H G.Choline metabolism and nutritional requirement of lake trout (Salvelinusnamaycush)[J].Journal of Animal Science,1976,43(2):474-477.
[10] 黄凯,杨鸿昆,甘晖,等.饲料中添加胆碱预防罗非鱼脂肪肝病变的作用[J].中国水产科学,2007,14(2):257-262.
[11] 杨代勤,陈芳,阮国良.饲料中添加胆碱对黄鳝生长、组织脂肪含量及消化酶活性的影响[J].水产学报,2006,30(5):676-682.
[12] 王道尊,赵亮,谭玉钧.草鱼鱼种对胆碱需要量的研究[J].水产学报,1995,19(2):133-139.
[13] 曹俊明,林鼎,薛华,等.四种抗脂肪肝物质降低草鱼肝胰脏脂质积累的替代关系[J].水生生物学报,1999,23(2):102-111.
[14] RUSSELL B C,HOUSTON W.Offshore fishes of the Arafura sea[J].Beagle:Records of the Museums and Art Galleries of the Northern Territory,1989,6:69-84.
[15] 阳会军,田丽霞,黄俊娃,等.石斑鱼的营养需求及饲料营养参数[J].广东饲料,2010,19(4):29-34.
[16] AOAC.Official methods of analysis of AOAC International[S].16th ed.Arlington,VA:Association of Analytical Chemists,1995.
[17] VENUGOPAL P B.Choline[M]//AUGUSTIN J,KLEIN B P,BECKER D,et al.Methods of vitamin assay.New York:John Wiley and Sons,1985:555-573.
[18] UTTER M F,KEECH D B.Pyruvate carboxylase Ⅰ.Nature of the reaction[J].The Journal of Biological Chemistry,1963,238(8):2603-2608.
[19] NESHEIM M C,NORVELL M J,CEBALLOS E,et al.The effect of choline supplementation of diets for growing pullets and laying hens[J].Poultry Science,1971,50(3):820-831.
[20] 郭吉余,林映才,蒋守群,等.大豆磷脂与胆碱对黄羽肉鸡生长性能、胴体品质、营养消化率、血清指标的影响[C]//王恬,刘建新.中国畜牧兽医学会动物营养学分会:第四届全国饲料营养学术研讨会论文集.南京:中国畜牧兽医学会动物营养学分会,2002:45.
[21] 陈承祯.烟酰胺.胆碱对肉仔鸡生长性能及脂肪代谢的影响[D].硕士学位论文.长春:中国人民解放军军需大学,2002.
[22] NEUMANN A L,KRIDER J L,JAMES M F,et al.The choline requirement of the baby pig[J].The Journal of Nutrition,1949,38(2):195-213.
[23] WILSON R P,POE W E.Choline nutrition of fingerling channel catfish[J].Aquaculture,1988,68(1):65-71.
[24] WU P,FENG L,KUANG S Y,et al.Effect of dietary choline on growth,intestinal enzyme activities and relative expressions of target of rapamycin and eIF4E-binding protein 2 gene in muscle,hepatopancreas and intestine of juvenile Jian carp (Cyprinuscarpiovar.Jian)[J].Aquaculture,2011(1/2/3/4):107-116.
[25] GRIFFIN M E,WILSON K A,WHITE M R,et al.Dietary choline requirement of juvenile hybrid striped bass[J].The Journal of Nutrition,1994,124(9):1685-1689.
[26] CRAIG S R,GATLIN D M.Dietary choline requirement of juvenile red drum (Sciaenopsocellatus)[J].The Journal of Nutrition,1996,126(6):1696-1700.
[27] MAI K S,XIAO L D,AI Q H,et al.Dietary choline requirement for juvenile cobia,Rachycentroncanadum[J].Aquaculture,2009,289(1/2):124-128.
[28] 张玲,张卫东,张小玲,等.氯化胆碱、肌醇和胆汁酸对鲤鱼生长、血清生化及免疫指标的影响[J].饲料工业,2008,29(22):14-16.

[30] 段元慧,朱晓鸣,韩冬,等.异育银鲫幼鱼对饲料胆碱最适需求量的研究[C]//中国水产学会:2009年中国水产学会学术年会论文摘要集.海口:中国水产学会,2009:121.
[31] SHIAU S Y,LO P S.Dietary choline requirements of juvenile hybrid tilapia,Oreochromisniloticus×O.aureus[J].The Journal of Nutrition,2000,130(1):100-103.
[32] 李华.半滑舌鳎维生素C及牙鲆、大菱鲆胆碱营养生理研究[D].硕士学位论文.青岛:中国海洋大学,2011.
[33] 朱瑞俊,李小勤,谢骏,等.饲料中添加氯化胆碱对草鱼成鱼生长、脂肪沉积和脂肪代谢酶活性的影响[J].中国水产科学,2010,17(3):527-535.
[34] 周明.饲料中添加胆碱和卵磷脂对大口黑鲈生长、体组成和肝脏的影响[D].硕士学位论文.广州:中山大学,2007.
[35] CRAIG S R,GATLIN D M.Growth and body composition of juvenile red drum (Sciaenopsocellatus) fed diets containing lecithin and supplemental choline[J].Aquaculture,1997,151(1/2/3/4):259-267.
[36] 帅继祥,张利民,王际英,等.星斑川鲽幼鱼胆碱需求量的研究[J].水生生物学报,2011,35(2):365-371.
[37] JIANG G Z,WANG M,LIU W B,et al.Dietary choline requirement for juvenile blunt snout bream,Megalobramaamblycephala[J].Aquaculture Nutrition,2013,19(4):499-505.
[38] ZHANG Z,WILSON R P.Reevaluation of the choline requirement of fingerling channel catfish (Ictaluruspunctatus) and determination of the availability of choline in common feed ingredients[J].Aquaculture,1999,180(1/2):89-98.
[39] LOFTUS T M,JAWORSKY D E,FREHYWOT G L,et al.Reduced food intake and body weight in mice treated with fatty acid synthase inhibitors[J].Science,2000,288(5475):2379-2381.
[40] 熊文中,杨凤,周安国.猪重组生长激素对不同杂交肥育猪脂肪代谢调控的研究[J].畜牧兽医学报,2001,32(1):1-4.
[41] 田维熙,董妍,权晖,等.不同生长期蛋鸡的体脂水平和肝脏脂肪酸合成酶活性的关系[J].生物化学杂志,1996,12(2):234-236.
[42] GREENE D H S,SELIVONCHICK D P.Lipid metabolism in fish[J].Progress in Lipid Research,1987,26(1):53-85.
[43] 张晓刚.肝脂酶与脂蛋白代谢[J].国外医学:临床生物化学与检验学分册,2002,23(1):48-49.
[44] CHOI S Y,GOLDBERG I J,CURTISS L K,et al.Interaction between ApoB and hepatic lipase mediates the uptake of ApoB-containing lipoproteins[J].Journal of Biological Chemistry,1998,273(32):20456-20462.
[45] 刘康.饲料脂肪和胆碱水平对吉富罗非鱼幼鱼生长性能及生理机能的影响[D].硕士学位论文.南宁:广西大学,2014.
*Corresponding author, professor, E-mail: dongxiaohui2003@163.com
(责任编辑 菅景颖)
Effects of Dietary Choline Content on Growth Performance,Body Composition, and Choline Content and Lipid Metabolism Enzyme Activities in Liver of Orange-Spotted Grouper (Epinepheluscoioides)
QIN Digen1DONG Xiaohui1,2*TAN Beiping1,2YANG Qihui1CHI Shuyan1LIU Hongyu1ZHANG Shuang1CHEN Xiaoru3
(1.LaboratoryofAquaticAnimalNutritionandFeed,CollegeofFisheries,GuangdongOceanUniversity,Zhanjiang524088,China; 2.SouthChinaSeaBio-ResourceExploitionandUtilizationCollaborativeInnovationCenter,Guangzhou510275,China; 3.TongweiCo.,Ltd.,Chengdu610041,China)
A 10-week feeding trial was carried out to investigate the effects of dietary choline content on growth performance, body composition, and choline content and lipid metabolism enzyme activities in liver of orange-spotted grouper (Epinepheluscoioides). Choline chloride was added to the basal diet to formulate six experimental diets with the adding levels were 0, 680, 1 361, 2 041, 2 721 and 4 082 mg/kg, which contained 8.1 (control), 602.5, 1 119.0, 1 511.5, 1 970.0 and 4 029.0 mg/kg (all were measured values) choline, respectively. Each diet was randomly assigned to three replicates and each replicate had 20 fish [average body weight of (87.85±0.04) g]. Results showed that the maximum specific growth rate and protein efficiency rate and minimum feed conversion ratio were reached at 1 119.0 mg/kg group. Survival rate in control group was significantly lower than that in other groups (P<0.05). No significant differences in moisture and crude protein content of whole-body were found among the groups (P>0.05), and ether extract content of whole-body in 4 029.0 mg/kg group was significantly higher than that in control group (P<0.05). No significant difference in ash content of whole-body was obversed between the control group and choline added groups (P>0.05). The choline content in liver was progressively increased and then leveled off with the increasing of dietary choline content and a maximum value was occurred in 1 511.5 mg/kg group (P<0.05). Liver lipoprotein lipase and total lipase activities were tended to increase, but liver fatty acid synthetase activity was tend to decrease and then stable with the increasing of dietary choline content; no significant difference was observed in hepatic lipase activity in liver among all groups (P>0.05). Base on the specific growth rate and liver choline content as evaluation indexes, the choline requirement for orange-spotted grouper determined by broken-line model analysis is 1 093.7 and 1 579.7 mg/kg diet, respectively.[ChineseJournalofAnimalNutrition, 2015, 27(12):3812-3820]
orange-spotted grouper (Epinepheluscoioides); choline; growth; body composition; requirement; lipid metabolism
10.3969/j.issn.1006-267x.2015.12.021
2015-06-03
公益性行业(农业)科研专项(201003020);广东省高等学校珠江学者特聘教授基金(GDUPS2011);广东省教育厅科技创新基金(2013KJCX0096)
覃笛根(1990—),男,布依族,贵州荔波人,硕士研究生,研究方向为水产动物营养与饲料。E-mail: qindigen@126.com
*通信作者:董晓慧,教授,硕士生导师,E-mail: dongxiaohui2003@163.com
S963
A
1006-267X(2015)12-3812-09

