植物乳杆菌和干酪乳杆菌对仔猪生长性能、器官指数及小肠形态的影响
县怡涵 赵秀英 李晨博 丁立人 朱伟云 杭苏琴
(南京农业大学消化道微生物研究室,南京210095)
植物乳杆菌和干酪乳杆菌对仔猪生长性能、器官指数及小肠形态的影响
县怡涵 赵秀英 李晨博 丁立人 朱伟云 杭苏琴*
(南京农业大学消化道微生物研究室,南京210095)
本试验旨在研究植物乳杆菌和干酪乳杆菌对仔猪生长性能、器官指数及小肠形态的影响。选取15窝7日龄大×长仔猪,随机分为3组,每组5个重复,每个重复1窝仔猪(8~10头)。各组分别灌喂去离子水(对照组)、植物乳杆菌菌液和干酪乳杆菌菌液,试验从7日龄开始至35日龄结束,于21(断奶)、24和35日龄屠宰仔猪采样。结果表明,与对照组相比,植物乳杆菌和干酪乳杆菌能显著提高断奶后仔猪平均日采食量和平均日增重(P<0.05),显著降低料重比(P<0.05),但对断奶前仔猪平均日增重、平均日采食量和料重比无显著影响(P>0.05);显著提高35日龄仔猪脾脏指数和胸腺指数(P<0.05),但对胃指数和大肠器指数无显著影响(P>0.05);促进了断奶后仔猪空肠和回肠绒毛发育。由此可见,试验菌株表现了一定的促进仔猪生长、抗腹泻功能,但还需进行体内外机制研究及大量重复性试验才能对菌株的益生特性做出客观、全面评价。
植物乳杆菌;干酪乳杆菌;仔猪;生长性能;器官指数;肠道形态
仔猪断奶时易出现采食量下降、肠绒毛萎缩、生长缓慢和腹泻等不良现象[1],虽然抗生素在应对仔猪断奶应激时发挥了巨大作用,但由于耐药性问题日趋严重,抗生素替代品受到极大关注[2]。益生菌是一类能在宿主体内存活,通过抑制或杀死有害病原菌、改善肠道微生态环境、增强肠道屏障功能和宿主免疫机能,从而促进宿主健康的活菌制剂[3-5]。最常见的益生菌是产乳酸菌(lactic acid bacteria, LAB),它们广泛存在于人和动物肠道内且有较强的产乳酸能力[5-6],其中植物乳杆菌(Lactobacillusplantarum)、罗伊氏乳杆菌(Lactobacillusreuteri)、鼠李糖乳杆菌(Lactobacillusrhamnosus)和干酪乳杆菌(Lactobacilluscasei)等乳酸杆菌研究较为广泛和深入,在欧洲许多菌株已商品化生产[5]。Suo等[7]研究发现,植物乳杆菌ZJ316能显著抑制大肠杆菌和沙门氏菌生长,促进仔猪小肠绒毛发育,改善肠道形态,提高仔猪日增重和饲料转化率,减少腹泻发生;Guerra-Ordaz等[8]报道,断奶仔猪饲喂7 d植物乳杆菌后,回肠、结肠总乳酸杆菌数上升,回肠绒毛高度和杯状细胞数量上升,腹泻显著减少;Pieper等[9]报道,植物乳杆菌通过促进肠道有益菌生长,调节微生物菌群结构和多样性,促进断奶仔猪健康。但也有研究发现,不同菌种特性不尽相同,相同菌种不同菌株其作用也不尽相同[5]。为此,本研究通过给断奶前仔猪灌喂植物乳杆菌和干酪乳杆菌,研究其对仔猪生长性能、器官指数及小肠形态的影响,初步评价测试菌株对仔猪断奶的缓解作用,并为益生菌产品的开发提供基础证据。
1 材料与方法
1.1 试验动物与试验设计
本试验于江苏省常州市某猪场选取同一品种(大×长)、出生日期相近的15窝7日龄仔猪,随机分为3组,分别灌喂去离子水(对照组)、1×109CFU/头植物乳杆菌菌液(LP组)和1×109CFU/头干酪乳杆菌菌液(LC组),每组5个重复,每个重复为1窝仔猪(8~10头)。植物乳杆菌与干酪乳杆菌冻干粉由北京大北农集团有限公司提供,试验于7日龄开始,21日龄断奶,35日龄结束,共29 d,于7、9、11、13、19、21、24日龄仔猪灌喂去离子水或菌液,仔猪断奶后基础饲粮组成及营养水平见表1。试验期间仔猪饲养于半封闭、漏缝地板式猪舍,自然采光,每天清扫;每天饲喂2次,试验全期自由采食、饮水。按常规程序进行仔猪免疫,试验期间腹泻仔猪不用药物治疗。
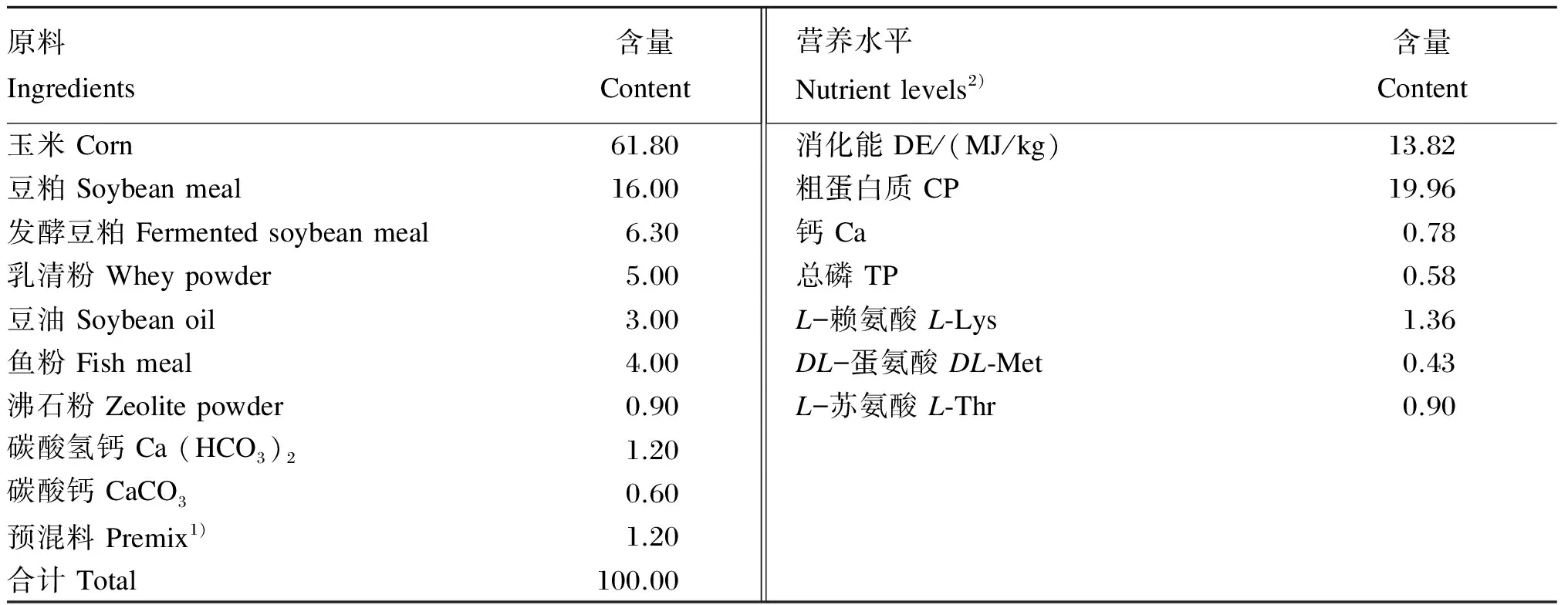
表1 仔猪断奶后基础饲粮组成及营养水平(饲喂基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet: VD3386 IU,VA 3 086 IU,VE 15.4 IU,VK32.3 mg,VB23.9 mg,D-泛酸钙D-calcium pantothenate 15.4 mg,烟酸 nicotinic acid 23 mg,胆碱 choline 500 mg,VB120.016 mg; Cu (Gly-Cu,21%) 17 mg,Fe (Gly-Fe,14%) 133 mg,Zn (Met-Zn,17.5%) 133 mg,Mn (Gly-Mn,22%) 33.3 mg,I [Ca(IO3)2] 0.83 mg,氯化胆碱 choline chloride (50%) 1 000 mg,防霉剂 anti-mildew agent 500 mg,抗氧化剂 antioxidant 200 mg,甜味剂 sweetener 400 mg,香味剂 flavor 600 mg,食盐 NaCl 1.3 g,丙酸 propanoic acid 2 g,赖氨酸盐酸 lysine·HCl 2.7 g,蛋氨酸 methionine 660 mg,苏氨酸 threonine 440 mg。
2)营养水平为计算值。Nutrient levels were calculated values.
1.2 样品采集与处理
肝脏等器官样品:于仔猪21、24和35日龄分别从对照组、LP组和LC组每个重复随机选1头仔猪,称重后屠宰,分离肝脏、胸腺、脾脏、胃、小肠(十二指肠、空肠和回肠)、大肠(盲肠和结肠),用滤纸吸掉血液,剔除脂肪后分别称重,用于器官指数分析。
空、回肠组织样品:处死仔猪后,打开腹腔取出胃肠道,按组织学区分各肠段,剪取空肠、回肠组织各2 cm,磷酸盐缓冲液(PBS)漂去肠内容物后,置组织样于4%多聚甲醛中常温固定,用于制作常规石蜡切片测定小肠绒毛高度和隐窝深度,计算绒腺比。
1.3 指标测定及方法
1.3.1 体重和采食量
于仔猪7、21、24和35日龄晨饲前以重复为单位对仔猪空腹称重,计算每窝仔猪的平均日增重(average daily gain,ADG);根据采食量的多少决定给料量,并记录剩料量,计算平均日采食量(average daily feed intake,ADFI)和料重比(feed/gain,F/G)。
1.3.2 腹泻率
准确记录每天腹泻头数,1 d 1头仔猪发生腹泻记为1头次,各期每个重复腹泻总头次除以其相应的仔猪总头次,求得各组的平均值,即为各组在试验期的腹泻率。
腹泻率(%)=腹泻头次/(供试猪总头数×
试验天数)×100[10]。
1.3.3 器官发育指数
器官指数(g/kg)=器官重量(g)/
仔猪宰前活体重(kg)[11]。
1.3.4 肠道组织形态测定
切片后,常规苏木精-伊红(HE)染色,每头猪、每个肠段制5张切片,每张切片中至少选5个视野计量仔猪空肠、回肠的绒毛高度和隐窝深度。
1.4 统计分析
数据经Excel 2007初步整理后,采用SPSS 20.0软件中的单因素方差(one-way ANOVA)模型进行分析,Tukey S-B test比较差异显著性,P<0.05为差异显著。
2 结果与分析
2.1 植物乳杆菌和干酪乳杆菌对仔猪生长性能的影响
由表2可知,仔猪灌喂植物乳杆菌和干酪乳杆菌对断奶前仔猪ADFI、ADG和F/G均无显著影响(P>0.05),但能显著降低仔猪腹泻率(P<0.05),与对照组相比,植物乳杆菌和干酪乳杆菌分别降低腹泻率23.88%和24.05%(P<0.05)。与对照组相比,植物乳杆菌和干酪乳杆菌显著提高断奶后仔猪ADFI和ADG(P<0.05),显著降低F/G(P<0.05),但对腹泻率无显著影响(P>0.05)。整个试验期,LP和LC组ADFI和ADG均显著高于对照组(P<0.05),但3组间F/G和腹泻率差异不显著(P>0.05),LP和LC组有降低F/G和腹泻率的趋势(P>0.05)。
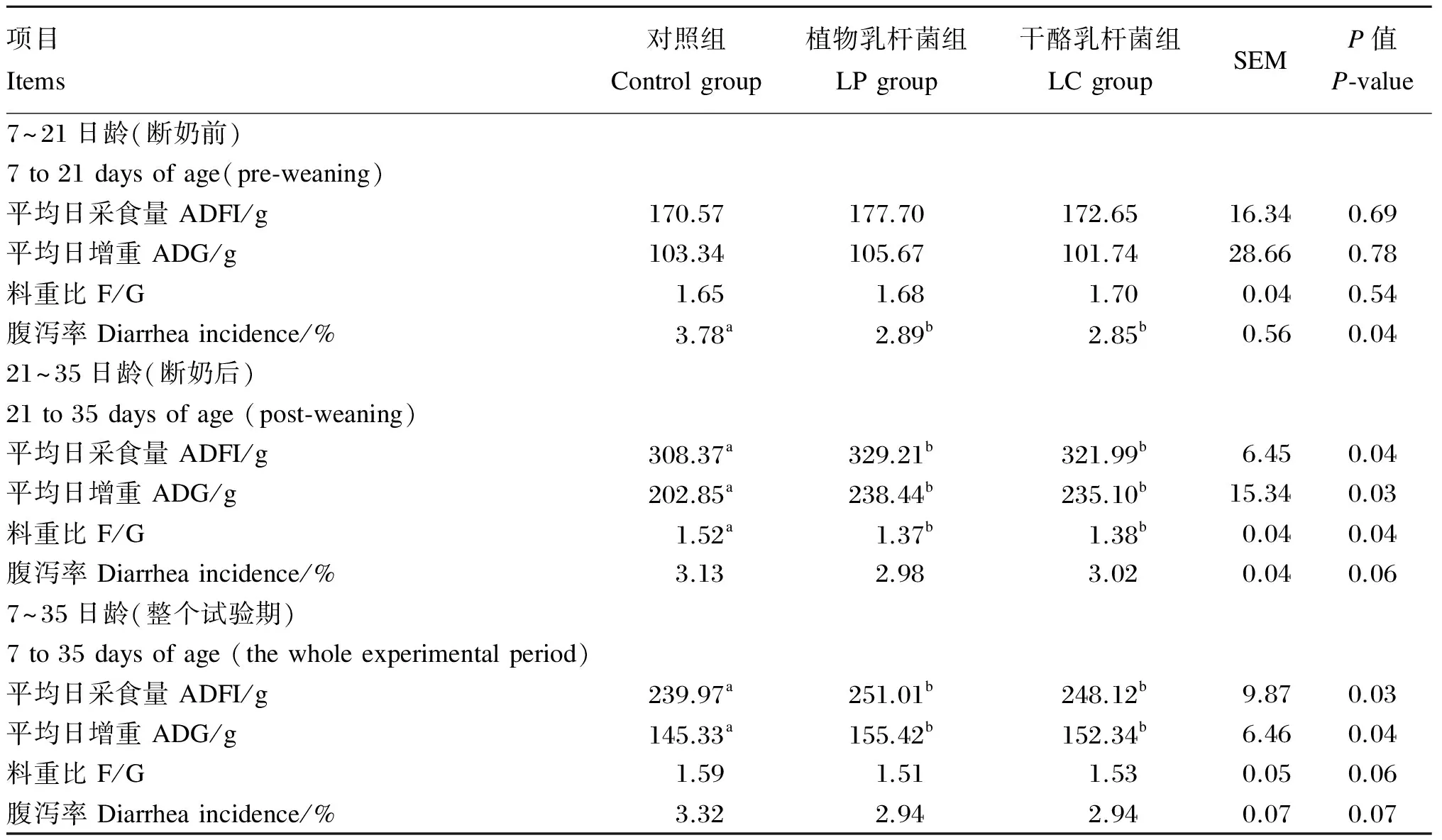
表2 植物乳杆菌和干酪乳杆菌对仔猪生长性能和腹泻率的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 植物乳杆菌和干酪乳杆菌对断奶仔猪器官指数的影响
由表3可知,与对照组相比,LP和LC组显著提高35日龄仔猪胸腺指数和脾脏指数(P<0.05),对胃和大肠指数无显著影响(P>0.05),对21和24日龄所有器官指数均无显著影响(P>0.05)。
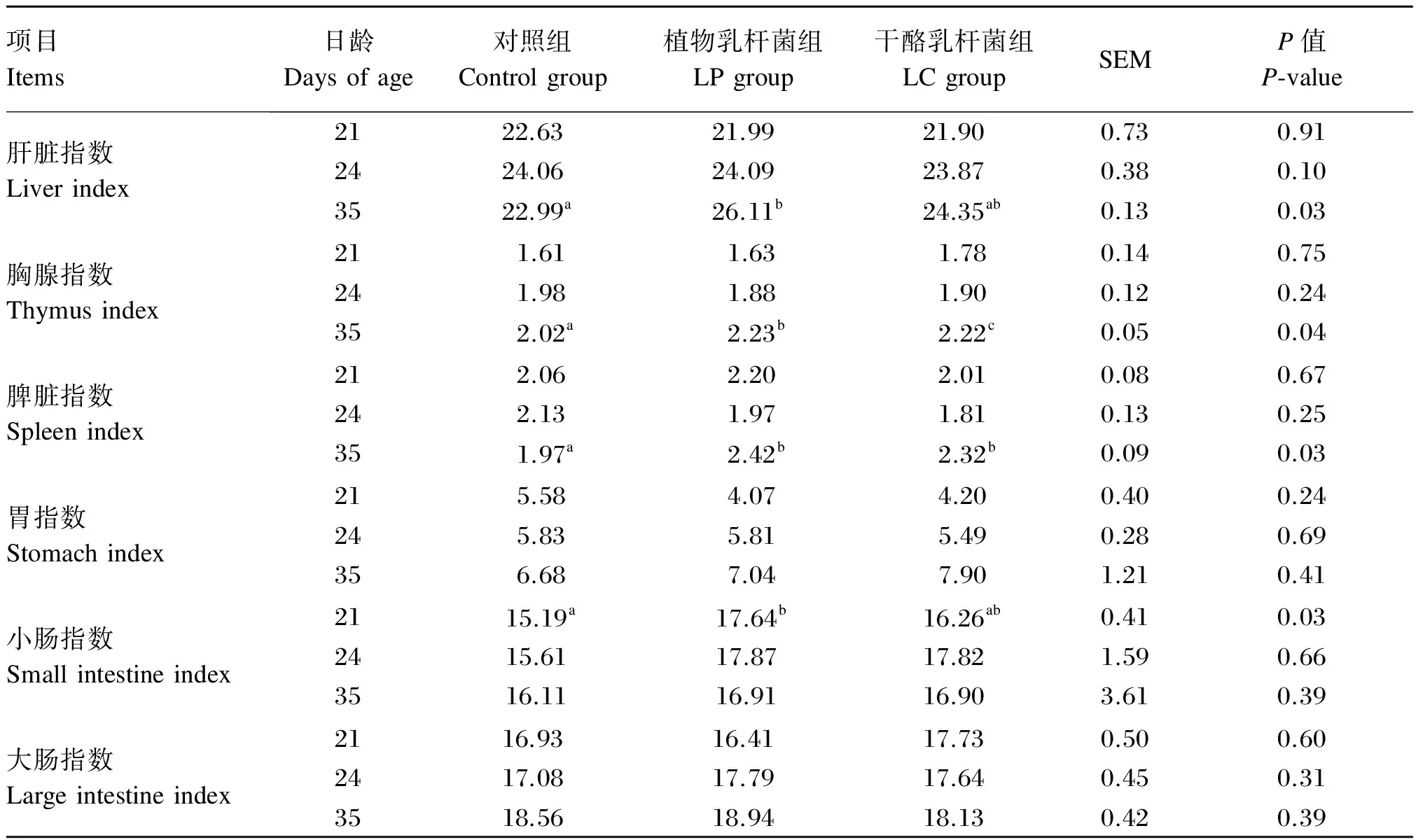
表3 植物乳杆菌和干酪乳杆菌对仔猪器官指数的影响
2.3 植物乳杆菌和干酪乳杆菌对断奶仔猪小肠形态的影响
如表4所示,与对照组相比,LP和LC组促进了24和35日龄仔猪空肠和回肠绒毛发育,提高了绒腺比,但与21日龄相比,24日龄空肠和回肠绒毛高度、绒腺比均降低,35日龄绒毛高度和绒腺比有所恢复,说明断奶影响小肠绒毛、隐窝形态,一段时间后可自行恢复,LP和LC有助于小肠形态的快速恢复。
3 讨 论
3.1 植物乳杆菌和干酪乳杆菌对仔猪生长性能和腹泻率的影响
研究结果显示,植物乳杆菌和干酪乳杆菌能提高断奶仔猪ADG和ADFI,降低F/G,这与许多前人的研究结果相似,Lee等[12]报道,当给断奶仔猪以108、109和1010CFU/kg饲喂植物乳杆菌时,植物乳杆菌呈剂量依赖方式显著提高仔猪ADG和ADFI;Chang等[13]报道,罗伊氏乳杆菌能提高仔猪ADG 27%~34%;Huang等[14]报道,乳杆菌复合物分别提高断奶2周龄仔猪ADG 28%和ADFI 31%。在多数研究中,乳酸杆菌的饲喂剂量通常是109,相当于成年猪10~100 g的食糜,或与猪肠道食糜中乳酸菌数量相当,但Lee等[12]的研究提示我们,为取得较好的生产效果乳酸杆菌的添加量可以达到1010CFU/kg;Yang等[15]也发现,该剂量的植物乳杆菌能显著提高大肠杆菌(E.coli)攻毒后仔猪的ADG和ADFI。根据本试验,分析测试菌株提高断奶仔猪生长性能的原因,可能是通过改善胃肠道形态如提高绒毛高度、降低隐窝深度,促进丁酸产生和增加微生物区系多样性等共同作用的结果。也有研究报道,乳酸杆菌类的益生菌可明显促进肠内容物中乳酸杆菌的富集和增殖,从而改善肠道健康,促进断奶仔猪生长[16],这提示在下一步的机制研究中需要引起注意。
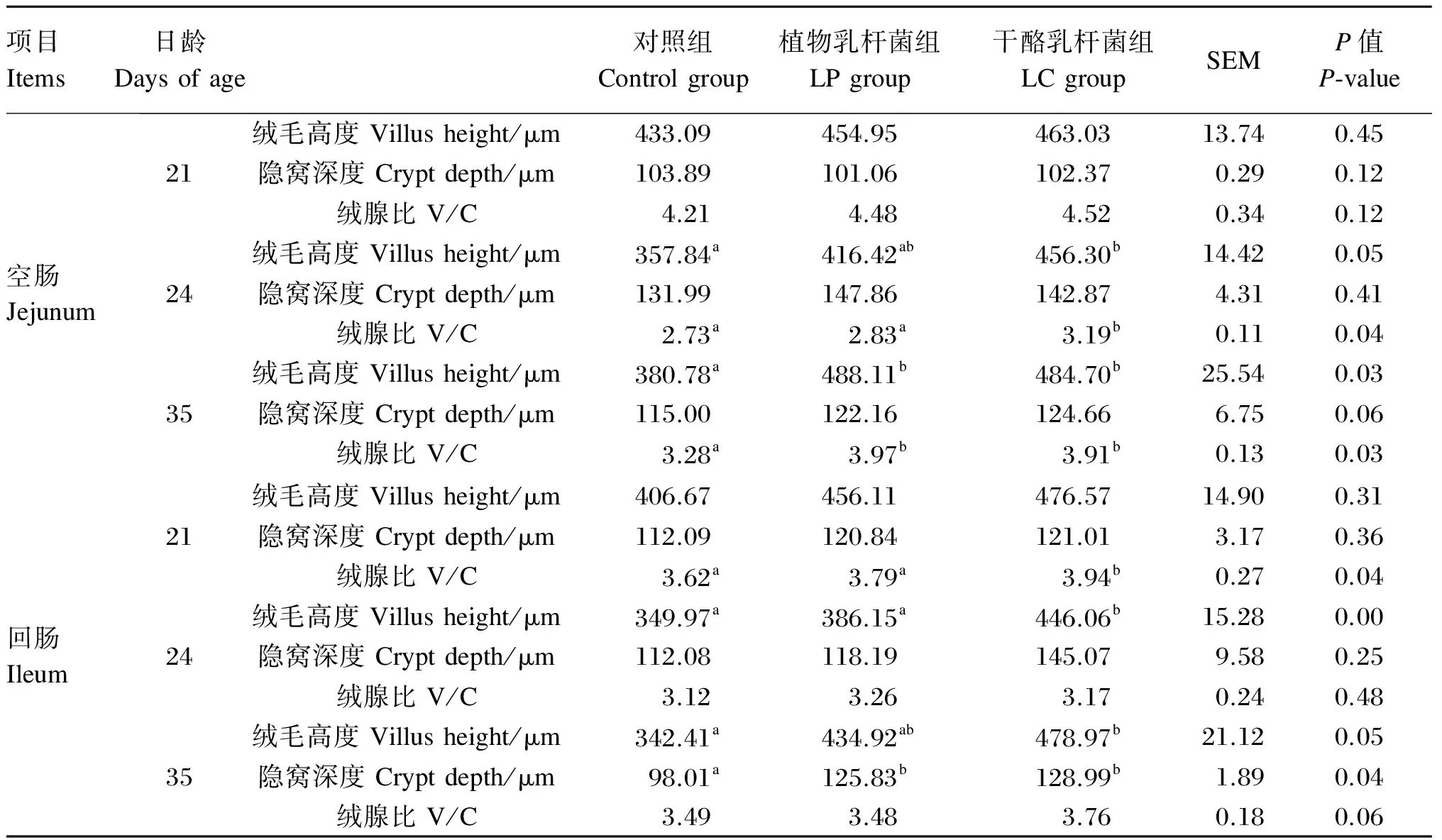
表4 植物乳杆菌和干酪乳杆菌对仔猪小肠形态的影响
据报道,新生和断奶仔猪腹泻通常与肠毒性E.coliK88有关,E.coli在小肠定植释放肠毒素,破坏肠道屏障引起腹泻[17]。体内、体外乳酸杆菌的研究发现,乳酸杆菌可通过保护肠道紧密连接屏障、竞争排除病原菌、产生抗菌物质、增强宿主免疫功能,减少细胞通透性等降低腹泻的发生[15,18-19],本研究发现仔猪从7日龄饲喂植物乳杆菌和干酪乳杆菌能显著降低断奶前仔猪腹泻率,但断奶后并不影响,说明测试菌株确实产生了一定抗腹泻效果,且较早使用较好,这与Yang等[15]的报道一致,他们发现仔猪出生4日龄开始饲喂植物乳杆菌能明显改善肠道屏障功能,减少E.coli攻毒后仔猪腹泻率,针对本试验腹泻率降低的机制,可通过体外测试菌与病原菌共培养试验、体内微生物菌群结构及数量和代谢产物分析、宿主免疫机能等方面进行深入探讨。
3.2 植物乳杆菌和干酪乳杆菌对仔猪器官指数的影响
脾脏属外周免疫器官,脾脏的发育状况关系到体液和细胞免疫的功能能否正常发挥。胸腺属中枢免疫器官,其功能对机体的细胞免疫紧密相关[20]。本研究发现,植物乳杆菌和干酪乳杆菌能显著提高脾脏指数和胸腺指数,说明测试菌株对仔猪免疫器官发育具有一定的促进作用,但是本研究未发现测试菌株对胃肠道指数有显著影响。Lee等[12]报道,植物乳杆菌通过下调炎症因子调控断奶仔猪急性炎症期健康;Suda等[21]报道,乳酸杆菌可显著促进断奶仔猪主要组织相容性复合体Ⅱ类(MHC-Ⅱ)的表达,通过下调Toll-like样受体4(TLR4)介导的核转录因子-κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)活性下调肠道细胞趋化因子和炎症因子的表达,在这方面我们还需拓展和借鉴,以期进一步探明测试菌株促进仔猪健康、改善生长性能的机制。
3.3 植物乳杆菌和干酪乳杆菌对断奶仔猪小肠形态的影响
小肠是营养物质消化和吸收的主要场所,小肠表面积的大小直接反映小肠的吸收功能,绒毛和隐窝的形态特征是反映肠上皮细胞的成熟度及吸收功能的最常用指标,绒毛越高,隐窝越浅,表明肠道消化吸收营养物质的能力越强[22]。本研究发现,植物乳杆菌和干酪乳杆菌能显著改善断奶后仔猪空肠、回肠绒毛发育,提高绒腺比,说明一定程度上测试菌株缓解了断奶对小肠绒毛的损伤,有利于仔猪对营养物质的消化吸收。Yang等[14]发现,植物乳杆菌能显著改善E.coli攻毒造成的仔猪十二指肠和空肠绒毛变短、隐窝加深等问题,其机制可能与益生菌株保护肠道屏障结构及功能有关,也有说与肠道细胞的增殖、上皮更新和微生物区系的改变有关[23]。
4 结 论
仔猪7日龄开始饲喂植物乳杆菌和干酪乳杆菌能显著提高断奶后仔猪ADFI、ADG,显著降低F/G,显著提高35日龄仔猪脾脏指数和胸腺器官指数,促进断奶后仔猪空肠和回肠绒毛发育,说明试验菌株具有促生长、抗腹泻的效果。
[1] LESER T D,LINDECRONA R H,JENSEN T K,et al.Changes in bacterial community structure in the colon of pigs fed different experimental diets and after infection withBrachyspirahyodysenteriae[J].Applied Environmental Microbiology,2000,66(8):3290-3296.
[2] CROMWELL G L.Why and how antibiotics are used in swine production[J].Animal Biotechnology,2002,13(1):7-27.
[3] GUARNER F,SCHAAFSMA G J.Probiotics[J].International Journal of Food Microbiology,1998,39(3):237-238.
[4] CHO J H,ZHAO P Y,KIM I H.Probiotics as a dietary additive for pigs:a review[J].Journal of Animal and Veterinay Advances,2011,10(16):2127-2134.
[5] JENSEN H,GRIMMER S,NATERSTAD K,et al.Invitrotesting of commercial and potential probiotic lactic acid bacteria [J].International Journal of Food Microbiology,2012,153(1/2):216-222.
[6] LAND M H,ROUSTER-STEVENS K,WOODS C R,et al.Lactobacillussepsis associated with probiotic therapy[J].Pediatrics,2005,115(1):178-181.
[7] SUO C,YIN Y S,WANG X N,et al.Effects ofLactobacillusplantarumZJ316 on pig growth and pork quality[J].BMC Veterinary Research,2012,8:89.
[8] GUERRA-ORDAZ A A,GONZLEZ-ORTIZ G,LA RAGIONE R M,et al.Lactulose andLactobacillusplantarum,a potential complementary synbiotic to control postweaning colibacillosis in piglets [J].Applied and Environmental Microbiology,2014,80(16):4879-4886.
[9] PIEPER R,JANCZYK P,URUBSCHUROV V,et al.Effect of a single oral administration ofLactobacillusplantarumDSMZ 8862/8866 before and at the time point of weaning on intestinal microbialcommunities in piglets[J].International Journal of Food Microbiology,2009,130(3):227-232.
[10] 房正国,不同脂肪来源的日粮对仔猪肠道发育及肠道微生物区系的影响[D].硕士学位论文.南京:南京农业大学,2012.
[11] 郑荷花.丁酸钾对断奶仔猪生长性能的影响及机理研究[D].硕士学位论文.南京:南京农业大学,2012.
[12] LEE J S,AWJI E G,LEE S J,et al.Effect ofLactobacillusplantarumCJLP243 on the growth performance and cytokine response of weaning pigs challenged with enterotoxigenicEscherichiacoli[J].Journal of Animal Science,2012,90(11):3709-3717.
[13] CHANG Y H,KIM J K,KIM H J,et al.Selection of a potential probioticLactobacillusstrain and subsequentinvivostudies[J].Antonie Van Leeuwenhoek,2001,80(2):193-199.
[14] HUANG C H,QIAO S Y,LI D F,et al.Effects ofLactobacillion the performance,diarrhea incidence,VFA concentration and gastrointestinal microbial flora of weaning pigs[J].Asian-Australasian Journal of Animal Science,2004,17(3):401-409.
[15] YANG K M,JIANG Z Y,ZHENG C T,et al.Effect ofLactobacillusplantarumon diarrhea and intestinal barrier function of young piglets challenged with enterotoxigenicEscherichiacoliK88[J].Journal of Animal Science,2014,92(4):1496-1503.
[16] TAKAHASHI S,EGAWA Y Y,SIMOJO N,et al.Oral administration ofLactobacillusplantarumstrain Lq80 to weaning piglets stimulates the growth of indigenous lactobacilli to modify the lactobacillal population[J].The Journal of General and Applied Microbiology,2007,53(6),325-332.
[17] FAIRBROTHER J M,NADEAUÉ,GYLESA C L.Escherichiacoliin postweaning diarrhea in pigs:an update on bacterial types,pathogenesis,and prevention strategies[J].Animal Health Research Review,2005,6 (1):17-39.
[18] NAVA G M,BIELKE L R,CALLAWAY T R,et al.Probiotic alternatives to reduce gastrointestinal infections:the poultry experience[J].Animal Health Research Review,2005,6(1):105-118.
[19] WEBERT E,ZIEMER C J,KERR B J.Effects of adding fi brous feedstuffs to the diet of young pigs on growth performance,intestinal cytokines,and circulating acute-phase proteins[J].Journal of Animal Science,2008,86(4):871?傆b881.
[20] 辛娜,刁其玉,张乃锋,等.芽孢杆菌制剂对断奶仔猪生长性能、免疫器官指数及胃肠道pH值的影响[J].饲料工业,2011,32(9):33-36.
[21] SUDA Y,VILLENA J,TAKAHASHI Y,et al.ImmunobioticLactobacillusjenseniias immune-health promoting factor to improve growth performance and productivity in post-weaning pigs [J].BMC Immunology 2014,15:24.
[22] RIEGER J,JANCZYK P,H?倝NIGEN H,et al.Intraepithelial lymphocyte numbers and histomorphological parameters in the porcine gut afterEnterococcusfaeciumNCIMB 10415 feeding in aSalmonellaTyphimurium challenge[J].Veterinary Immunology and Immunopathology,2015,164(1/2):40-50.
[23] 杭苏琴,时祺,丁立人,等.果寡糖对断奶前仔猪胃肠道组织形态、消化酶、有机酸及乳酸杆菌菌群的影响[J].草业学报,2014,23(2):260-267.
*Corresponding author, professor, E-mail: suqinhang69@njau.edu.cn
(责任编辑 武海龙)
Effects ofLactobacillusplantarumandLactobacilluscaseion Growth Performance, Organ Index and Intestinal Morphology of Piglets
XIAN Yihan ZHAO Xiuying LI Chenbo DING Liren ZHU Weiyun HANG Suqin*
(LaboratoryofGastrointestinalMicrobiology,NanjingAgriculturalUniversity,Nanjing210095,China)
The experiment was conducted to study the effects ofLactobacillusplantarumandLactobacilluscaseion growth performance, organ index and intestinal morphology of piglets. A total of 15 litters piglets (Yorkshire × Landrace) at age of 7 days were randomly assigned to 3 groups with 5 replicates per group and 1 litter (8 to 10 piglets) per replicate, including the control group orally administrated with distilled water,Lactobacillusplantarumgroup orally administrated withLactobacillusplantarumandLactobacilluscaseiorally administrated withLactobacilluscasei. The experiment started at day 7 and ended at day 35 after birth. The piglets were slaughtered on day 21, 24 and 35 after birth for sampling. The results showed that compared with the control group,LactobacillusplantarumandLactobacilluscaseisignificantly increased average daily feed intake (ADFI) and average daily gain (ADG) and decreased feed/gain (F/G) after weaning (P<0.05), however, no effects were found before weaning for both tested strains (P>0.05). Organ indexes of piglets at 35 days such as spleen and thymus were also significantly increased in the two tested strains group (P<0.05), and stomach index and large intestine index were not affected. (P>0.05).LactobacillusplantarumandLactobacilluscaseiimproved the villus development of jejunum and ileum of weaning piglets. The findings indicate that bothLactobacillusplantarumandLactobacilluscaseihave potential benefits to the growth performance and inhibition of diarrhea of piglets. However, further study of mechanisms and a large number of repeated experiments are needed for the evaluation of both tested strains for clinical use.[ChineseJournalofAnimalNutrition, 2015, 27(12):3805-3811]
Lactobacillusplantarum;Lactobacilluscasei; piglets; growth performance; organ index; intestinal morphology
10.3969/j.issn.1006-267x.2015.12.020
2015-06-15
农业部公益性行业专项“饲料中抗生素替代品关键研究与示范”(201403047);饲用微生物国家重点实验室开放课题
县怡涵(1992—),女,甘肃天水人,硕士研究生,从事动物营养与胃肠道健康的研究。E-mail: 2014105006@njau.edu.cn
*通信作者:杭苏琴,教授,硕士生导师,E-mail: suqinhang69@njau.edu.cn
S828
A
1006-267X(2015)12-3805-07

