快速实时荧光定量PCR检测猪繁殖与呼吸综合症病毒方法的建立
吴海港,饶品彬,蔡 晔,全滟平,姜永厚
(浙江理工大学生命科学学院,杭州 310018)
快速实时荧光定量PCR检测猪繁殖与呼吸综合症病毒方法的建立
吴海港,饶品彬,蔡 晔,全滟平,姜永厚
(浙江理工大学生命科学学院,杭州 310018)
为建立一种快速准确检测猪繁殖与呼吸综合症病毒(PRRSV)的基于TaqMan实时荧光定量PCR方法,根据猪繁殖与呼吸综合症病毒的ORF7保守序列分别设计引物和TaqMan探针,在常规PCR的基础上,设计并优化基于TaqMan探针的荧光定量PCR检测PRRSV的方法。结果表明本研究建立的基于TaqMan探针的实时荧光定量PCR体系相关系数大于99%,扩增效率为97%,具有良好的线性关系。利用建立的方法检测猪圆环病毒2型(PCV2)、猪细小病毒(PPV)、伪狂犬病毒(PRV)、猪瘟病毒(CSFV)、日本脑炎病毒(JEV),结果均为阴性,说明此方法具有较好的特异性。灵敏度试验表明该方法检测极限为5 copies/μL;应用建立的方法对58份血清样本和60份组织样本进行检测,共检测出14份阳性血清和10份阳性组织。这些结果表明本研究建立的基于TaqMan探针的PRRSV实时荧光定量PCR方法具有良好的特异性、灵敏度、重复性,可为临床检测PRRSV提供更高效的技术平台。
猪繁殖与呼吸综合症病毒; TaqMan探针; 实时荧光定量PCR; 检测
0 引 言
猪繁殖与呼吸综合症病毒(porcine reproductive and respiratory syndrome virus,PRRSV)是引起猪繁殖与呼吸综合症(porcine reproductive and respiratory syndrome,PRRS)的主要病原,该病是一种对养猪业危害极其严重的病毒性传染病,临床特征为母猪发热、流产,断奶前、后仔猪死亡,呼吸障碍等,又称“蓝耳病”[1]。PRRS一般仅见于猪,其他家禽和动物未见发病,该病潜伏期短,从感染到出现病症间隔大约为2~37 d,不同年龄、品种的猪均可感染,严重可致猪体免疫系统功能丧失而死亡,属于一旦发现必须向世界动物卫生组织(office international des epizooties,OIE)通报的烈性传染病。根据核苷酸序列差异不同分为2个亚型,亚型A为1991年荷兰学者Wensvoort等[2]在病猪体内分离的欧洲型PRRSV,主要流行于欧洲地区,亚型B为同年美国学者Benfield等[3]分离到的美洲型PRRSV,主要流行于美洲和亚太地区。PRRSV具有高度的传染性,能垂直传播和水平传播,致使该病在各养猪国家蔓延,造成了极大的经济损失,引起了世界各国政府的高度重视。
目前已建立的检测PRRSV方法有很多,如病毒分离培养,免疫荧光技术(immunofluorescence technique,IFA),免疫过氧化物酶单层试验(immunoperoxidase monolayer assay,IPMA),血清中和试验(serum neutralization test,SNT),酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)等。这些方法存在耗时长,技术要求高,或灵敏度低,不能在病毒潜伏期进行有效检测等不足。实时荧光定量PCR技术(real-time fluorescent quantitative PCR)的出现极大地简化了核酸检测过程。实时荧光定量PCR技术是1996年美国Applied Biosystem公司新推出的核酸定量技术,该技术通过荧光染料或荧光探针对PCR产物进行跟踪标记,再结合相应软件对产物进行分析,对未知模板初始浓度进行定量[4]。因实时荧光定量PCR自动化程度高,目前已广泛应用于临床疾病诊断、动物疫病监测、食品安全和科学研究。本研究旨在根据实时荧光定量PCR原理,利用TaqMan探针技术设计和建立一种快速检测PRRSV方法,为猪繁殖与呼吸综合症病毒的早期诊断提供工具,同时也为猪繁殖与呼吸综合症的分子生物学、致病机理和流行病学等相关领域的研究提供参考和依据。
1 材料和方法
1.1 材料
PRRSV、猪瘟病毒(classical swine fever virus,CSFV)及猪圆环病毒2型(porcine circovirus type 2,PCV2)疫苗株由本实验室保存;猪细小病毒(porcine parvovirus,PPV)疫苗干粉购自北京中海保健科技有限公司;伪狂犬病毒(porcine pseudorabies virus,PRV)和日本脑炎病毒(Japanese encephalitis virus,JEV)疫苗干粉购自武汉科前动物生物制品有限公司;大肠杆菌E.coliDH5α,本实验室保存,58份来自全国各地区血清样品和60份采集于杭州屠宰场的组织样本。
1.2 主要试剂
TaqDNA聚合酶,dNTP mixture,质粒pMD18-T,DNA Gel Extraction Kit为生工生物工程(上海)有限公司产品,M-MuLV反转录酶,RNase抑制剂为TaKaRa公司产品。
1.3 引物与TaqMan探针设计
根据GenBank下载PRRSV序列的Clustal-W (DNAStar Inc.,Madison,WI,USA)比对结果,选取保守的ORF7基因,利用Primer Premier 5.0 (Prmier Biosoft international,USA)设计ORF7 PCR引物,ORF7上游引物5′-GAGTTTCAGCGGAACAATGG-3′,ORF7下游引物5′-GCCGTTGACCGTAGTGGAG-3′。在上述引物区内设计荧光定量PCR引物和TaqMan探针(表1)。通过NCBI中BLAST对设计的引物和探针进行分析,确保引物和探针的特异性。设计的引物和探针由上海生工生物工程公司合成。
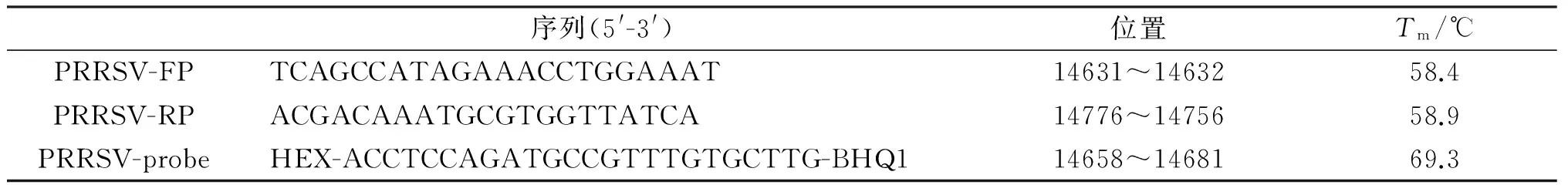
表1 实时荧光定量PCR引物和探针
1.4 病毒质粒标准品制备
1.4.1 ORF7基因的扩增
根据产品说明,用病毒RNA抽提试剂盒从疫苗株样本提取病毒核酸。以提取的核酸产物为模板,按照反转录试剂盒说明将提取产物反转录成cDNA,然后进行PCR扩增。PCR反应体系如下:10×Taq PCR Buffer 2.5 μL,Mg2+(25 mM)2 μL,dNTP(2.5 mM)1 μL,上、下游引物(10 μM) 0.5 μL,Taq DNA聚合酶(5 U/μL) 0.2 μL,cDNA模板1 μL,加ddH2O至总体积为25 μL。反应程序为:95℃预变性3 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min,琼脂糖凝胶电泳检测。
1.4.2 PCR产物的克隆及鉴定
按照凝胶回收试剂盒回收PCR产物,与pMD18-T载体连接,将连接产物转化感受态细胞DH5α,挑选转化的菌落进行单克隆培养,提取质粒进行酶切鉴定以及序列测定。
1.4.3 重组质粒浓度的测定
将质粒提取物用紫外分光光度计检测质粒浓度,并根据公式计算质粒的拷贝数。将质粒标准品以10倍比稀释后用于标准曲线的制作。
1.5 实时荧光定量PCR检测方法的建立
1.5.1 标准曲线的建立
将重组质粒按照10倍梯度稀释,取5个梯度的质粒标准品作为实时荧光定量PCR反应模板进行反应,制作标准曲线。实时荧光定量PCR反应体系总体积为15 μL,反应体系组成为:25 mM Mg2+2.1 μL,10×Buffer 1.5 μL,2.5 mM dNTP Mix 1.2 μL,0.2 U Taq聚合酶,上、下游引物(10 μM)各0.3 μL,探针(10 μM) 0.15 μL,重组质粒1 μL,灭菌ddH2O补足15 μL。反应在ABI 7300荧光定量PCR仪上进行,扩增程序为:95℃ 3 min;95℃ 15 s,60℃ 1min,40个循环。
1.5.2 实时荧光定量PCR方法的特异性试验
分别以PRRSV、PCV2、PPV、PRV、CSFV和JEV所抽提的DNA或cDNA以及双蒸水为模板进行荧光定量PCR检测,检验其反应特异性。
1.5.3 实时荧光定量PCR方法的灵敏性试验
用含有目的片段的质粒作标准品,以10倍系列稀释成1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101、5.0×100、1.0×100copies/μL为模板和双蒸水进行荧光定量PCR检测,检验其灵敏度。
1.5.4 实时荧光定量PCR方法的重复性试验
将含有目的片段的3个浓度梯度(106、105、104copies/μL)的质粒标准品分别重复做批内实时荧光定量PCR反应3次,并在不同时间内分别进行3次批间实时荧光定量PCR反应,对PRRSV各浓度标准品的Ct值进行数据统计分析。
2 结果与分析
2.1 标准曲线建立
构建的含PRRSV目的片段的重组质粒经酶切和测序,BLAST在线比对分析,验证了本研究克隆的DNA序列确实为PRRSV的部分核酸序列,表明重组质粒构建成功(结果未列出)。以制备的PRRSV标准品梯度稀释成106、105、104、103、102copies/μL,以这5个浓度的标准品作为模板进行荧光定量PCR反应,对扩增曲线进行分析制作标准曲线,结果表明模板浓度在106~102copies/μL范围荧光定量PCR反应可获得理想的标准曲线,相关系数大于0.99,扩增效率达到97%(图1)。

图1 PRRSV荧光定量PCR扩增标准曲线
2.2 特异性
用建立的荧光定量PCR方法分别对PRRSV,PCV2、PRV、PPV、CSFV和JEV进行检测,PRRSV有扩增曲线产生,而以PCV2、PRV、PPV、CSFV和JEV为模板的对照组均无扩增曲线,空白阴性对照无扩增曲线(图2),结果表明PRRSV实时荧光定量PCR具有较好的反应特异性。

图2 PRRSV实时荧光定量PCR反应特异性
3.3 灵敏度
以浓度分别为106、105、104、103、102、10和5 copies/μL的PRRSV标准品作为模板时扩增曲线均有阳性信号产生,1 copies/μL的PRRSV标准品无扩增曲线(图3),表明PRRSV实时荧光定量PCR的检测灵敏度可以达到5 copies/μL。
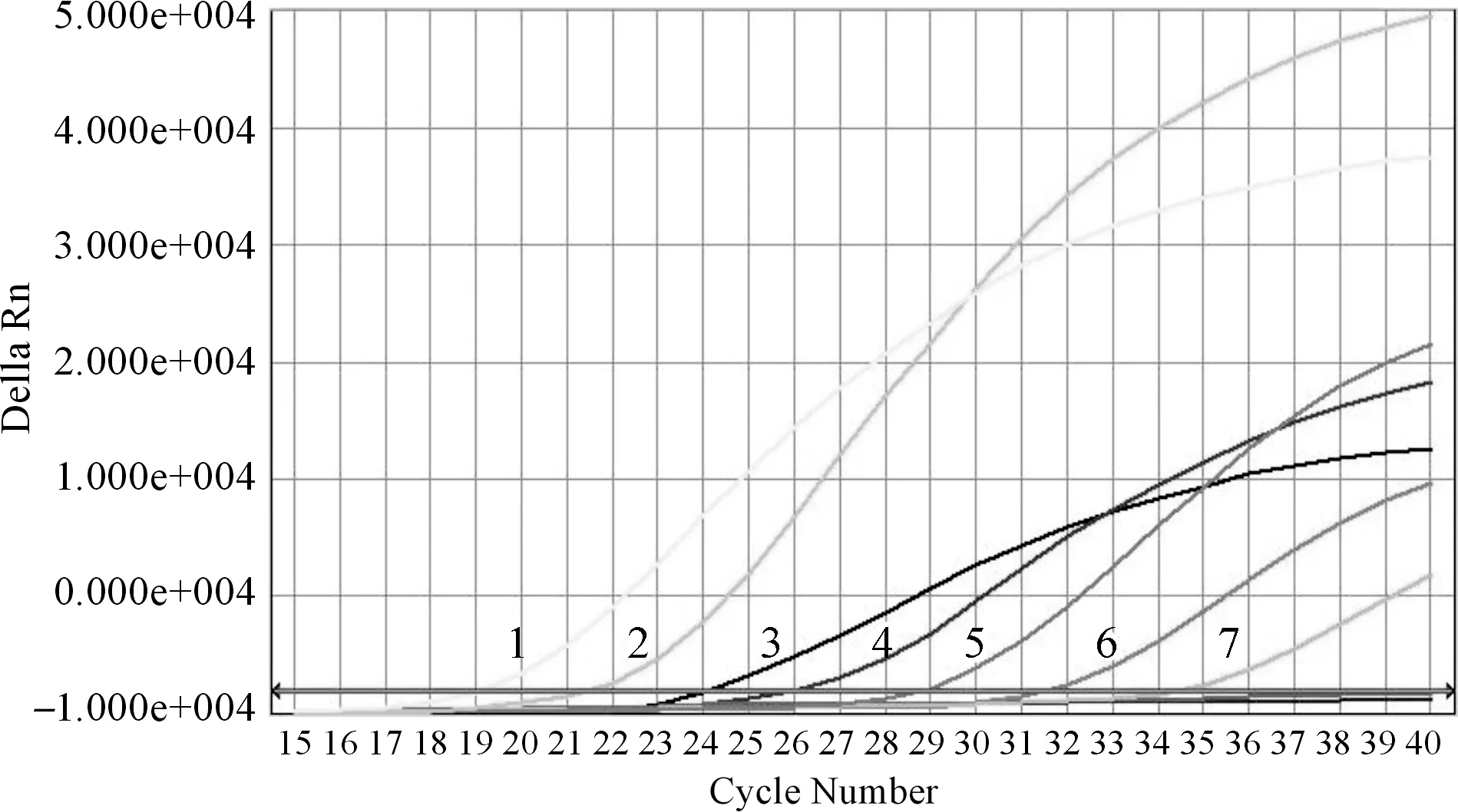
图3 PRRSV实时荧光定量PCR检测灵敏度注:1.106copies/μL;2.105copies/μL;3.104copies/μL;4.103copies/μL;5.102copies/μL;6.10copies/μL;7.5copies/μL。
3.4 重复性
将制备的PRRSV标准品梯度稀释成106、105、104copies/μL,以这3个浓度的标准品作为模板分别进行实时荧光定量PCR重复性试验,对标准品的扩增曲线相应Ct值进行统计分析(表2),批内重复的变异系数分别为0.57%、1.85%和1.50%,小于3%;批间重复试验的变异系数分别为3.26%、3.99%和3.18%,小于5%,表明实时荧光定量PCR检测PRRSV具有良好的重复性。
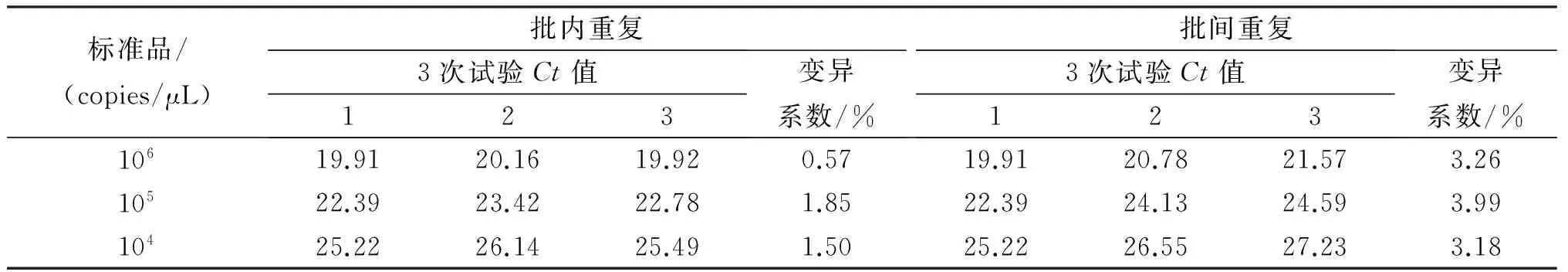
表2 实时荧光定量PCR检测PRRSV重复性
3.5 临床检测
利用建立的PRRSV实时荧光定量PCR方法检测来自不同地区的58份血清样品和60份来自浙江杭州地区的组织样本,检测结果显示血清样品中有14份阳性,组织样品中有10份阳性。
4 讨 论
实时荧光定量PCR技术与常规PCR相比具有下列优势:a)定量检测,常规PCR只能通过胶成像分析终点法对扩增产物进行定性分析,而实时荧光定量PCR技术利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,最终精确地对起始模板进行定量分析;b)具有良好的稳定性与可重复性,在本试验中,经过多次重复试验,批内重复和批间重复的变异系数分别小于2%和5%。而常规PCR电泳后通过扫描凝胶定量,其变异系数高达31%[5];c)安全省时,实时荧光定量PCR技术省去了常规PCR中的电泳、染色等后续步骤,避免了溴化乙锭或同位素等对人体健康的危害,同时简化了实验程序,减少了实验环境对产物的污染,适宜于大批量样本的检测;d)高精确度,实时荧光定量PCR的检测始模板量,在模板含量较低时也能得到精确结果,比半定量PCR更可靠,有利于制定定量检测标准,便于在不同实验室之间进行结果比较。
PRRSV ORF7编码核衣壳蛋白,即N蛋白,具有很强的保守性,N蛋白包含所有毒株保守的共同表位,又具有欧洲型和美洲型PRRSV的表位[6-8]。本研究选用相对保守的N蛋白基因,建立了基于TaqMan探针的实时荧光定量PCR检测PRRSV方法。TaqMan探针技术在引物和探针设计方面都具有较高的特异性,所以具有双重保障,即扩增的产物是由一对特异性引物和特异性探针共同决定。另外,TaqMan探针技术的引物二聚体不会产生荧光,而TaqMan探针的3′端已经磷酸化,不能形成二聚体,所以不会对特异性产生影响[9]。本实验中对PRRSV和其它5种常见猪病毒进行检测,除目标病毒外均为阴性,表明建立的实时荧光定量PCR具有较好的特异性,可有效减少假阳性的发生。
病毒检测方法的灵敏度对猪呼吸和障碍性疾病的预防和控制具有十分重要的意义。病毒检测的灵敏度越高,对病毒感染的早期检测越精确,则对疫病的防治越重要。PRRSV病毒含量和病毒的动态变化对治疗猪呼吸和障碍性疾病时药物的选取,药物剂量,药物作用时间等条件具有重要的指导意义,对治疗后的康复保健也具有指示作用。目前已有一些利用实时荧光定量PCR检测PRRSV的报道。杨宗照等[10]建立了实时荧光定量PCR方法检测高致病性PRRSV,结果显示该方法可快速简便地检测HP-PRRSV。黄震等[11]建立了基于SYBR GreenⅠ染料技术实时荧光定量PCR方法检测PRRSV,结果显示该方法具有较好的重复性和特异性,检测灵敏度达到13 copies/μL。但这些建立的方法使用SYBR Green染料,虽然在设计时更加简便,但荧光染料能够和任何dsDNA结合,因此它也能和二聚体等非特异性DNA结合,使实验出现假阳性信号,降低了实验的特异性。陶海静等[12]建立了基于TaqMan探针的实时荧光定量PCR检测PRRSV方法,但其灵敏度相对较差。PRRSV感染后仍将在猪只特定位点持续低水平存在,主要存在于淋巴组织[13],对此阶段的宿主进行PRRSV病原检测就需要更高的灵敏性、特异性和准确性的方法。本实验建立的TaqMan实时荧光定量PCR方法检测灵敏度可达5 copies/μL,能够在PRRSV感染早期和晚期进行准确诊断检测。
本研究对60份肺、脾以及58份血清样本采用荧光定量PCR方法进行了检测,并与普通PCR方法检测结果进行比较分析,阳性率分别高达16.7%和24.1%。本研究建立的实时荧光定量PCR方法具有较高的检测灵敏度,由于检测阳性样品均具有高的病毒滴度,两种检测方法在所检测的样本范围内符合率100%,但本试验所建立的检测方法不但可以对PRRSV定性检测,还可以对PRRSV进行定量检测,同时也免去了DNA电泳的步骤,更加方便省时,而在病毒含量低和大量临床样品检测时具有更明显的优势。所检测血清样本的阳性感染率与张志等[14]在2009年部分地区规模猪场全血多种病原监测中PRRSV流行调查结果一致;组织样品的感染率与徐丽华等[15]调查结果相比差异较大,表明在不同地区因管理水平和卫生条件不同,感染率可相差很大。
本研究采用TaqMan探针技术成功建立了荧光定量PCR检测PRRSV的方法,确定了该方法检测的最佳条件,验证了该方法的敏感性、特异性和重复性.并成功应用于临床样品的检测。结果表明本研究建立的方法可有效应用于对PRRSV的检测,为蓝耳病防治提供科学依据,同时可用于疫苗效价评估和致病机理等方面的研究。
[1] Cho J G,Dee S A.Porcine reproductive and respiratory syndrome virus[J].Theriogenology,2006,66(3): 655-662.
[2] Wensvoort G,Terpstra C,Pol J M A,et al.Mystery swine disease in the Netherlands: the isolation of Lelystad virus[J].Veterinary Quarterly,1991,13(3): 121-130.
[3] Benfield D A,Jackwood D J,Bae I,et al.Detection of transmissible gastroenteritis virus using cDNA probes[J].Archives of Virology,1991,116(1-4): 91-106.
[4] Bustin S A,Benes V,Nolan T,et al.Quantitative real-time RT-PCR-a perspective[J].Journal of Molecular Endocrinology,2005,34(3): 597-601.
[5] Bièche I,Noguès C,Paradis V,et al.Quantitation of hTERT gene expression in sporadic breast tumors with a real-time reverse transcription-polymerase chain reaction assay[J].Clinical Cancer Research,2000,6(2): 452-459.
[6] Ren X,Wang M,Yin J,et al.Phages harboring specific peptides to N protein of PRRSV distinguish the virus from other viruses[J].Journal of Clinical Microbiology,2010,48(5): 1875-1881.
[7] 丛晓燕,吴家强,李 俊,等.猪繁殖与呼吸综合征病毒SX-1株N蛋白单克隆抗体的制备[J].家畜生态学报,2011,32(6): 61-65.
[8] 吴胜昔,邵烈刚,曾 政,等.猪繁殖与呼吸综合症病毒核衣壳蛋白的原核表达及单克隆抗体制备[J].免疫学杂志,2013,29(10): 894-897.
[9] Castillo A,Tolón M R,Fernández-Ruiz J,et al.The neuroprotective effect of cannabidiol in an in vitro model of newborn hypoxic-ischemic brain damage in mice is mediated by CB 2 and adenosine receptors[J].Neurobiology of Disease,2010,37(2): 434-440.
[10] 杨宗照,母安雄,方维焕.高致病性猪繁殖与呼吸综合征病毒实时荧光定量PCR方法的建立[J].中国预防兽医学报,2009,31(4): 288-291.
[11] 黄 震,魏春娅,闫明菲,等.猪繁殖与呼吸综合征病毒 SYBR Green Ⅰ荧光定量PCR检测方法的建立[J].中国畜牧兽医,2013,40(4): 89-92.
[12] 陶海静,王老七.基于TaqMan探针的猪繁殖与呼吸综合征病毒荧光定量PCR检测方法的研究[J].中国兽医杂志,2009 (10): 9-12.
[13] Allende R,Laegreid W W,Kutish G F,et al.Porcine reproductive and respiratory syndrome virus: description of persistence in individual pigs upon experimental infection[J].Journal of Virology,2000,74(22): 10834-10837.
[14] 张 志,王赛赛,李 岚,等.猪全血中多种病原流行病学监测的初步研究[J].中国动物检疫,2012,29(2): 46-48.
[15] 徐丽华,王一成,袁秀芳,等.2008-2011年浙江省猪主要病毒性疫病病原流行病学调查[J].浙江农业学报,2012,24(3): 383-387.
(责任编辑:许惠儿)
Rapid Detection of Porcine Reproductive and Respiratory Syndrome Virus by Real-Time Fluorescence Quantitative PCR
WUHai-gang,RAOPin-bin,CAIYe,QUANYan-ping,JIANGYong-hou
(School of Life Science,Zhejiang Sci-Tech University,Hangzhou 310018,China)
The purpose of this study is to develop TaqMan-based real-time fluorescence quantitative PCR method which can detect rapidly porcine reproductive and respiratory syndrome virus (PRRSV).Primers and TaqMan probe were designed in accordance with ORF7 conserved sequence of PRRSV.Based on conventional PCR,fluorescence quantitative PCR based on TaqMan probe was designed and optimized to detect PRRSV.The results show correlation coefficient of real-time fluorescence quantitative PCR based on TaqMan probe is greater than 99%,with amplification efficiency of 97%.It has a good linear relation.The method was used to detect porcine circovirus type 2 (PCV2),porcine parvovirus (PPV),pseudorabies virus (PRV),classical swine fever virus (CSFV) and Japanese encephalitis virus (JEV).The results were negative.This shows this method has favorable specificity.The sensitivity test indicates detection limit of this method is 5 copies/μL.58 serum and 60 tissue samples were tested with such method.14 positive serums and 10 positive tissues were detected.These results show real-time fluorescence quantitative PCR based on TaqMan probe owns good specificity,sensitivity and repeatability.It can provide more efficient technical platform for clinical detection of PRRSV.
porcine reproductive and respiratory syndrome virus; TaqMan probe; real-time fluorescence quantitative PCR; detection
1673-3851 (2015) 02-0258-06
2014-05-20
浙江省自然科学基金项目(Y3090166);国家自然科学基金项目(31101831)
吴海港(1988-),男,浙江绍兴人,硕士研究生,主要从事病毒分子诊断方面的研究。
姜永厚,E-mail:yonghoujiang@zstu.edu.cn
S852.659.6
A
——一道江苏高考题的奥秘解读和拓展

