姜黄素亚型B14对HK Ⅱ细胞损伤的保护作用及机制
马佳男,刘秋菊, 安 伟,程 飞,魏 巍
(1.吉林大学基础医学院,吉林 长春 130021;2.吉林大学第一医院泌尿外科,吉林 长春 130021;3.吉林大学第一医院肿瘤中心,吉林 长春 130021)
姜黄素亚型B14对HK Ⅱ细胞损伤的保护作用及机制
马佳男1,2,刘秋菊3, 安 伟1,程 飞1,魏 巍1
(1.吉林大学基础医学院,吉林 长春 130021;2.吉林大学第一医院泌尿外科,吉林 长春 130021;3.吉林大学第一医院肿瘤中心,吉林 长春 130021)
采用CCK-8比色法检测了姜黄素(Cur)及其亚型对人肾皮质近曲小管上皮细胞(HK Ⅱ)的损伤作用;采用ELISA法检测了不同浓度和时间条件下血管紧张素Ⅱ(Angiotensin Ⅱ,Ang Ⅱ)对HK Ⅱ细胞Cleaved caspase-3表达的影响,并建立了糖尿病肾病细胞模型;利用此模型研究了B14对HK Ⅱ细胞的保护作用及机制.结果表明:Cur及其亚型B13,B14对HK Ⅱ细胞均无毒害作用;以Ang Ⅱ 250 nmol/L培养48 h时,可建立最佳糖尿病肾病模型.B14对Ang Ⅱ引起的HK Ⅱ细胞损伤具有保护作用,且此种保护作用与PI3K信号通路有关.
姜黄素亚型B14;血管紧张素Ⅱ;糖尿病肾病;人肾皮质近曲小管上皮细胞
糖尿病(diabetes mellitus,DM)是一种常见的代谢紊乱性疾病.25%~40% 的糖尿病患者最终发展为糖尿病肾病(diabetic nephropathy,DN),而糖尿病肾病常由糖尿病的微血管病变引起,是糖尿病最主要的微血管并发症,也是导致终末期肾病(end-stage renal disease,ESRD)的首要原因.[1]
血管紧张素Ⅱ(Angiotensin Ⅱ,Ang Ⅱ)是已知最强的缩血管活性物质之一,它可引起血流动力学变化从而造成细胞损伤.研究发现,AngⅡ造成的细胞损伤是糖尿病肾病发生、发展的主要诱因之一[2].
姜黄素(curcumin,Cur)是从姜科植物姜黄中提取的一种植物多酚,具有抗感染、抗氧化及抗肿瘤等作用.近年来的研究发现,Cur对很多疾病引起的细胞损伤及纤维化有明显的保护作用[3].陈丽等研究证实,Cur对糖尿病大鼠肾脏病变具有明显的防治作用[4];梁广等以Cur为先导物,设计、合成了姜黄素结构类似物和衍生物,并对其活性进行了检测,其中亚型B14有明显的抗细胞凋亡及抗肿瘤活性.[5]
本实验基于以上研究,探讨了B14对AngⅡ诱导的人肾皮质近曲小管上皮细胞损伤的保护作用及机制,以为研究糖尿病肾病的发病机制和研制新型预防糖尿病肾病的药物奠定实验基础.
1 材料与方法
1.1 主要材料与试剂
人肾皮质近曲小管上皮细胞(HK Ⅱ)、姜黄素及其亚型B13和B14由美国路易斯威尔大学医学中心馈赠.DMEM培养基和胎牛血清购自GIBCO公司;胰蛋白酶和青链霉素混合溶液购自北京鼎国生物技术有限公司;CCK-8试剂购自Beyotime公司;Cleaved caspase-3试剂盒购自细胞信号技术有限公司(Cell Signaling Technology Co.);其他化学试剂均为国产分析纯.
1.2 方法
1.2.1 细胞培养及传代
将HK Ⅱ细胞用含10% 胎牛血清的DMEM培养基培养于37℃、含5%CO2的饱和湿度培养箱中,每2~3 d换液1次.当镜下观察细胞融合度达80%~90%时,进行细胞传代.
1.2.2 Cur及B13,B14对HK Ⅱ细胞活性影响的检测
将对数生长期的HK Ⅱ细胞调至 1×105个/mL后接种于3块96孔培养板中,每孔100 μL,设空白组、Cur组、B13组、B14组4组,每组6个复孔,以调零孔进行调零比对.空白组只加培养液;给药组分别加2.5 nmol/L的Cur及B13,B14.然后移至37℃、含5% CO2的饱和湿度培养箱孵育24,48,72 h.分别取出培养板,采用CCK-8法测定各孔D(450)值,计算细胞相对存活率.
细胞相对存活率=(D(450)给药组-D(450)调零组)/(D(450)空白组-D(450)调零组)×100%.
1.2.3 DN模型的建立
将对数生长期的HK Ⅱ细胞调至 1×105个/mL后接种于96孔培养板中,每孔100 μL.依据文献[5],将100 nmol/L的Ang Ⅱ加入到培养基中进行培养,分别在不同的时间段取出,用ELISA法检测细胞内Cleaved capase-3蛋白的表达情况,以确定最佳造模时间.然后,选取不同浓度的Ang Ⅱ加入到培养基中,按上述最佳造模时间培养后取出,用ELISA法检测细胞内Cleaved capase-3蛋白的表达情况,以确定最佳给药浓度.
1.2.4 B14对HK Ⅱ细胞损伤的保护作用及机制
将对数生长期的HK Ⅱ细胞调至4×105个/mL后接种于6孔培养板中,每孔加细胞悬液2 mL.然后移至37℃、含5% CO2的饱和湿度培养箱孵育.实验分为5组:空白组不给任何药物;Ang Ⅱ组添加最佳造模浓度的Ang Ⅱ;B13组、Cur组和B14组在添加最佳造模浓度的Ang Ⅱ的同时添加2.5 nmol/L的 B13,Cur和 B14.此外,另设5组,按上述各组给药的同时再分别添加PI3K蛋白抑制剂.以上所有各组在培养最佳造模时间后,分别用ELISA法检测细胞内Cleaved caspase-3蛋白的表达量,检测方法参照试剂盒说明书.
1.2.5 统计学处理
采用SPSS15.0进行数据处理,各组实验数据均用平均值±标准差表示.两组间差异显著性分析用两样本均数差别的t检验,P<0.05表示有显著性差异,P<0.01表示有极显著性差异.
2 结果
2.1 Cur及B13,B14对细胞活性的影响
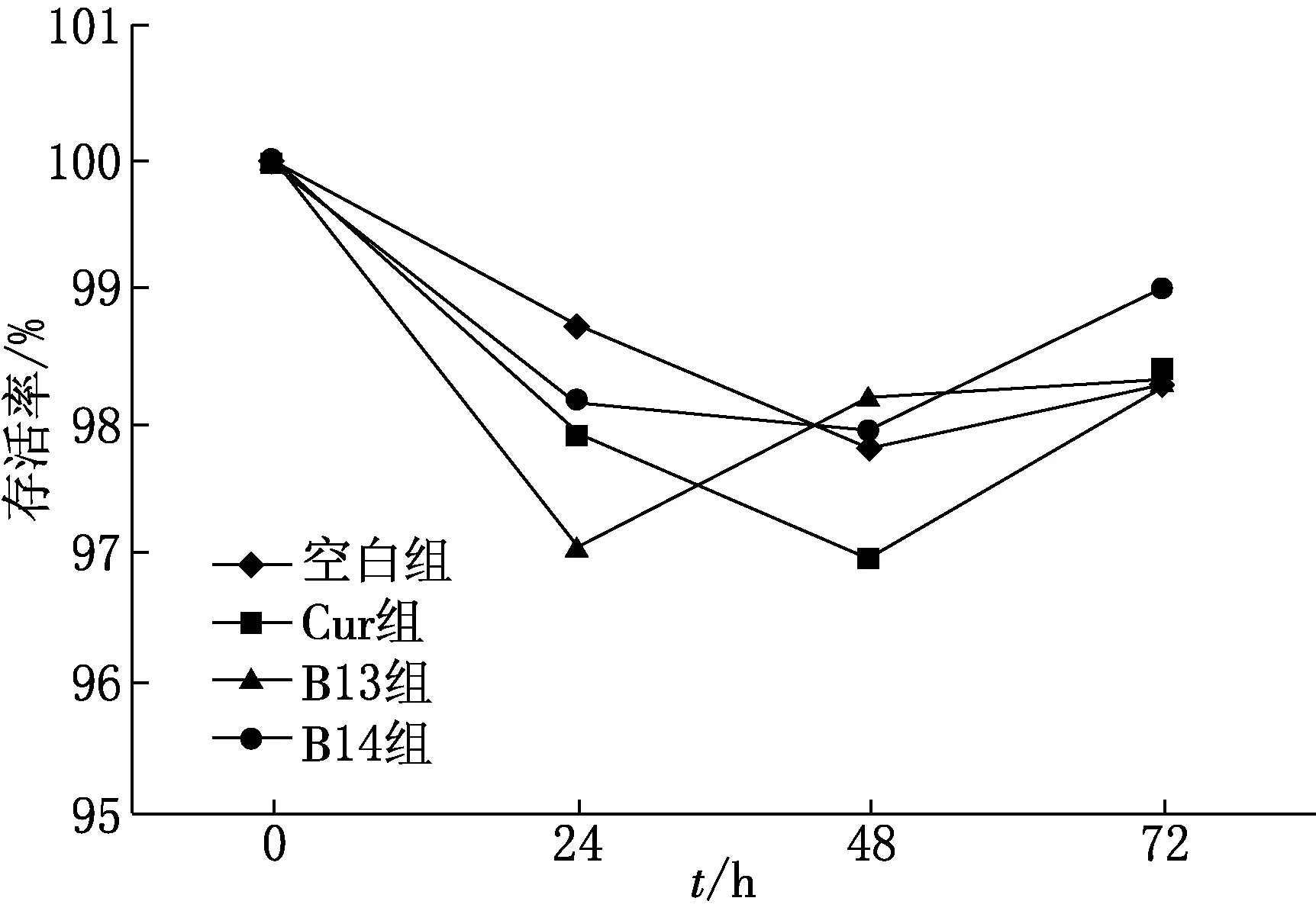
图1 Cur及B13,B14对HK Ⅱ细胞存活率的影响
如图1所示,Cur及B13,B14在对HK Ⅱ细胞作用24,48,72 h时,细胞的存活率均大于97%,与空白组相比,无显著性差异(P>0.05),表明上述药物对细胞无明显毒害作用,可用于后续实验研究.
2.2 DN模型结果
Cleaved caspase-3蛋白的表达变化是反映细胞凋亡程度的敏感指标,因此,测定细胞中Cleaved caspase-3蛋白的含量可判断细胞损伤的程度.本实验通过ELISA方法检测了给予不同浓度AngⅡ、培养不同时间后细胞内Cleaved caspase-3蛋白的含量,结果如图2、图3所示.由图2、图3可见,当AngⅡ浓度为250 nmol/L,培养时间为48 h时,HK Ⅱ细胞Cleaved caspase-3的表达量较空白组显著升高(P<0.05),表明AngⅡ致HK Ⅱ细胞发生DN的最佳给药浓度和时间分别为250 nmol/L和48 h.
2.3 B14对HK Ⅱ细胞损伤的保护作用
由图4可见,AngⅡ组Cleaved caspase-3蛋白表达量明显增加,即细胞凋亡明显增加,与空白组相比差异极显著(P<0.01);而Cur组和B14组的Cleaved caspase-3蛋白表达量下降,细胞凋亡减少,与AngⅡ组相比差异显著(P<0.05),其中以B14组的细胞凋亡降低最为明显(P<0.01),而B13组Cleaved caspase-3蛋白表达量与模型组相比无明显下降(P>0.05).这说明Cur及B14均对AngⅡ造成的HK Ⅱ细胞损伤有保护作用,且以B14效果最好.
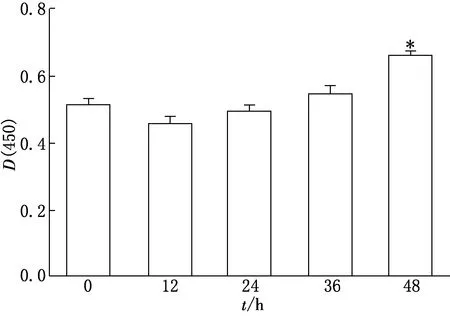
*P<0.05(vs空白组)图2 AngⅡ处理时间对HK Ⅱ细胞Cleaved caspase-3蛋白表达的影响
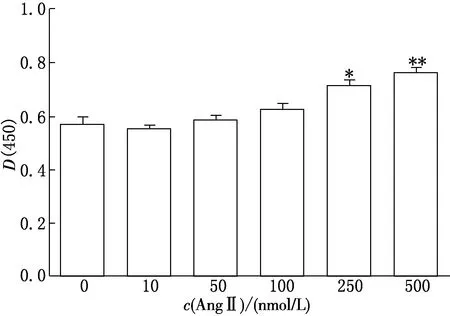
*P<0.05,**P<0.01(vs空白组)图3 AngⅡ处理浓度对HK Ⅱ细胞Cleaved caspase-3表达的影响
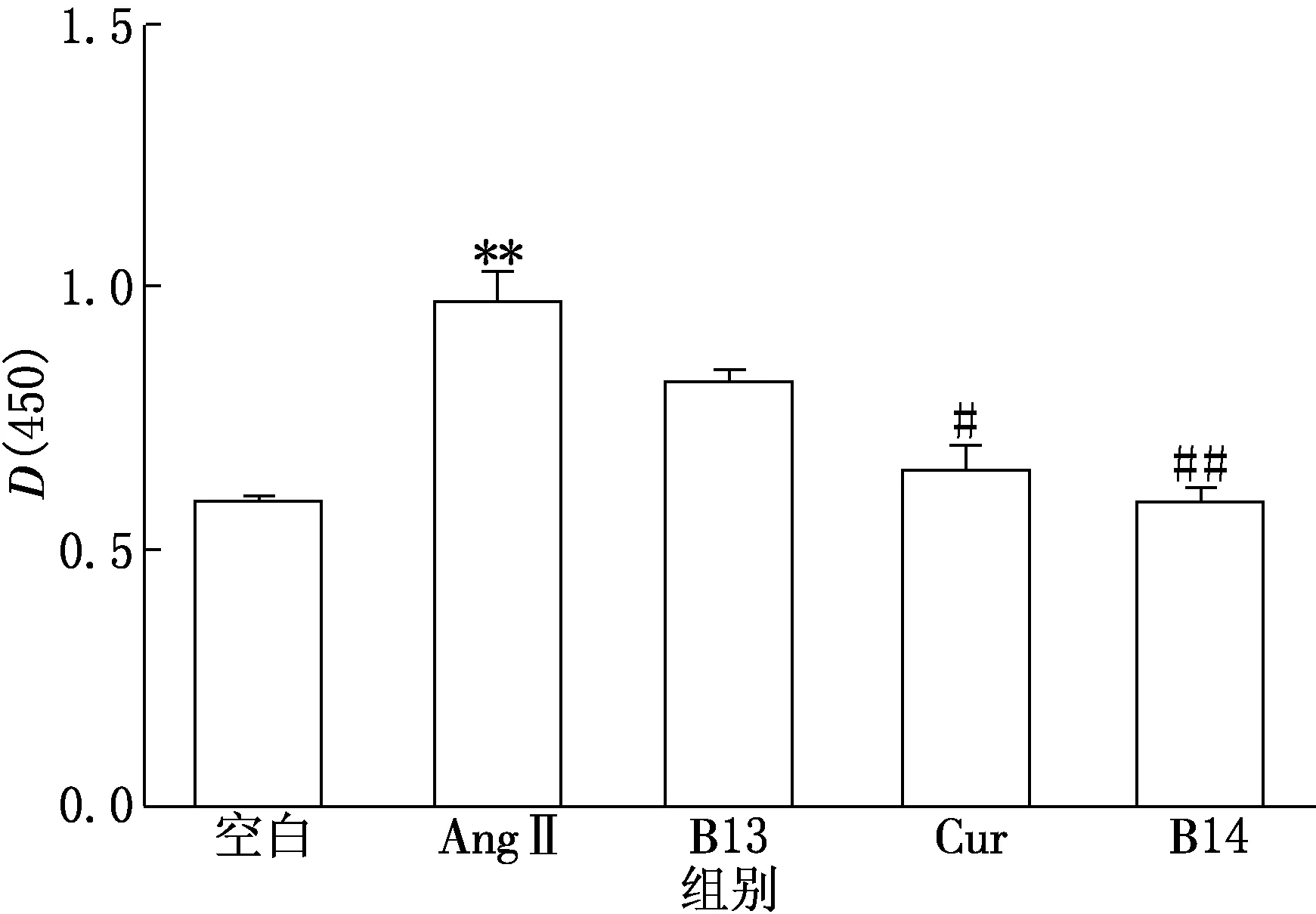
**P<0.01(vs空白组);#P<0.05,##P<0.01(vs AngⅡ组)图4 ELISA法检测各组HK Ⅱ细胞Cleaved caspase-3蛋白表达情况
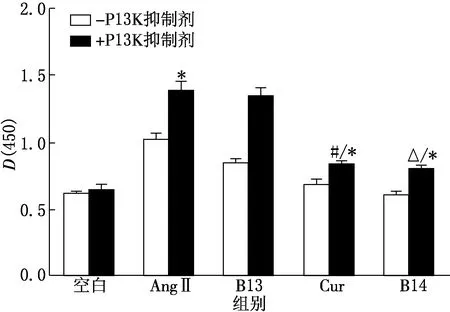
*P<0.05(vs AngⅡ组),#P<0.05(vs Cur+PI3K抑制剂组),ΔP<0.05(vs B14+PI3K抑制剂组)图5 PI3K抑制剂对HK Ⅱ细胞Cleaved caspase-3蛋白表达的影响
2.4 B14对HK Ⅱ细胞损伤保护作用的机制
由图5可见,AngⅡ+PI3K抑制剂组Cleaved caspase-3蛋白表达量明显升高,与AngⅡ组相比差异显著(P<0.05),说明PI3K信号通路的激活可抑制细胞凋亡;Cur+PI3K抑制剂组、B14+PI3K抑制剂组与Cur组、B14组相比Cleaved caspase-3表达量升高(P<0.05),说明加入PI3K抑制剂后,Cur及B14 对细胞损伤的保护作用有所下降,即Cur及B14对HK Ⅱ损伤的保护作用机制与PI3K信号通路有关;而Cur+PI3K抑制剂组、B14+PI3K抑制剂组与AngⅡ组相比Cleaved caspase-3蛋白表达量仍下降(P<0.05),说明加入PI3K抑制剂阻断PI3K信号通路后,Cur及B14 仍对细胞损伤有保护作用,即Cur及B14对HK Ⅱ细胞损伤的保护作用还与其他信号通路有关.
3 讨论
糖尿病肾病(diabetic nephropathy,DN)是由糖代谢异常为主因所致的肾小球硬化,是糖尿病病人最重要的并发症之一,其发病率在我国呈上升趋势.目前,DN已成为终末期肾脏疾病的第二位,仅次于各种肾小球肾炎.由于DN存在复杂的代谢紊乱,一旦发展到终末期肾病,往往比其他肾脏疾病的治疗更加困难,因此早期防治对延缓DN意义重大.研究发现,在DN中,Ang Ⅱ 可引起血流动力学变化,其介导细胞因子引起的细胞凋亡也越来越为人们所重视.[2]另外,Ang Ⅱ 受体拮抗剂也被发现并广泛用于治疗DN[7].因此,本实验利用Ang Ⅱ制备肾小管上皮细胞DN模型,并通过检测Cleaved caspase-3蛋白的表达确定最佳的造模浓度和时间,结果表明250 nmol/L的Ang Ⅱ 培养48 h可建立最佳的DN模型.
姜黄为常用中药,具有行气破瘀、通经止痛、清心解毒等功效,其主要生物活性成分为姜黄素类和挥发油.其中Cur具有降血脂、抗凝、抗氧化、利胆、抗癌等作用[3].已有研究证实[4],Cur对Ⅱ型糖尿病肾病的大鼠肾脏具有保护作用.本实验研究了Cur及其提取物B13,B14对肾脏的保护作用.结果发现,Cur及其提取物亚型B14均可不同程度地降低Cleaved caspase-3蛋白的表达,抑制细胞凋亡,其中以B14效果最好.表明B14对Ang Ⅱ引起的HK Ⅱ细胞损伤具有较Cur更强的保护作用.
PI3K-AKT-mTOR信号通路是细胞凋亡的重要信号通路,参与了不同种类细胞存活调节和抗凋亡的过程,其转导过程的关键信号分子为PI3K蛋白.PI3K本身不但具有丝氨酸/苏氨酸(Ser/Thr)激酶活性,也具有磷脂酰肌醇激酶的活性.当接受来自酪氨酸激酶和G蛋白偶联受体信号后,可将刺激信号转导到细胞内,促进细胞增殖和抑制细胞凋亡.[8]大量研究表明,PI3K/AKT可通过多种途径发挥抗凋亡作用,被称为经典的抗凋亡通路.[9]研究证实[10],PI3K-AKT-mTOR是肾脏损伤过程中关键的信号通路.本实验通过给予抑制PI3K-AKT-mTOR信号通路的抑制剂研究了B14对HK Ⅱ细胞损伤的保护作用机制,结果发现,加入PI3K抑制剂后,B14虽仍具有对HK Ⅱ细胞的保护作用,但这种保护作用的程度明显下降,表明B14对HK Ⅱ细胞损伤的保护作用与激活PI3K-AKT-mTOR信号通路,进而抑制细胞凋亡有关,但并非唯一的作用途径,有关的其他保护作用的机制还有待进一步研究.本实验研究结果为今后DN药物的治疗提供了一个新的思路和方法.
[1] 卢叶,李海明. 基于指南之糖尿病肾病的诊疗[J]. 上海医药,2013, 34(18):6-9.
[2] OLEARCZYK J J,QUIGLEY J E,MITCHELL B C,et al. Administration of a substituted adamantyl urea inhibitor of soluble epoxide hydrolase protects the kidney from damage in hypertensive Goto-Kakizaki rats[J]. Clin Sci (Lond),2009,116(1):61-70.
[3] CALABRESE V,BATES T E,MANCUSO C, et al. Curcumin and the cellular stress response in free radical-related diseases[J]. Mol Nutr Food Res,2008,52 (9):1062-1073.
[4] 陈丽,刘晓城. 姜黄素对糖尿病大鼠肾脏的保护作用及对血红素加氧酶表达的影响[J]. 武汉大学学报(医学版),2009,30(1):43-46.
[5] 梁广,田吉来,郭丽丽. 姜黄素的构效关系及以其为先导物的抗肿瘤化合物研究进展[J]. 化学通报,2008(2):110-118.
[6] 梁绪国,侯桂华,潘其兴.血管紧张素Ⅱ 、卡托普利及氯沙坦对血管内皮细胞凋亡的影响[J].山东大学学报(医学版),2002,40(4):300-304.
[7] 潘道延,沈洁. 肾素-血管紧张素-醛固酮系统与糖尿病肾病[J].中华临床医师杂志,2015,9(4):523-527.
[8] YAN R,ZHANG Z M,FANG X Y,et al.Synthesis,molecular docking and biological evaluation of 1,3,4-oxadiazole derivatives as potential immunosuppressive agent[J].Bioorg Med Chem,2012,20 (4):1373-1379.
[9] 潘蓉蓉,金永喜,朱文宗. PI3K/Akt信号通路介导的细胞凋亡机制研究进展[J]. 浙江中西医结合杂志,2013,23(1):70-71.
[10] XIE L,ZHENG X,QIN J,et al. Role of PI3-kinase/Akt signalling pathway in renal function and cell proliferation after renal ischaemia/reperfusion injury in mice[J]. Nephrology (Carlton),2006,11(3):207-212.
(责任编辑:方 林)
The protective effect and mechanism of curcumin subtype B14 to HK Ⅱ injury
MA Jia-nan1,2,LIU Qiu-ju3,AN Wei1,CHENG Fei1,WEI Wei1
(1.The College of Basic Medical Sciences,Jilin University,Changchun 130021,China;2.Department of Urology,First Hospital of Jilin University,Changchun 130021,China;3.Department of Cancer Center,First Hospital of Jilin University,Changchun 130021,China)
The cell viability was detected with CCK-8 assay to observe toxic effects of curcumin(Cur) and its subtypes B13 or B14 on HK Ⅱ. Then,cleaved caspase-3 expression was detected with ELISA kit at different time and concentration of Angiotensin Ⅱ(Ang Ⅱ) in order to establish diabetic nephropathy cell model. Finally,the protective role and mechanism of Cur subtype B14 in the HK Ⅱ were researched with the cell model. The results showed that Cur and its subtypes B13 or B14 had no toxic effects on the HK Ⅱ cells. Diabetic nephropathy cell model could be established with 250 nmol/L Ang Ⅱ for 48 h. B14 can protect HK Ⅱ injury induced by Ang Ⅱ and this process could be associated with PI3K signaling pathway. This paper laid a foundation for researching the pathogenesis and developing new drugs of diabetic nephropathy.
curcumin subtype B14;Ang Ⅱ;diabetic nephropathy;HK Ⅱ
1000-1832(2015)04-0129-04
10.16163/j.cnki.22-1123/n.2015.04.027
2015-05-03
国家自然科学基金青年科学基金资助项目(81302860);白求恩医学科研支持计划青年科研基金资助项目(2013205034).
马佳男(1992—),女,硕士研究生,主要从事泌尿外科基础和临床研究;通讯作者:魏巍(1975—),男,博士,副教授,主要从事泌尿外科临床研究.
R 692.6 [学科代码] 320·2435
A

