断层解剖学分析在四肢软组织肉瘤手术计划中的应用
李觅 任晔 杨卿 郭风劲 杨彩虹
·临床研究论著·
断层解剖学分析在四肢软组织肉瘤手术计划中的应用
李觅 任晔 杨卿 郭风劲 杨彩虹
目的 探讨断层解剖学分析在软组织肉瘤外科边界设计中的作用。方法 2012年3月至2014年12月我科收治四肢软组织肉瘤患者10例,术前行0.625 mm薄层扫描MRI和/或CTA检查。逐层详细分析断层解剖结构,确定肿瘤累及间室、反应带区域,以间室结合广泛边缘切除为原则准确设计肿瘤切除的边界,手术严格按照设计边界进行。对术后标本观察反应带和边界厚度,做两个维度最小边界测量,病理学检查明确肿瘤性质,确认切除标本边缘是否存在肿瘤细胞。结果 ①术后肿瘤实体与术前断层解剖分析大小相比差异无统计学意义(P>0.05)。②术后测量肿瘤外正常组织厚度,手术类型达到广泛切除或治愈性切除标准,与术前计划一致。肿瘤完整切除,术后手术切缘病理检查未发现肿瘤细胞浸润。③末次随访患者功能恢复良好,未见肿瘤复发。结论 逐层断层解剖分析为软组织肉瘤提供精确数字化外科边界,合理而精确切口设计,减少出血、创伤和肿瘤污染的可能性,有利于肿瘤切除时实现治愈性切除。规范断层解剖影像学检查和逐层断层解剖分析应该成为恶性软组织肉瘤切除术前设计必要步骤。
磁共振成像;诊断显像;软组织肿瘤;预测
近年来,四肢软组织肉瘤保肢治疗越来越受到关注。美国癌症联合会(American Joint Committee on Cancer,AJCC)指南强调,肉瘤手术切除范围要尽可能大以减少局部复发的可能,同时又要尽可能小以保留更多功能[1]。Enneking等[2,3]以间室为基础,提出软组织肉瘤外科手术分期系统,对软组织肉瘤手术治疗具有指导意义。但该分期在实际临床操作中存在一定问题,外科医生依旧凭借各自经验来进行手术,导致软组织肉瘤治疗及预后差异很大。20世纪80年代后期,Kawaguchi等[4-7]提出以边界为基础外科手术分期,希望能在安全边界内完成肿瘤切除,从而规范软组织肉瘤手术治疗。肿瘤周围阻碍其生长的正常组织均被认为是屏障,依据屏障中胶原纤维含量不同分为“厚屏障”与“薄屏障”。 屏障可以转换为相应厚度正常组织,肿瘤反应带边缘没有接触屏障时,“厚屏障”被认为是3 cm正常组织,而“薄屏障”是2 cm正常组织,软骨是5 cm正常组织。而当肿瘤反应带边缘接触屏障时,所有屏障换算值要减去1 cm。但该体系建立在术后病理检查基础上,术前边界无法确定,对指导手术切除存在困难。断层解剖影像资料能够为术前确定肿瘤外科边界,制定手术计划提供帮助。
资料与方法
一、一般资料
本研究选取2012年3月至2013年12月我科收治的10例软组织肉瘤患者,男5例,女5例,平均年龄38.6岁。均为下肢软组织肉瘤。术后病理检查:原始神经外胚叶肿瘤5例,脂肪肉瘤3例,滑膜肉瘤2例。
二、手术方法
术前对患处行薄层CT平扫及增强检查,参数为12 keV、240 mA,扫描层距为0.625 mm。同一部位行MRI冠状位、矢状位和水平位扫描,SE序列T1WI TR/TE=400 ms/12 ms。分别确定CT及MRI片上肿瘤起止点位置,测量水平及垂直方向上最长径,以较大者作为肿瘤断层解剖影像学大小予以记录。将CT及MRI断层信息逐层进行对比分析,确定肿瘤累及间室,反应带区域及肿瘤周围正常组织。
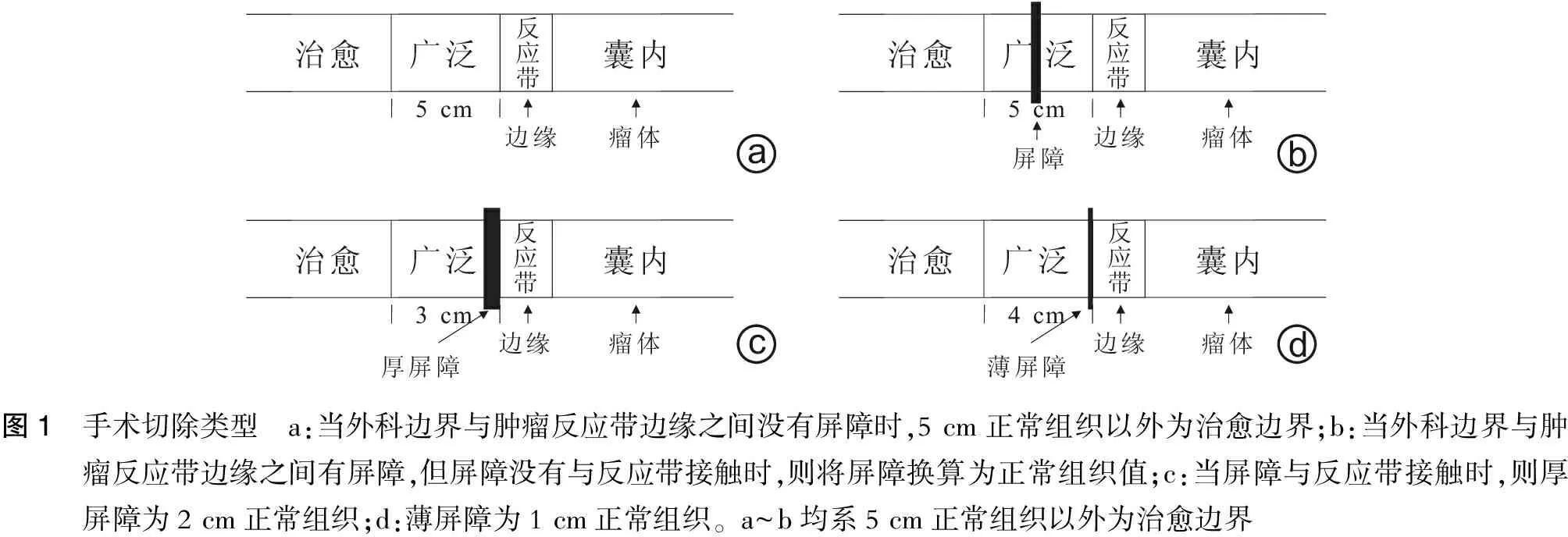
以间室结合广泛边缘切除为原则准确设计肿瘤外科边界。屏障可以转换为相应厚度正常组织,手术边界在肿瘤反应带边缘外5 cm正常组织(包含屏障在内,不考虑实际物理距离是否为5 cm)以上被认为是治愈切除。当外科边界与肿瘤反应带边缘之间有屏障,但屏障没有与反应带接触时,则将屏障换算为正常组织值;当屏障与反应带接触时,则厚屏障为2 cm正常组织;薄屏障为1 cm正常组织。均系5 cm正常组织以外为治愈边界(图1)。
确定手术边界后,结合肿瘤累及间室起止点和周围重要骨骼肌肉、神经血管位置,将最易达到肿瘤切除边界的肌间隙或肌骨间隙作为手术入路。如果肿瘤累计软组织,则以周围肌间隙作为手术入路,作梭形切口完整切除肿瘤及累及间室(图2)。如果肿瘤累及骨组织,则以周围肌骨间隙作为手术入路,完整切除肿瘤及累及骨组织。同时穿刺点和活检区域周围3 cm皮肤以内作为肿瘤一部分。
依据术前设计进行切除手术。尽量在正常组织中按设计的边界切除,避免切破瘤体及反应带,术中充分止血,吸引渗血避免肿瘤播散。小心保护肿瘤周围血管神经。对于肿瘤的供应血管从大血管分出部小心结扎切除。肿瘤完整切除后再次探查确认,对任何肉眼可见残余灶扩大切除。
术后观察标本反应带和边界厚度,测量两个维度最小边界,与术前断层解剖资料作比较。常规病理学检查,确定肿瘤诊断,同时做手术切缘观察,确认是否存在肿瘤细胞。所有患者术后每3个月复查局部MRI及肿瘤标志物,门诊随访肢体功能。
三、统计学处理
运用SPSS 18.0统计软件进行数据分析,将术后肿瘤实体测量与术前影像学进行配对t检验,P<0.05表示差异具有统计学意义。
结 果
一、随访情况
术后每3个月随访,随访时间为3.0~15.0个月,平均9.3个月。复查局部MRI,均未见肿瘤复发,1例原始神经外胚叶患者肿瘤标志物NSE轻微上升,动态观察。门诊随访肢体功能良好。
二、术后肿瘤实体与术前断层解剖分析比较
每例患者术前断层解剖分析和术后实体测量的垂直最长径和水平最长径数据比较,差异均无统计学意义(均P>0.05,表1)。
三、手术切除类型与术前计划基本一致
术后测量标本两个维度方向上肿瘤反应带以外正常组织最小值(表2)。10个病例全部达到广泛切除或治愈切除,没有边缘切除和囊内切除。7例与术前切除类型一致,3例没有达到术前制定手术类型,可能术中切除过少,导致肿瘤边界没有达到预期。10例患者均采用个体化手术入路设计,完成肿瘤切除。术后病理学检查结果提示手术切缘均未发现肿瘤细胞(图2)。
讨 论
CT及MRI检查能提供丰富断层解剖信息,是诊断恶性肿瘤重要技术。在乳腺肿瘤[8]、肝脏肿瘤[9]、胃肠道肿瘤[10]、头颈部肿瘤[11]中,断层分析影像学能确定包膜边界及周围反应带,帮助制定手术方案。1997年美国放射学诊断肿瘤小组得出结论,CT+MRI检查在局部骨与软组织肉瘤边界评价准确率上没有区别[12]。但Steinbach等[13]认为该研究结果有时代局限性,研究中大部分病例都集中于1991至1995年,而后来CT及MRI仪器有长足发展,各种影像学技术也在不断进步。而将术前MRI、CT和X线片同时和术后病理学资料进行比较后发现,只有MRI在T1加权或T2压脂资料上与组织学检查,差异没有统计学意义,而CT资料差异有统计学意义[14]。对于软组织肉瘤,可将18FDG-PET和CT资料联合应用于肿瘤手术边界确定中。Bancroft[15]通过测定7例患者肿瘤边界外1~5 cm组织不同区间内标准摄取(SUV)值,发现肿瘤瘤体平均值为11.7,肿瘤边界至1 cm区间平均值为2.2,1~2 cm为1.1,2~3 cm为0.83,3~4 cm为0.7,4~5 cm为0.64。组织学检测发现肿瘤细胞消失一般在SUV最大值小于1.0处。从而提出手术边界最佳位置为SUV值为1.0位置[15]。本研究中术前CT检查结合MRI断层解剖学分析评估肿瘤大小与术后切除肿瘤实体大小差异没有统计学意义。断层解剖分析肿瘤边界能近似表示肿瘤实体边界。
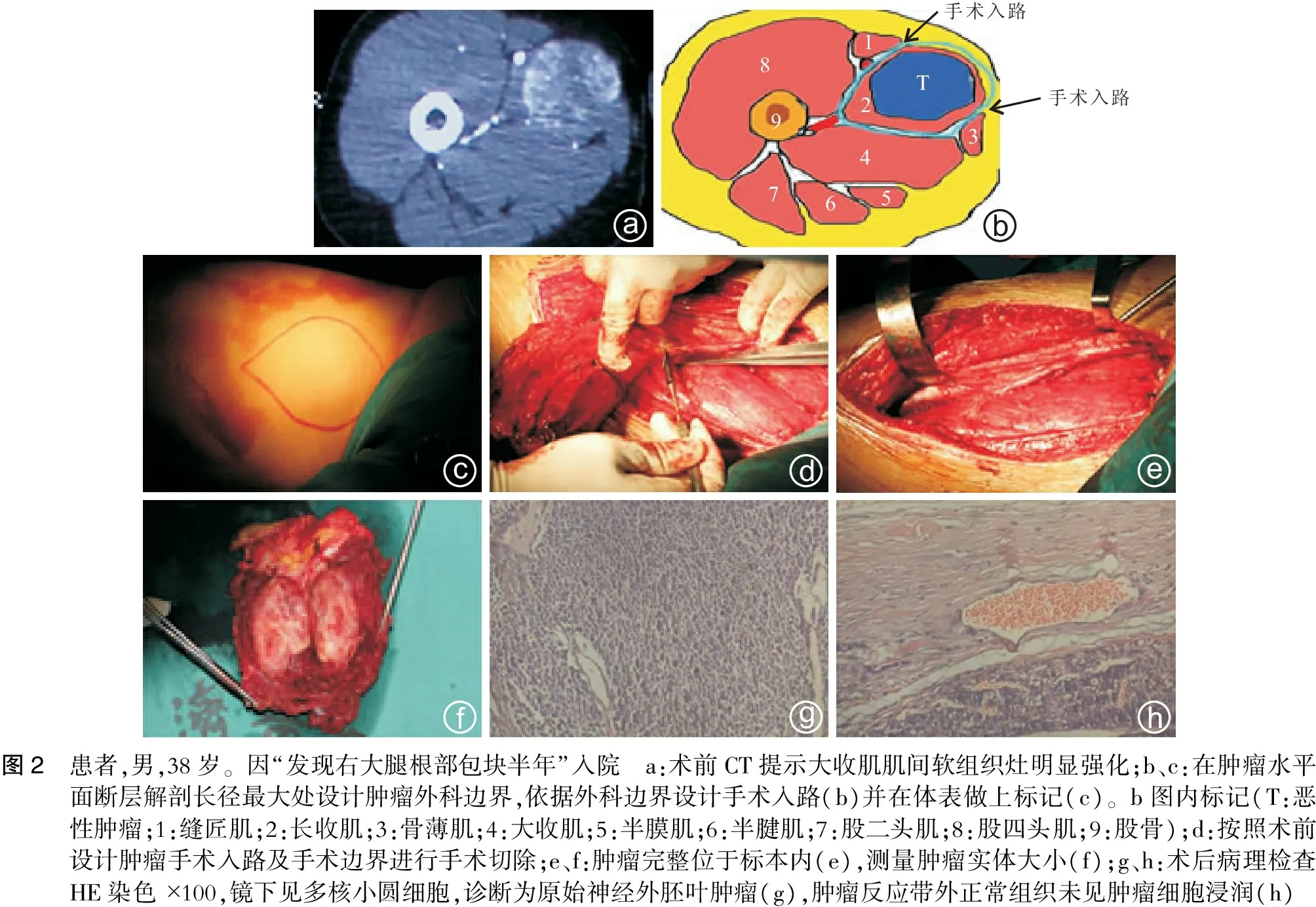
caedfhgT手术入路手术入路T123456789b图2 患者,男,38岁。因“发现右大腿根部包块半年”入院 a:术前CT提示大收肌肌间软组织灶明显强化;b、c:在肿瘤水平面断层解剖长径最大处设计肿瘤外科边界,依据外科边界设计手术入路(b)并在体表做上标记(c)。b图内标记(T:恶性肿瘤;1:缝匠肌;2:长收肌;3:骨薄肌;4:大收肌;5:半膜肌;6:半腱肌;7:股二头肌;8:股四头肌;9:股骨);d:按照术前设计肿瘤手术入路及手术边界进行手术切除;e、f:肿瘤完整位于标本内(e),测量肿瘤实体大小(f);g、h:术后病理检查HE染色×100,镜下见多核小圆细胞,诊断为原始神经外胚叶肿瘤(g),肿瘤反应带外正常组织未见肿瘤细胞浸润(h)
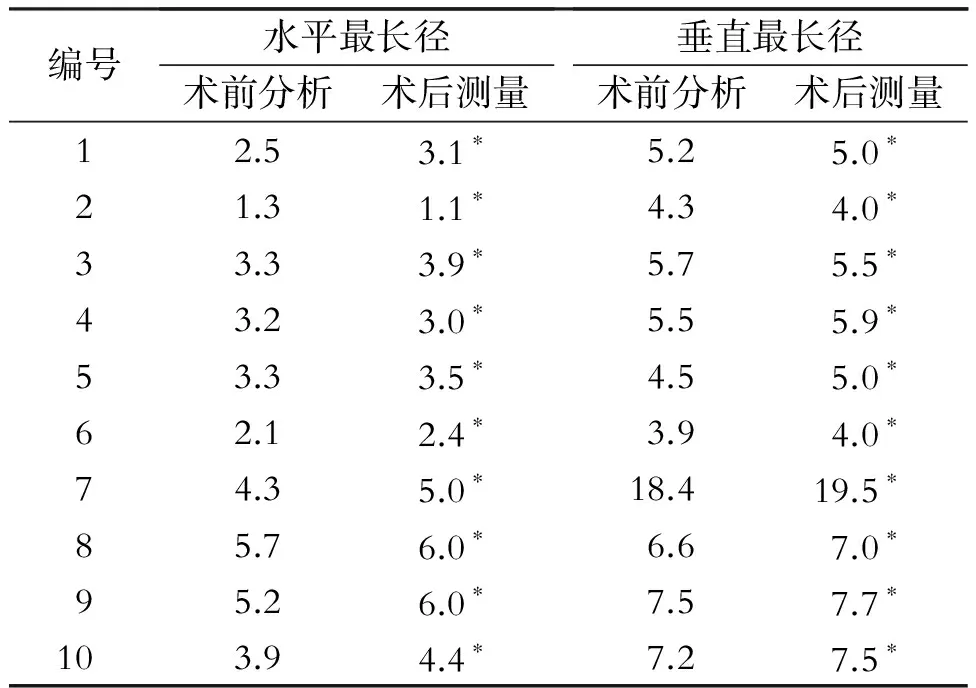
表1 10例患者不同方法测量肿瘤最长径(cm)
注:与术前断层解剖分析最长径比较,*P>0.05
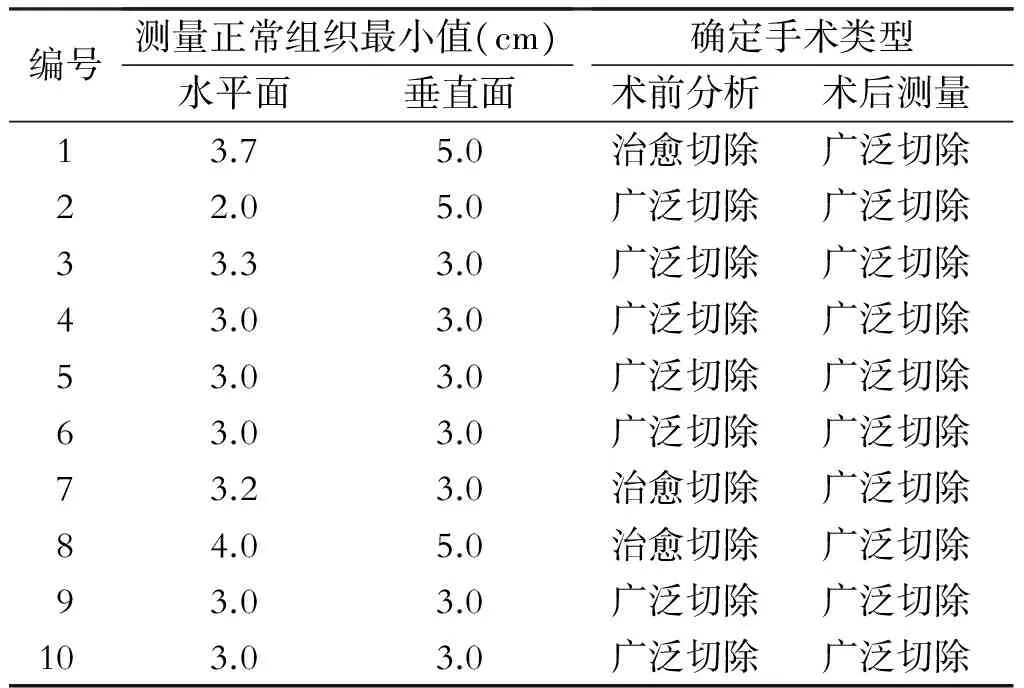
表2 10例患者肿瘤标本边界外最小正常组织值
薄层扫描层距最小值可达0.625 mm,大大提高了局部分辨率。逐层详细分析这些信息,结合边界体系,能够在术前制定出详细手术边界。同时,随着扫描层距减小,垂直维度上肿瘤大小评估更准确,为多维度肿瘤外科边界设计提供更加科学依据。
以间室结合Kawaguchi等[4-7]提出的外科手术分期为原则准确设计肿瘤外科边界。对于有条件的患者尽量选择治愈切除或广泛切除,避免囊内切除,有利于降低术后肿瘤复发率和转移率。当肿瘤边界紧邻血管神经,若为了避免损伤血管神经考虑行边缘切除,可能会导致肿瘤未彻底切除,增加术后肿瘤复发率;有时行治愈切除或广泛切除+神经血管移植也是一种选择方式。骨肿瘤医生应结合每位患者的不同情况进行判断再选择行何种手术方式。
断层分析影像学上肿瘤边界不清,无法确定肿瘤边界,或者当肿瘤反应带在几个层面中间断出现,均可以以最后一次出现断层面近似代替肿瘤边界。尽可能降低扫描间距,能提高肿瘤边界的近似度。这项工作对断层解剖学知识及影像学读片能力有较高要求,需要在经验丰富的骨肿瘤医生指导下完成,在术前花费大量时间反复阅片确定。
软组织肉瘤累及单个间室,一般沿间室生长[16]。间室之间屏障能阻止肿瘤发展。间室外完整切除肿瘤可以达到广泛切除甚至治愈切除的目标[17]。而对于累及多个间室恶性肿瘤,应将肿瘤侵犯屏障也视为肿瘤一部分,尽可能将多个间室整体切除。对于软组织肉瘤,手术边界被肿瘤细胞浸润污染后,局部复发率较大升高,远期无转移,生存率较低[18]。本研究病例采用广泛切除和治愈切除,手术切缘均未见肿瘤细胞浸润,保证了肿瘤整体切除同时降低局部复发。
对于软组织肉瘤一般选择传统手术入路或联合入路切除[19,20],但面临关键部位暴露不理想、暴露不充分、手术切口长度不合适等问题。本研究在确定外科边界基础上,选择最易达到肿瘤手术切除边界肌间隙或肌骨间隙作为手术入路。手术时快速到达肿瘤边界,充分暴露,同时依据薄层影像资料精确制定切口长度,既能完成肿瘤整体切除,也能实现手术切口最小化,在一些特殊部位肿瘤切除中有重要意义。
对放化疗敏感的软组织肉瘤,可术前行新辅助放化疗,待肿瘤瘤体缩小后再评估手术边界、确定手术入路。但仍建议放化疗前行肿瘤影像学检查,与放化疗后对比可确定肿瘤变化范围。对放化疗不敏感的软组织肉瘤,或发现时肿瘤巨大,出现明显神经血管压迫症状可考虑先评估肿瘤边界,确定手术入路,行手术切除。
Kawaguchi边界体系没有考虑肿瘤发生发展过程特点。对于侵袭性不同肿瘤均用5 cm作为治愈边界是否合适,需要进一步大规模多中心临床病理研究来证实。断层解剖资料虽然能完成多维度上肿瘤边界确定,但是对于肿瘤整体边界确定仍显粗糙。如果能将肿瘤及周围正常组织进行三维重建,配合3D打印技术在术前针对每个不同病例建立个体化空间标本,进行完整手术边界设计,肿瘤外科切除手术将迈向新台阶。
本研究随访期间未见肿瘤明显复发,但随访时间较短,继续随访评估每位患者5年生存情况,进一步分析断层解剖学分析指导软组织肉瘤手术切除后的生存曲线。逐层断层解剖分析为软组织肉瘤提供精确数字化外科边界,合理而精确切口设计,减少出血、创伤和肿瘤污染可能性,有利于肿瘤切除实现治愈性切除。规范断层解剖影像学检查和逐层断层解剖分析应该成为恶性软组织肉瘤切除术前设计必要步骤。
[1] Edge SB, Byrd DR, Compton CC, et al. AJCC Can-cer Staging Handbook[M]. 7th ed. New York: Springer, 2010.
[2] Enneking WF, Spanier SS, Goodman MA, et al. A system for the surgical staging of musculoskeletal sarcoma[J]. Clin Orthop Relat Res, 1980,(153):106-120.
[3] Enneking WF. History of orthopedic oncology in the United States: progress from the past, prospects for the future[J]. Cancer Treat Res, 2009,(152):529-571.
[4] Kawaguchi N, Ahmed AR, Matsumoto S, et al. The concept of curative margin in surgery for bone and soft tissue sarcoma[J]. Clin Orthop Relat Res, 2004,(419):165-172.
[5] Kawaguchi N, Amino K, Matsumoto S, et al. [Eva-luation method of surgical margin in musculoskeletal sarcoma][J]. Gan To Kagaku Ryoho, 1989,16(4 Pt 2-3):1802-1810.
[6] Kawaguchi N, Amino K, Matsumoto S, et al. [Procedures and results of limb salvage surgery of musculoskeletal sarcoma][J]. Gan To Kagaku Ryoho, 1988,15(4 Pt 2-2):1154-1163.
[7] Kawaguchi N, Matumoto S, Manabe J. New method of evaluating the surgical margin and safety margin for musculoskeletal sarcoma, analysed on the basis of 457 surgical cases[J]. J Cancer Res Clin Oncol, 1995,121(9-10):555-563.
[8]Akashi-Tanaka S, Sato N, Ohsumi S, et al. Eva-luation of the usefulness of breast CT imaging in delineating tumor extent and guiding surgical management: a prospective multi-institutional study[J]. Ann Surg, 2012,256(1):157-162.
[9] Chou CT, Chen RC, Lee CW, et al. Prediction of microvascular invasion of hepatocellular carcinoma by pre-operative CT imaging[J]. Br J Radiol, 2012,85(1014):778-783.
[10] Low G, Tho LM, Leen E, et al. The role of imaging in the pre-operative staging and post-operative follow-up of rectal cancer[J]. Surgeon, 2008,6(4):222-231.
[11] de Bree R, van der Waal I, de Bree E, et al. Management of adult soft tissue sarcomas of the head and neck[J]. Oral Oncol, 2010,46(11):786-790.
[12] Panicek DM, Gatsonis C, Rosenthal DI, et al. CT and MR imaging in the local staging of primary malignant musculoskeletal neoplasms: Report of the Radio-logy Diagnostic Oncology Group[J]. Radiology, 1997,202(1):237-246.
[13] Steinbach LS. CT and MR imaging in the local staging of primary malignant musculoskeletal neoplasms: report of the radiology diagnostic oncology group. Radiology, 1997,202:237-246[J]. Sarcoma, 1998,2(1):57-58.
[14] Han G, Wang Y, Bi WZ, et al. Magnetic resonance imaging is appropriate for determining the osteotomy plane for appendicular osteosarcoma after neoadjuvant chemotherapy[J]. Med Oncol, 2012,29(2):1347-1353.
[15] Bancroft LW. Postoperative tumor imaging[J]. Semin Musculoskelet Radiol, 2011,15(4):425-438.
[16] Balach T, Stacy GS, Haydon RC. The clinical evaluation of soft tissue tumors[J]. Radiol Clin North Am, 2011,49(6):1185-1196.
[17] Kawaguchi N, Amino K, Matsumoto S, et al. [The value of limb-saving surgery in the treatment of osteosarcoma][J]. Gan To Kagaku Ryoho, 1987,14(5 Pt 2):1412-1422.
[18] Dickinson IC, Whitwell DJ, Battistuta D, et al. Surgical margin and its influence on survival in soft tissue sarcoma[J]. ANZ J Surg, 2006,76(3):104-109.
[19] Wu CC. A novel approach for evaluating acceptable intra-operative correction of lower limb alignment in femoral and tibial malunion using the deviation angle of the normal contralateral knee[J]. Knee, 2014,21(2):573-581.
[20] Wang X, Ma X, Zhang C, et al. Anatomical factors affecting the selection of an operative approach for fibular fractures involving the posterior malleolus[J]. Exp Ther Med, 2013,5(3):757-760.
Role of sectional anatomy analysis in preoperative plan of soft tissue sarcoma of limbs.
LIMi,RENYe,YANGQing,GUOFengjing,YANGCaihong.
DepartmentofOrthopaedics,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology
YANGCaihong,E-mail:yangcaihong@tjh.tjmu.edu.cn
Objective To investigate the role of sectional anatomy analysis in the preoperative plan of soft tissue sarcoma. Methods Retrospective analysis was taken with 10 soft tissue sarcoma patients who were hospitalized in our hospital from Mar. 2012 to Dec. 2014. Thin MRI scans and (or) CTA examinations were taken before the operations. Analyzing each single slice of image determined the anatomical informations such as compartment of tumor involved and reaction zones. According to the wide range and compartment principle, the surgical boundary of the tumors was designed. Measuring length of the reaction zone and minimal thickness of the boundaries in two dimensions on postoperative specimens. Pathological diagnosis was needed to confirm the presence of tumor cells on surgery margins. All the patients were followed up every three months. Results 1. There was no statistical significance between the size of postoperative tumor and preoperative sectional anatomy analysis on image(P>0.05). 2. According to the measurement of the normal tissue thickness in postoperative tumor, the type of surgery reached wide resection or curative resection standards. Pathological examination found no tumor cell infiltration on surgical margin. 3. All the patients had good functional recovery with no tumor recurrence at the last follow-up time.Conclusion Sectional anatomy analysis could provide precise surgical digital boundary and design reasonable incisions of soft tissue sarcoma, which would not only reduce the possibility of bleeding, trauma, tumor contamination but also achieve curative resection of tumor resection. Sectional anatomy analysis should become the necessary step in the preoperative plan of soft tissue sarcoma.
Magnetic resonance imaging; Diagnostic imaging; Soft tissue neoplasms; Forecasting
10.3969/j.issn.1674-8573.2015.06.003
武汉市科技计划基金(2014010202010091)
430030 武汉,华中科技大学同济医学院附属同济医院骨科
杨彩虹,E-mail:yangcaihong@tjh.tjmu.edu.cn
2015-08-19

