B7-H4、IRF-2水平检测对胰腺癌患者预后的评价
杨振华
胰腺癌是一种恶性程度很高的消化道恶性肿瘤,致死率较高,研究显示,早期诊治可显著提升患者预后[1]。但由于胰腺解剖位置深、胰腺癌早期症状隐匿以及胰腺癌生物学特性尚未探明,,早期胰腺癌不易发现。B7-H4是Sica等[2]发现的协同刺激因子,其生成物可抑制T淋巴细胞介导的免疫应答,促进免疫逃逸而致恶性肿瘤发生;IRF-2是主要干扰素调控因子,直接产于免疫反应,并促进细胞增殖[3]。有研究提示,在乳腺癌、卵巢癌及部分其它癌症组织中,上述两因子呈高表达状态,有助于早期诊断[4-5];最新的研究认为,B7-H4参与胰腺癌的发生发展,对胰腺癌的预后预测有一定价值[6];而IRF-2在胰腺癌中高表达,作为癌基因产物参与胰腺癌调控[7]。本研究应用免疫组化检测B7-H4和IRF-2在胰腺癌中的表达,以验证2者在提示胰腺癌预后中的价值,现报告如下。
资料与方法
一、一般资料
自2003年1月至2009年1月入住我院,且术前未经放化疗的胰腺癌手术切除标本共67例,其中男性38例,女性29例;年龄33~82岁,平均(55.2±9.2)岁;腺癌高分化19例、中分化17例、低分化31例;肿瘤直径<2.0 cm 5例、2.0~4.0 cm 39例、>4.0 cm 23例。
二、检测方法
1.仪器及试剂
双目显微镜(日本奥林匹斯,BH-2型);石蜡切片机(德国徕卡);恒温烤箱(黄石医疗机械厂,B3-A型);人乳腺癌、卵巢癌组织芯片(艾莉娜生物科技有限公司);免疫组化系统(日本Dako,Envision system)。
2.检测方法
参考仪器说明书,简述如下:石蜡标本切片,择合适品脱蜡至水,置入以3%双氧水,室温孵育10 min;医用蒸馏水冲洗5 min,连续3次;置入枸缘酸盐缓冲液,高温煮沸10 min;再行医用蒸馏水三次冲洗;以5%BSA封闭,室温孵育,15 min后加入一抗,设定环境温度为4℃,反应过夜;以PBS冲洗5 min,持续3次;加入二抗,设定环境温度为37℃,反应1 h;再行PBS三次冲洗;显色并行自来水冲洗,苏木素染色,封片;镜下观察。上述研究均以染色强阳性的人乳腺癌组织作为阳性对照,以正常羊血清代替一抗,结果为阴性对照,另以PBS代替一抗,结果作为空白对照。阳性细胞标准:细胞浆、细胞膜呈棕黄或褐黄。
3.染色积分评定
阳性细胞评分:<5%为0分;5%~10%为1分;11%~30%为2分;31%~70%为3分;>70%为4分。染色强度评分:无色为0分;淡黄色1分;棕黄色2分;棕褐色3分。以上两项之和为染色积分,并认为评分≥2分为阳性。
三、研究方法
统计B7-H4及IRF-2的表达情况;结合分化程度、淋巴转移、远端转移、TNM分期、KPS评分、肿瘤T分期等信息,分析2者表达与临床常规病理指标间的关系;持续随访并统计患者存活率。
四、统计学方法
结 果
一、胰腺癌组织中B7-H4、IRF-2的表达
67例标本B7-H4平均染色积分 (4.07±1.28)分,IRT-2平均染色积分(3.58±1.07)分。而B7-H4阳性48例,阳性率为71.6%,IRF-2阳性38例,阳性率为56.72%;Spearman等级相关性分析二者显正相关性(r=0.614,P=0.000)。见表 1。

表1 胰腺癌组织中B7-H4、IRF-2的表达及相关性 (n)
二、B7-H4与IRF-2的表达与各临床病理指标间的相关性
按患者临床资料不同分组对比,结果显示,肿瘤分化程度对IRF-2的表达有影响;TNM分期对B7-H4及IRF-2的表达均有影响;肿瘤T分期对IRF-2的表达有影响;KPS评分对B7-H4的表达有影响;淋巴结转移对B7-H4的表达有影响,上述差异均有统计学意义(P<0.05),见表2。
三、B7-H4、IRF-2的表达与预后的关系
67例患者持续随访5年,死亡58例,无失访病例;中位生存时间为267.8 d,1年生存率为36.2%。生存曲线结果显示,B7-H4阴性患者预后明显好于阳性患者;IRF-2阴性患者预后明显好于阳性患者。上述差异均有统计学意义(P<0.05),对COX回归多因素分析B7-H4高表达(P=0.021)、IRF-2高表达(P=0.000)、淋巴结转移(P=0.000)及 TNM 分期(P=0.000)为影响胰腺癌预后的独立因素。见图1、图 2。
讨 论
胰腺癌的发生多伴随癌基因的激活与肿瘤抑制基因的失活,而这正是导致细胞无限增殖,演变为恶性肿瘤的基础;目前,有研究对胰腺癌肿瘤细胞的染色体核型进行分析,发现4号染色体的长臂出现异常,且研究显示该长臂基因可能与胰腺炎的发展有着紧密关系。干扰素调控因子2(IRF-2)属于干扰素调控因子家族(IRF1-9)中的一员,其也是定位于4号染色体的长臂的基因之一,该调控因子在免疫反应及细胞增殖分裂中起着重要的作用;已有多项研究发现,IRF-2与肿瘤发生有着紧密关系,在胰腺癌细胞中,其DNA结合结构域的点的异常突变,会直接导致细胞增殖中断,导致细胞凋亡,而上述研究均说明IRF-2在胰腺癌的发生中参与重要角色,但临床上并无关于IRF-2的相关研究。B7-H4作为共刺激分子家族中的一员,其属于B7分子家族中首个GPI偶联蛋白,该因子mRNA多存在与淋巴及其非淋巴组织中,正常组织中极为少见;有研究发现,人体肿瘤中,如肺癌、食管癌、肾癌、卵巢癌等癌细胞表面均有B7-H4的阳性表达,这说明B7-H4在肿瘤的发展过程中也发挥着一定得作用,如段文元等报道发现B7-H4在胰腺癌细胞中的高表达,能抑制淋巴细胞对肿瘤细胞的杀伤作用,这对于促进肿瘤的形成及肿瘤细胞逃避免疫系统的抑制与杀伤有积极的作用。目前,国内关于B7-H4及其家族B7-H3等因子的研究已有报道,但关于B7-H4与IRF-2之间报道尚属首次。

表2 B7-H4与IRF-2的表达与各临床病理指标间的相关性 [n(%)]
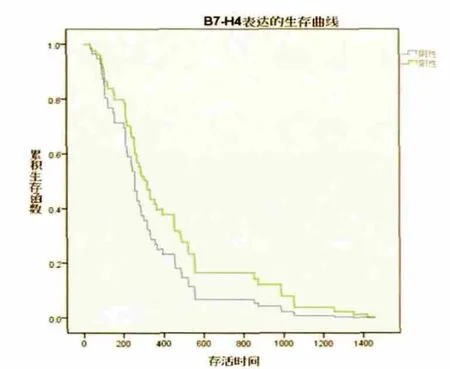
图1 B7-H4表达的生存曲线

图2 IRF-2表达的生存曲线
本研究主要检测了B7-H4和IRF-2在胰腺癌组织中的表达,并分析了其与各临床病理因素间的关系,旨在探索二者之间是否存在一定内在关联。本67例标本中,B7-H4阳性者占48例,且TNM分期越高、KPS评分越低,其阳性表达率越高,淋巴结转移者其阳性率亦越高。这提示B7-H4的表达与胰腺癌的不良预后密切相关。该蛋白的主要生理作用在于抑制T细胞增殖、细胞因子及细胞周期的进程,从而抑制T细胞介导下的免疫应答,从而导致恶性肿瘤发生。研究指出,其在多种人类恶性肿瘤,包括肺癌、卵巢癌、乳腺癌等中均有过表达现象,且阳性表达率与肿瘤细胞的分化层度呈负相关,未发现B7-H4阳性表达的患者,五年生存率显著性高于对照组[8],但关于其在胰腺癌中的表达研究则极为少见。本研究则能够指出,B7-H4可能成为胰腺癌的早期诊断及疗效评价的有力指标。B7-H4在胰腺癌组织中的表达显著性高于正常组织,且其表达水平与肿瘤分级正相关,这可能是因为其抑制了T淋巴免疫,从而导致了肿瘤逃逸、癌症进展。有研究指出,正常细胞中如果出现B7-H4过表达,亦可能于转化前免于死亡,导致转化为恶性细胞,从而促进肿瘤进程[9]。
本研究中,IRF-2阳性者占38例,且IRF-2与TNM分期、肿瘤分化程度、肿瘤T分期有关,亦可提示IRF-2在胰腺癌的发展中起着一定促进作用。早期研究指出,过量表达的IRF-2可能导致NIH3T3转化,且在其它肿瘤或癌症(如乳腺癌)的发生过程中,其表达明显上升[10]。体外实验证明,胰腺癌细胞中IRF-2的DNA定点突变可抑制细胞增殖,促进肿瘤细胞凋亡[11]。本研究同时还就患者预后进行系统性分析,指出B7-H4高表达、IRF-2高表达、淋巴结转移及TNM分期为影响胰腺癌预后的独立因素。后两者的在其它一系列研究中亦可得到验证,这可从侧面证实本文论点的准确性[12]。
总之,本研究提示,B7-H4或IRF-2阳性组的预后要显著性差于对照组,且COX风险回归模型提示两者过表达为影响胰腺癌预后的独立因素,因此在进行胰腺癌的早期诊断、评价胰腺癌的预后中,建议以两者检测结果为评价指标。
1 汪毅,赵平,王成锋,等.综合治疗在预后不良胰腺癌中的价值.中华医学杂志,2009,89(34):2381-2385.
2 Sica GL,Choi IH,Zhu G,et al.B7-H4,a molecule of the B7 family,negativelyregulatesT cellimmunity[J].Immunity,2003,18(6):849-861.
3 Yi Y,Wu H,Gao Q,et al.Interferon regulatory factor(IRF)-1 and IRF-2 are associated with prognosis and tumor invasion in HCC.Ann Surg Oncol,2013,20(1):267-276.
4 蒋敬庭,吴昌平,沈月平,等.共刺激分子B7-H4在胃癌组织中表达及其与预后的关系.中华实验外科杂志,2009,26(9):1155-1158,封3.
5 Pettersson S,Kelleher M,Pion E,et al.Role of Mdm2 acid domain interactions in recognition and ubiquitination of the transcription factor IRF-2.Biochem J.2009,418(3):575-585.
6 SakaiToshitaka,MashimaHirosato,YamadaYumi,et al.The Roles of Interferon Regulatory Factors 1 and 2 in the Progression of Human Pancreatic Cancer.Pancreas,2014 43(6):909-916.
7 Chen Y,Sun J,Zhao H,et al.The coexpression and clinical significance of costimulatory molecules B7-H1,B7-H3,and B7-H4 in human pancreatic cancer.Onco Targets Ther,2014,19(7):1465-1472.
8 蒋敬庭,吴昌平,沈月平,等.协同刺激分子B7-H4影响细胞因子诱导的杀伤细胞治疗胃癌预后的多因素COX模型分析.中华实验外科杂志,2010,27(5):656-660.
9 洪波,钱韵,姚航平,等.B7-H4在胰腺癌中的表达及其临床意义.浙江大学学报(医学版),2013,42(5):511-516.
10 Zeimet AG,Reimer D,Wolf D,et al.Intratumoral interferon regulatory factor(IRF)-1 but not IRF-2 is of relevance in predicting patient outcome in ovarian cancer.Int J Cancer,2009,124(10):2353-2360.
11 Cui L,Deng Y,Rong Y,et al.IRF-2 is over-expressed in pancreatic cancer and promotes the growth of pancreatic cancer cells.Tumour biology,2012,33(1):247-255.
12 李胜棉,吴义娟,王晓辰,等.Smac、Bcl-2和Ki-67在胰腺癌组织中的表达及预后价值.肿瘤,2009,29(11):1076-1081.

