雌激素对人脐静脉血管内皮细胞凋亡的影响
何小静,王彦洁,王 宇,杨 欣,李晓冬
0 引 言
冠心病是全球更年期妇女最主要的死亡原因,绝经前妇女动脉粥样硬化的发生率及冠心病的发病率和病死率要远远低于同龄男性。而这种性别优势随着绝经后年龄增加、雌激素水平的降低而慢慢变小或随之消失[1-2]。雌激素用来防治以动脉粥样硬化病变为基础的心血管疾病已成为近年来的热点。2013 年全球国际绝经协会共识明确指出使用标准剂量的雌激素可降低60 岁以下绝经10 年以内的女性心血管疾病的发病率及病死率[3]。
内质网是细胞内重要的细胞器,参与蛋白质翻译后的修饰、折叠和寡聚化[4]。多种因素导致生理条件改变时错误折叠或未折叠蛋白在内质网腔内大量积聚,损伤内质网的正常生理功能,这种状态称内质网应激(endoplasmic reticulum stress,ERS)。过度或持续时间较长的刺激引起细胞内环境失调,触发凋亡进而导致疾病的发生。近年来多项研究证实内质网及其引起的细胞凋亡参与了心血管疾病的发生、发展,并在动脉粥样硬化及斑块破裂中发挥了重要的作用。雌激素作为一种女性性激素,已被证明可以通过扩张血管、促进血管内皮修复增生、抑制炎症反应、抗氧化、调节脂质代谢等发挥血管保护作用[5-7]。
然而,雌激素是否通过阻止ERS 引起内皮细胞凋亡的分子机制目前还不清楚。衣霉素可抑制内质网内蛋白质N 一端糖基化,干扰蛋白质合成;二硫苏糖醇是一种强还原剂,能够打开蛋白质内二硫键,抑制蛋白的折叠。两者都能引起内质网内未折叠蛋白积聚,诱发细胞ERS,是经典的研究药物。Kim 等[8]采用衣霉素诱导人脐静脉内皮细胞ERS,内质网伴侣蛋白表达上调,ERS 凋亡相关蛋白CHOP 和c-Jun氨基末端激酶(c-Jun NH2"terminal kinase,JNK)活化,成功创建了衣霉素诱导HUVEC ERS 的模型。
1 材料与方法
1.1 材料 人类内皮细胞系EA.hy926 由北京大学人民医院中心实验室提供。17-β 雌二醇,ICI182,780 和hochest 染色33342 购自美国Sigma-Aldrich 公司。衣霉素和G15 购自美国Tocris Bioscience 公司。二硫苏糖醇购自美国Amresco 公司。DMEM 培养基、胎牛血清、青霉素和链霉素和胰蛋白酶均购自美国Gibco 公司。抗CHOP、抗caspase-12 和抗GRP78 抗体购自美国Santa Cruz 公司及Abcam 公司。内参β-actin 抗体和蛋白质marker 购自美国Proteintech 公司。其他提取蛋白试剂购自中国Beyotime,Applygen 和ZSGB-BIO 公司。
1.2 方法
1.2.1 细胞的培养及处理 选用含10% FBS 的DMEM 培养基,常规加入100 μg/mL 青链霉素置于37 ℃、5%CO2条件下培养细胞。内皮细胞接种于6孔板中,每2 天更换培养基,当生长融合至70%~80%时,取生长状态良好的细胞更换为含1%FBS的DMEM,饥饿24 h 使细胞生长同步化。实验前期已确定10 μmol/L 衣霉素处理细胞10 h 或2 mmol/L二硫苏糖醇处理细胞8 h 为诱导细胞ERS 凋亡最佳浓度和时间,而10-8mol/L 的17-β 雌二醇对ERS 的保护作用最明显。根据是否用衣霉素/二硫苏糖醇,雌激素,雌激素拮抗剂(ICI182,780 和G15)处理进行如下分组:①空白对照A、B 组;②衣霉素/二硫苏糖醇组:10 μmol/L 衣霉素诱导HUVECs 10 h或2 mmol/L 二硫苏糖醇诱导8 h;③衣霉素/二硫苏糖醇+17-β 雌二醇组:10-8mmol/L 17-β 雌二醇预处理1 h,后加入衣霉素/二硫苏糖醇处理,浓度和时间同衣霉素/二硫苏糖醇组;④衣霉素/二硫苏糖醇+17-β 雌二醇+ICI 组;⑤衣霉素/二硫苏糖醇+17-β 雌二醇+G15 组;⑥衣霉素/二硫苏糖醇+17-β雌二醇+ICI+G15 组,后3 组均加10-7mmol/L 雌二醇拮抗剂预处理0.5 h,后加含17-β 雌二醇的DMEM培养1 h,最后按衣霉素/二硫苏糖醇组处理相应时间。所有组别细胞最后用胰蛋白酶处理离心后获得。
1.2.2 Western blot 检测 各组细胞处理结束后,加入60 μL 的蛋白裂解液,于4 ℃摇床裂解30 min,4 ℃下以离心半径10 cm,12 000 r/m 离心机离心20 min,提取总蛋白。Bradford 法测定蛋白浓度,根据目的蛋白分子量大小配置10%~15%不连续SDSPAGE 分离胶。每孔依次上样,总蛋白样品50 μg,十二烷基硫酸钠-聚丙稀酰胺凝胶电泳,硝酸纤维素膜转膜,含5%(重量/体积)脱脂奶粉封闭,抗体杂交孵育:将膜与含抗GRP78(1 ∶1000),抗CHOP(1∶500),抗剪切的caspase-12(1 ∶1000)的一抗于4 ℃摇床过夜。洗膜后与含辣根过氧化物酶(HRP)的二抗室温孵育2 h,ECL 超敏发光液化学发光,实验重复3 次以上,所有蛋白的条带强度使用ImageJ软件V1.43 通过与β-action 的密度进行归一化后进行灰度分析。
1.2.3 Hochest 染色 HUVECs 细胞接种于6 孔板中,细胞接种密度为30%~50%融合时改变为含1%FBS 的DMEM 培养基饥饿,余条件同前。饥饿24 h 后用上述浓度及时间的衣霉素、二硫苏糖醇、17-β 雌二醇及ICI1182,780 干预,然后用4%的多聚甲醛固定细胞。根据产品说明书(Sigma-Aldrich公司,美国)进行Hochest 凋亡染色,通过荧光显微镜观察凋亡状态的细胞核。
1.3 统计学分析 用SPSS 13.0 软件进行统计分析,采用GraphPad Prism 5.0 软件进行数据统计图表制作,计量资料以均数±标准差表示,多组间比较采用One-way ANOVA 分析,以P≤0.05 为差异有统计学意义。
2 结 果
2.1 Western blot 蛋白分析结果 与空白对照A组比较,衣霉素组GRP78、caspase-12 和CHOP 的表达升高(P <0.05);与衣霉素组比较,衣霉素+17-β雌二醇组GRP78、caspase-12 和CHOP 的表达均下降(P <0.05);与衣霉素+17-β 雌二醇组比较,衣霉素+17-β 雌二醇+IGI 组CHOP 表达升高(P <0.05),衣霉素+17-β 雌二 醇+G15 组GRP78、caspase-12 表达升高(P <0.05),衣霉素+17-β 雌二醇+ICI+G15 组GRP78、caspase-12 和CHOP 的表达升高(P <0.05)。
与空白对照B 组比较,二硫苏糖醇组GRP78、caspase-12 和CHOP 的表达升高(P <0.05);与二硫苏糖醇组比较,二硫苏糖醇+17-β 雌二醇组GRP78和CHOP 表达均下降(P <0.05);与二硫苏糖醇+17-β 雌二醇组比较,二硫苏糖醇+17-β 雌二醇+ICI组GRP78 和CHOP 的表达升高(P <0.05),二硫苏糖醇+17-β 雌二醇+G15 组GRP78 表达升高(P <0.05),二硫苏糖醇+17-β 雌二醇+ICI+G15 组GRP78、caspase-12 和CHOP 的表达升高(P <0.05)。见图1,表1、表2。
2.2 Hochest 染色 通过Hochest 染色检测细胞形态学变化发现衣霉素/二硫苏糖醇组同一高倍视野凋亡细胞数明显高于空白对照组,衣霉素/二硫苏糖醇+17-β 雌二醇组多个视野仅见少数细胞凋亡,数目显著少于衣霉素/二硫苏糖醇组,衣霉素/二硫苏糖醇+17-β 雌二醇+ICI 组、衣霉素/二硫苏糖醇+17-β 雌二醇+G15 组、衣霉素/二硫苏糖醇+17-β雌二醇+ICI+G15 组凋亡细胞数均不同程度高于衣霉素/二硫苏糖醇+17-β 雌二醇组。见图2。
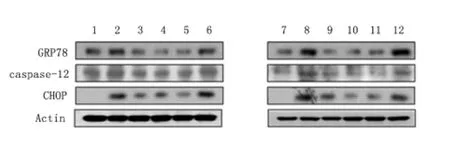
图1 衣霉素/二硫苏糖醇诱导HUVEC ERS 分子的表达Figure 1 Expression of ERS molecules induced by TM/DTT
表1 衣霉素模型组不同药物处理组凋亡分子的灰度值,n=3)Table 1 Gray value of apoptotic molecules in TM model group treated with different drugsn=3)
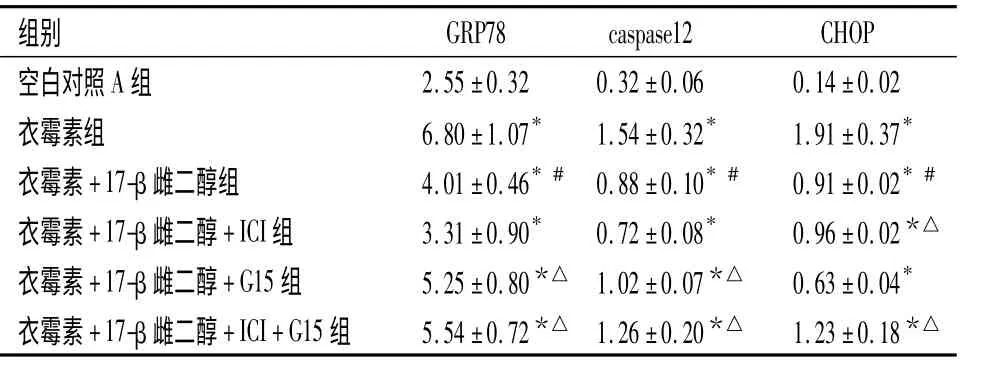
表1 衣霉素模型组不同药物处理组凋亡分子的灰度值,n=3)Table 1 Gray value of apoptotic molecules in TM model group treated with different drugsn=3)
与空白对照A 组比较,*P <0.05;与衣霉素组比较,#P <0.05;与衣霉素+17-β 雌二醇组比较,△P <0.05
组别GRP78 caspase12 CHOP空白对照A 组2.55±0.32 0.32±0.06 0.14±0.02衣霉素组 6.80±1.07* 1.54±0.32* 1.91±0.37*衣霉素+17-β 雌二醇组 4.01±0.46*# 0.88±0.10*# 0.91±0.02*#衣霉素+17-β 雌二醇+ICI 组 3.31±0.90* 0.72±0.08* 0.96±0.02*△衣霉素+17-β 雌二醇+G15 组 5.25±0.80*△ 1.02±0.07*△ 0.63±0.04*衣霉素+17-β 雌二醇+ICI+G15 组 5.54±0.72*△ 1.26±0.20*△ 1.23±0.18*△
表2 二硫苏糖醇模型组不同药物处理组凋亡分子的灰度值,n=3)Table 2 Gray value of apoptotic molecules in DTT model group treated with different drugs,n=3)
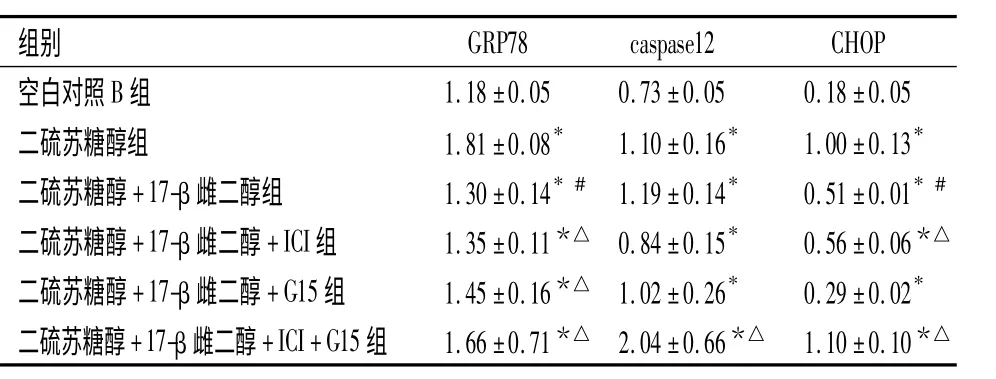
表2 二硫苏糖醇模型组不同药物处理组凋亡分子的灰度值,n=3)Table 2 Gray value of apoptotic molecules in DTT model group treated with different drugs,n=3)
与空白对照B 组比较,*P <0.05,与二硫苏糖醇组比较,#P <0.05;二硫苏糖醇+17-β 雌二醇组比较,△P <0.05
组别GRP78 caspase12 CHOP空白对照B 组1.18±0.05 0.73±0.05 0.18±0.05二硫苏糖醇组 1.81±0.08* 1.10±0.16* 1.00±0.13*二硫苏糖醇+17-β 雌二醇组 1.30±0.14*# 1.19±0.14* 0.51±0.01*#二硫苏糖醇+17-β 雌二醇+ICI 组 1.35±0.11*△ 0.84±0.15* 0.56±0.06*△二硫苏糖醇+17-β 雌二醇+G15 组 1.45±0.16*△ 1.02±0.26* 0.29±0.02*二硫苏糖醇+17-β 雌二醇+ICI+G15 组 1.66±0.71*△ 2.04±0.66*△ 1.10±0.10*△

图2 镜下观察不同方式处理后血管内皮细胞凋亡(Hochest 染色 ×400)Figure 2 Microscopic vascular endothelial cell apoptosis were observed after treatment in different ways(Hochest staining×400)
3 讨 论
流行病学资料显示,绝经前女性冠心病的发病率及病死率仅为同龄男性的1/10 ~3/10,但绝经后发病率快速上升,甚至超过男性,并成为绝经后女性死亡的首要原因,ERS 后血管内皮细胞损伤引起的细胞凋亡可能是血管动脉粥样硬化的一个重要机制[9]。ERS 单独存在也可促进动脉粥样硬化的发展,雌激素作为一种类固醇激素,在体内最具活性的形式是17β-雌二醇,也是女性绝经前体内最主要的雌激素形式,可减轻ERS,阻止内皮细胞和内皮前体细胞的凋亡[10-12]。
在ERS 凋亡信号通路中,GRP-78 被认为是ERS 反应的标志,而caspase-12 是触发ERS 介导细胞凋亡信号通路的特异性基因[13]。当ERS 时间过长或过度,促凋亡转录因子CHOP 被激活。通过激活GADD34,即翻译起始因子eIF2a 的P-Ser51,促进eIF2a 激酶家族激活进而抑制逆转录翻译[14]。因此,CHOP 通过增加ERS 沉默蛋白和氧化应激促进细胞凋亡。caspase-12 定位于内质网的细胞质侧,通过与caspase-7 和GRP-78 形成复合物,但过度的ERS,GRP78 将重新分配到内质网腔,在该特定域caspase-12 被裂解激活,通过细胞色素C 途径导致细胞死亡。
国内外大多研究采用衣霉素或二硫苏糖醇建立ERS 凋亡模型[15],本研究采用双模型对照,结果显示与空白对照A、B 组相比,衣霉素/二硫苏糖醇处理组ERS 凋亡分子表达量明显上调;与衣霉素/二硫苏糖醇组相比,衣霉素/二硫苏糖醇+17-β 雌二醇组凋亡分子表达量降低,而加入雌激素受体拮抗剂后凋亡标记物的表达呈上调趋势,提示衣霉素/二硫苏糖醇成功诱导了ERS 模型。国际上报道雌激素对ERS 有保护作用,雌激素受体拮抗剂ICI182,780(ERα,ERβ 拮抗剂和GPER 激动剂)和G15(GPER 拮抗剂)对凋亡无显著影响[16]。雌激素在体内主要通过雌激素受体发挥作用,目前确定且了解较多的雌激素受体主要有3 种:ERα、ERβ 及GPER。雌激素通过ERα 和ERβ 激活包括PI3K,Akt 信号,和ERK1/2 在内的信号通路快速起效,以上信号转导通路,除JNK 增加凋亡以外,均保护细胞免受损伤。同时雌激素及其受体复合物也可通过转移至细胞核内作为转录因子,调控基因的表达,起效较为缓慢[17]。衣霉素/二硫苏糖醇+17-β 雌二醇+ICI+G15 组凋亡蛋白明显高于衣霉素/二硫苏糖醇+17-β 雌二醇组,而衣霉素/二硫苏糖醇+17-β 雌二醇+ICI 组、衣霉素/二硫苏糖醇+17-β 雌二醇+G15 组凋亡蛋白表达改变呈上升趋势,说明雌二醇通过调节其受体起到了抑制HUVEC ERS 引起的凋亡的作用,而雌激素的保护作用可能是通过ERα,ERβ和GPER 共同起调节作用,而雌激素受体后信号通路有待于进一步研究。
Losordo 等[18]研究显示绝经前及绝经后女性患者中ER 表达越丰富的冠状动脉,发生AS 的机会越小。也有报道在女性AS 患者血管上的ER 表达明显减少[19],动脉粥样硬化较为严重的血管对激素治疗的反应性下降。这些均提示雌激素的冠脉保护作用可能是由于PI3K/Akt 通路的激活增加和降低炎症和细胞因子的产生有关,一定程度上依赖于动脉粥样硬化的发生和发展[20]。而雌激素通过1 个还是多个受体发挥作用,是基因型还是非基因型以及雌激素受体后信号通路目前在继续研究中。
我们的研究结果提示雌激素能通过调节雌激素受体抑制ERS 诱导的人脐静脉内皮细胞的凋亡。为雌激素通过调节雌激素受体保持ERS 的稳态,进而保护心血管的作用提供了新的见解。雌激素的保护作用可能是通过雌激素受体后信号通路起效的。本研究的局限性是脐静脉血管内皮细胞反应性在某些方面可能不同于成人动脉内皮细胞。
[1] Kim ES,Menon V.Status of women in cardiovascular clinical trials[J].Arterioscler Thromb Vasc Biol,2009,29(3):279-283.
[2] Body mass index and cardiovascular disease risk factors in seven Asian and five Latin American centers:data from the International Clinical Epidemiology Network(INCLEN)[J].Obes Res,1996,4(3):221-228.
[3] Wunder D,Pache TD.The global consensus statement 2013 on menopausal hormone therapy[J].Rev Med Suisse,2013,9(403):1950-1953.
[4] 陈 瑜,刘翠萍,茅晓东,等.糖基化终产物诱导小鼠足细胞内质网应激和细胞凋亡的研究[J].医学研究生学报,2013,26(11):1129-1133.
[5] Lagranha CJ,Deschamps A,Aponte A,et al.Sex differences in the phosphorylation of mitochondrial proteins result in reduced production of reactive oxygen species and cardioprotection in females[J].Circ Res,2010,106(11):1681-1691.
[6] Xing D,Nozell S,Chen YF,et al.Estrogen and mechanisms of vascular protection[J].Arterioscler Thromb Vasc Biol,2009,29(3):289-295.
[7] Baruscotti I,Barchiesi F,Jackson EK,et al.Estradiol stimulates capillary formation by human endothelial progenitor cells:role of estrogen receptor-α/β,heme oxygenase 1,and tyrosine kinase[J].Hypertension,2010,56(3):397-404.
[8] Kim KM,Pae HO,Zheng M,et al.Carbon monoxide induces heme oxygenase-1 via activation of protein kinase R-like endoplasmic reticulum kinase and inhibits endothelial cell apoptosis triggered by endoplasmic reticulum stress[J].Circ Res,2007,101(9):919-927.
[9] Csiszar A,Ungvari Z,Koller A,et al.Proinflammatory phenotype of coronary arteries promotes endothelial apoptosis in aging[J].Physiol Genomics,2004,17(1):21-30.
[10] Haas MJ,Raheja P,Jaimungal S,et al.Estrogen-dependent inhibition of dextrose-induced endoplasmic reticulum stress and superoxide generation in endothelial cells[J].Free Radic Biol Med,2012,52(11-12):2161-2167.
[11] Kooptiwut S,Mahawong P,Hanchang W,et al.Estrogen reduces endoplasmic reticulum stress to protect against glucotoxicity induced-pancreatic beta-cell death[J].J Steroid Biochem Mol Biol,2014,139:25-32.
[12] Fu Z,Zou F,Deng H,et al.Estrogen protects SGC7901 cells from endoplasmic reticulum stress-induced apoptosis by the Akt pathway[J].Oncol Lett,2014,7(2):560-564.
[13] 王 帅,伊 雪,邬鹏宇,等.莱菔硫烷抗凋亡对移植大鼠心脏的保护作用[J].医学研究生学报,2014,27(2):157-159.
[14] Marciniak SJ,Yun CY,Oyadomari S,et al.CHOP induces death by promoting protein synthesis and oxidation in the stressed endoplasmic reticulum[J].Genes Dev,2004,18(24):3066-3077.
[15] Kyriakakis E,Philippova M,Joshi MB,et al.T-cadherin attenuates the PERK branch of the unfolded protein response and protects vascular endothelial cells from endoplasmic reticulum stressinduced apoptosis[J].Cell Signal,2010,22(9):1308-1316.
[16] Razandi M,Pedram A,Levin ER.Estrogen Singnals to the Preservation of Endothelial Cell From and Function[J].J Biol Chem,2000,275(49):38540-38546.
[17] Knowlton AA,Lee AR.Estrogen and the cardiovascular system[J].Pharmacol Ther,2012,135(1):54-70.
[18] Losordo DW,Kearney M,Kim EA,et al.Variable expression of the estrogen receptor in normal and atherosclerotic coronary arteries of premenopausal women[J].Circulation,1994,89(4):1501-1510.
[19] Nakamura Y,Suzuki T,Miki Y,et al.Estrogen receptors in atherosclerotic human aorta:inhibition of human vascular smooth muscle cell proliferation by estrogens[J].Mol Cell Endocrinol,2004,219(1-2):17-26.
[20] Yu HP,Hsieh YC,Suzuki T,et al.The PI3K/Akt pathway mediates the nongenomic cardioprotective effects of estrogen following trauma-hemorrhage[J].Ann Surg,2007,245(6):971-977.

