蒙古黄芪不同药用部位中黄芪甲苷的含量测定
杨庆珍,刘德旺,黄林芳Δ,蔡敏Δ
(1.中国医学科学院 北京协和医学院药用植物研究所,北京 100193;2.内蒙古医科大学,内蒙古 呼和浩特 010080)
蒙古黄芪 Astragalus membranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao为多年生草本植物,是2010年版《中国药典》规定黄芪正品之一,根入药,春、秋二季采挖,除去须根和根头,晒干[1]。黄芪具有补气固表、利尿托毒、敛疮生肌之功效,属于传统大宗中药材商品,民间有用黄芪配成滋补强身之食品的习惯,药性温和,有“补气固表之圣药”的美誉,已有2000多年的应用历史[2]。蒙古黄芪主产于内蒙古、山西、河北等地,是黄芪栽培和商品流通中的主流品种[3-5]。黄芪年消耗量十分庞大,野生资源在大量采挖的情况下日渐稀少,已被确立为国家三级保护植物。
黄芪主要活性成分为黄芪皂苷、黄酮和黄芪多糖[6-7],黄芪甲苷具有抗肿瘤、抗炎、抗氧化、降糖和改善心血管疾病等广泛的生物活性,常被作为评价黄芪药材质量优劣的标准[8-9]。课题组前期对黄芪中有效成分与质量的相关性研究较多,并未对其不同药用部位有效成分含量进行研究[10-12]。为便于加工、储存和运输,黄芪的传统加工方法多将须根和根头去掉丢弃,但废弃的蒙古黄芪须根和根头是否含有黄芪药效成分目前尚未见研究报道。故本文采用HPLC-ELSD法测定了蒙古中西部地区两年生蒙古黄芪药材主根、须根、根头和全根中黄芪甲苷含量。比较不同加工方法蒙古黄芪不同药用部位中黄芪甲苷含量的差异,以期为蒙古黄芪的采收加工提供参考。
1 材料与方法
1.1 仪器与试剂 HPLC-ELSD[安捷伦 (Agilent)公司,包括1100高效液相色谱仪、Agilent 1100自动进样器、Alltech Elsd 2000ES蒸发光检测器];KQ—400KDE超声波清洗器(昆山超声仪器有限公司);AB135—S电子分析天平(Mettler);ELGA PURELAB Classic-UVF纯水仪(英国);FZ102型微型植物试样粉碎机(北京中兴伟业仪器有限公司)。
甲醇(天津市北联精细化学品开发有限公司)、乙腈(天津市光复精细化工研究所)为色谱纯,正丁醇、氨水为分析纯。对照品蒙古黄芪甲苷(批号:110781-200613)购自中国生物药品检定所。
1.2 材料 本研究所用材料采自内蒙古中西部呼和浩特市、包头市、巴彦淖尔市共8份样品,均为人工育苗移栽,秋季采收,经内蒙古医科大学刘德旺副教授鉴定为蒙古黄芪[Astragalus membranaceus(Fisch.)Bge.Var.mongholicus(Bag.)Hsiao]的干燥根,产地采收后,分烘干与自然干燥方式干燥,每组样品分别取主根、须根、根头、全根,见表1。
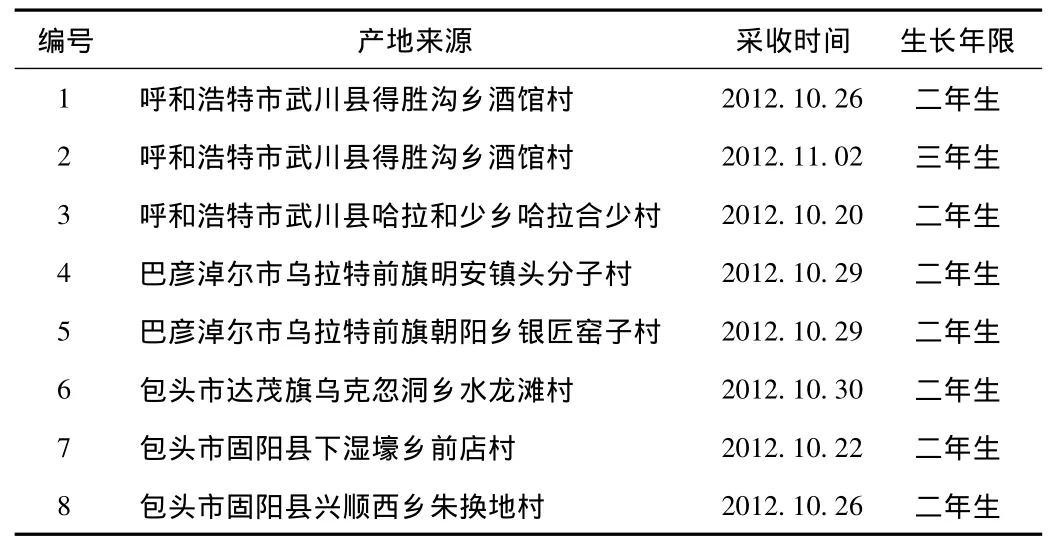
表1 内蒙古地区蒙古黄芪样品信息Tab.1 Information of A.membranaceus and A.mongholicus samples in Inner Mongolia
1.3 方法 黄芪甲苷的测定方法参照2010年版《中国药典》[1]。
1.3.1 色谱条件:色谱柱为BEH C18(100 mm×2.1 mm,1.7 μm),流动相为乙腈-水(32∶68),进样量为2 μL,体积流量为1.0 mL/min,柱温为30℃。ELSD参数:温度为45 ℃,氮气体积流量为2.74 mL/min。
1.3.2 对照品溶液的制备:取黄芪甲苷对照品适量,精密称定,加甲醇制成每1 mL含0.5 mg的溶液,即得。
1.3.3 供试品溶液的制备:取本品中粉约4 g,精密称定,置索氏提取器中,加甲醇40 mL,冷浸过夜,再加甲醇适量,加热回流4 h,提取液回收溶剂并浓缩至干,残渣加水10 mL,微热使溶解,用水饱和的正丁醇振摇提取4次,每次40 mL,合并正丁醇液,用氨试液充分洗涤2次,每次40 mL,弃去氨液,正丁醇液蒸干,残渣加水5 mL使溶解,放冷,通过D101型大孔吸附树脂柱(内径为1.5 cm,柱高为12 cm),以水50 mL洗脱,弃去水液,再用40%乙醇30 mL洗脱,弃去洗脱液,继用70%乙醇80 mL洗脱,收集洗脱液,蒸干,残渣加甲醇溶解,转移至5 mL量瓶中,加甲醇至刻度,摇匀,即得。
1.3.4 供试样品含量测定:分别精密吸取对照品溶液10 μL、20 μL,供试品溶液 20 μL,注入液相色谱仪,测定,用外标两点法对数方程计算,即得。
2 结果
按照干燥品计算,不同药用部位及干燥方式蒙古黄芪中黄芪甲苷含量测定结果见表2,对比结果折线图见图1。由表2和图1可见,黄芪药材各药用部位黄芪甲苷含量差异显著,须根中含量最高(0.102% ~0.164%,平均0.129%);全根次之(0.069% ~0.108%,平均0.086%);再次是主根(0.04% ~0.089%,平均0.061%);根头中最低(0.008% ~0.040%,平均0.024%)。其中须根、主根和全根中黄芪甲苷的含量均大于2010年版《中国药典》规定的0.04%,而根头中仅一批样品黄芪甲苷含量(0.04%)符合规定,其余均低规定含量,说明根头不适合作为以黄芪甲苷为有效成分的药用部位。

表2 不同药用部位及干燥方式黄芪甲苷含量(%,n=3)Tab.2 Contents of AstragalosideⅣin A.membranaceus and A.mongholicus different medicinal parts by different drying methods(%,n=3)

图1 不同药用部位及干燥方式黄芪甲苷含量Fig.1 Contents of AstragalosideⅣin A.membranaceus and A.mongholicus different medicinal parts with different drying methods
基于黄芪甲苷含量,应用SPSS软件对蒙古黄芪样品不同干燥方式的药用部位做主成分分析(PCA)。由分析结果的散点图(图2)可见,相同药用部位黄芪甲苷含量相近,结合黄芪甲苷分析结果(表2,图1)推测,分布于散点图第一象限的蒙古黄芪药用部位黄芪甲苷的含量最高,其次是第二象限。分布于成分2正值部分蒙古黄芪药用部位黄芪甲苷的含量高,分布于成分2负值部分蒙古黄芪药用部位黄芪甲苷的含量低。

图2 不同药用部位及干燥方式黄芪甲苷含量的PCA分析Fig.2 Principal component analysis for the contents of AstragalosideⅣin
3 讨论
3.1 蒙古黄芪不同药用部位黄芪甲苷含量 本研究通过对蒙古黄芪不同药用部位黄芪甲苷含量的测定,发现黄芪药材各药用部位含量差异显著,具体表现为:须根>全根>主根>根头。须根中黄芪甲苷含量最高,在传统的加工方式中,在产地直接将须根和根头除去,如果只以黄芪甲苷为考核指标,则应保留须根部分。以增加黄芪的供应量,降低药材提取企业的原料成本。
3.2 采收时期对黄芪甲苷含量的影响 来自呼和浩特市武川县得胜沟乡酒馆村的2号样品,是唯一一批三年生样品,从图1可见,2号样品须根、全根、主根中黄芪甲苷含量均高于其它批次,但根头中黄芪甲苷含量均低于其它批次,可以推断,三年生样品中黄芪甲苷地上部分向地下部分的转移率更高。课题组结合哈拉和少、得胜沟二年生蒙古黄芪根头及茎叶地上部分采集收情况发现,地上部分未枯萎时采收,其根头及茎叶地上部分中黄芪甲苷含量可达0.033%,而此时地下部分主根及须根中黄芪甲苷含量则相对较低。说明蒙古黄芪采收时间以地上低分全部枯萎后进行采收为宜。
3.3 加工方式对黄芪甲苷含量的影响 课题组考察了药材采收后直接清洗与不清洗2种方式,发现是否直接清洗对产品含量影响不大。对比自然干燥及烘箱70℃干燥2种方式,以干燥后干品中黄芪甲苷含量进行比较,发现自然晾晒干燥的方式所含黄芪甲苷含量均高于70℃烘干方式,高约9.9%。黄芪甲苷(黄芪皂苷Ⅳ)为多种黄芪皂苷(黄芪皂苷Ⅰ、黄芪皂苷Ⅱ等)的基本母核[13-15],自然干燥蒙古黄芪中黄芪甲苷含量高于烘箱70℃干燥方式,原因可能是在自然晾干过程中某些尚未失活的生物酶把其它黄芪皂苷降解为黄芪甲苷。说明用烘箱高温烘干的方式对蒙古黄芪中黄芪甲苷含量具有一定的影响,初步推断黄芪加工应采取自然干燥或者低温干燥。在后续实验中,课题组将对一系列烘干温度梯度对烘干对药材中黄芪甲苷的影响做进一步研究。
3.4 药材品质的优良性 本次所收集的蒙古黄芪样本来源于内蒙古呼和浩特至巴彦淖尔市阴山山脉北侧地区,为蒙古黄芪道地产区之一,按干燥品计算,全根黄芪甲苷含量在0.077% ~0.108%之间,是《中国药典》2010年版黄芪药材黄芪甲苷含量0.040%标准规定的1.85~2.7倍,验证了内蒙古所产道地蒙古黄芪药材的高品质。
[1]中国药典[S].一部.2010.
[2]苏彦雷.黄芪的研究进展[J].海峡药学,2009,11:1-4.
[3]中国药材公司.中国常用中药材[M].北京:科学出版社,1995.
[4]赵一之.黄芪植物来源及其产地分布研究[J].中草药,2004,35(10):1189-1190.
[5]赵明,段金廒,黄文哲,等.中国黄芪属(Astragalus Linn.)药用植物资源现状及分析[J].中国野生植物资源,2000,19(6):5-9.
[6]黄小平,王蓓,邱咏园,等.黄芪甲苷和三七的主要有效成分配伍对小鼠脑缺血再灌注后脑组织能量代谢的影响[J].中草药,2014,45(2):220-226.
[7]杨娟,王洪新,张英杰,张静,等.黄芪甲苷对异丙肾上腺素致乳鼠心肌细胞肥大的影响及其机制[J].中草药,2013,21:3018-3023.
[8]Wang B,Chen MZ.Astragaloside Ⅳ possesses antiarthritic effect by preventing interleukin 1β-induced joint inflammation and cartilage damage[J].Archives of Pharmacal Research,2014,37(6):793-802.
[9]Qi WW,Niu JY,Qin QJ,et al.Astragaloside Ⅳ attenuates glycated albumin-induced epithelial-to-mesenchymaltransition by inhibiting oxidative stress in renal proximal tubular cells[J].Cell Stress and Chaperones,2014,19(1):105-114.
[10]Fu J,Wang JH, Huang LF,etal.Review ofthe Botanical Characteristics, Phytochemistry, and Pharmacology ofAstragalus membranaceus(Huangqi)[J].Phytother Res,2014,28(9):1275-1283.
[11]杨庆珍,刘德旺,王冬梅,等.黄芪生态型与品质的相关性研究[J].中草药,2014,16:2395-2399.
[12]付娟,杨世海,黄林芳.超高效液相色谱法同时测定黄芪中6种黄酮类成分的含量[J].中国药学杂志,2013,48(11):916-919.
[13]刘丽华,李加林.黄芪与红芪的高效液相色谱鉴定[J].时珍国医国药,2010,5:1277-1278.
[14]何盼,李震宇,范圣此,等.基于代谢组学技术和ITS2序列的恒山黄芪与川黄芪差异性研究[J].药学学报,2013,10:1595-1601.
[15]原田正敏,姜顺善.日本常用生药的定量方法——黄芪[J].国外医药(植物药分册),1990,5:201-202.
- 中国生化药物杂志的其它文章
- 硫酸软骨素蛋白多糖对神经系统损伤修复的影响
- 骨碎补化学成分和药理作用研究进展

