肉牛CAST基因5′UTR和3′UTR多态性分析
刘振山等


摘要:
钙蛋白酶抑制蛋白(Calpastatin,CAST)专一抑制钙蛋白酶(Calpain,CAPN)活性,参与调节牛肉的嫩化及肌内蛋白的水解,其编码基因是肉质性状的主要候选基因。本研究根据牛CAST基因5′UTR区(GenBank No. AY834771)和3′UTR区(GenBank No. DQ991097)序列设计两对引物,用PCR-SSCP方法对鲁西黄牛和渤海黑牛共305个样本进行了单核苷酸多态性分析。结果显示,CAST基因5′UTR和3′UTR区存在PCR-SSCP多态,在5′UTR区存在6437(C/T)、6477(G/A)和6614(G/T)3个SNP位点,表现为AA、AB、BB、BC和AD 5种基因型;在3′UTR区存在359(T/C)和366(A/G)2个SNP位点,表现为EE、EF、FF和EG 4种基因型。经检验表明,鲁西黄牛和渤海黑牛均处于非Hardy-Weinberg平衡状态;群体遗传多态性分析表明这两种牛的多态信息含量均为中度多态。
关键词:鲁西黄牛;渤海黑牛;CAST基因;5′UTR;3′UTR;单核苷酸多态性
中图分类号:S823.2文献标识号:A文章编号:1001-4942(2015)03-0108-05
Polymorphism Analysis on 5′UTR and 3′UTR
of CAST Gene from Beef Cattle
Liu Zhenshan,Liu Guifen,Song Enliang,Liu Xiaomu,Tan Xiuwen,Wan Fachun*
(Institute of Animal Science and Veterinary Medicine,Shandong Academy of Agricultural Sciences/Shandong Provincial
Key Laboratory of Animal Disease Control and Animal Breeding,Jinan 250100,China)
AbstractCalpastatin (CAST) is a protein inhibitor that acts specifically on calpains (CAPN) and plays a regulatory role in postmortem beef tenderization and muscle proteolysis,and its encoding gene was considered to be a main candidate gene for meat quality traits. Based on the published bovine CAST 5′UTR(GenBank No. AY834771)and 3′UTR(GenBank No. DQ991097) sequence, two pairs of primers were designed,and the single nucleotide polymorphisms of the two regions of CAST gene in Luxi(n=160)and Bohai black cattle(n=145)were analyzed by PCR-SSCP technique. The results showed that 3 SNPs at 6437(C/T)、6477(G/A)and 6614(G/T)and 5 genotypes(AA,AB,BB,BC and AD)were detected in CAST 5′UTR, and 2 SNPs at 359(T/C) and 366(A/G) and 4 genotypes(EE,EF,FF and EG)were detected in CAST 3′UTR. A chi-square analysis suggested that the allele frequencies and genotype frequencies of CAST gene were not in Hardy-Weinberg equilibrium, and statistical analysis revealed an intermediate PIC in Luxi and Bohai black cattle.
Key wordsLuxi cattle;Bohai black cattle;CAST gene;5′UTR;3′UTR;SNPs
牛肉嫩度是牛肉食用品质的一个重要感官特征,也是决定肉品质量的主要因素,多年来一直是国内外肉品科学研究的热点之一。影响肉嫩度的因素很多,包括肌节的长度、结缔组织的含量、肌原纤维蛋白的降解程度、畜体的年龄、糖酵解的速度、pH值、可溶性胶原蛋白等。国内外学者对肌原纤维蛋白的降解做了大量研究,发现肉中存在的钙蛋白酶系统对肌肉在成熟过程中的嫩化起一定的调控作用,是肌原纤维蛋白降解的限速步骤,这引起了科研人员的广泛关注。
钙蛋白酶系统在细胞内普遍存在,参与细胞的一系列进程,包括生长、凋亡、迁移和细胞周期等[1],该系统包括钙蛋白酶(Calpain,CAPN)、钙蛋白酶抑制蛋白(CAST)和钙蛋白酶激活蛋白(Calpain Activator),三者相互作用,通过参与肌原纤维蛋白的降解过程影响肌肉生长及嫩化[2]。
钙蛋白酶抑制蛋白(CAST)是钙蛋白酶系统的一个重要成员,是细胞内高效、需Ca2+的内源性专一抑制CAPN活性的蛋白质,它可以识别CAPN与钙结合引起的构象变化并与之特异性结合,通过抑制CAPN的自溶对其进行抑制调节,从而调节肌肉内蛋白的水解速率[3]。endprint
研究证实,CAST基因是家畜肉质尤其是嫩度性状的候选基因。对猪CAST基因的研究发现,不同基因型的肌肉除肌内脂肪和背膘厚差异显著外[4],其嫩度、屠宰45 min后pH值和滴水损失也存在显著差异[5,6];CAST基因对鸡肌纤维密度和直径有着显著的影响[7];对牛的研究也发现,CAST不同基因型与该酶的活性、胴体性状及牛肉剪切值相关[8,9]
鲁西黄牛和渤海黑牛是山东省主要的地方黄牛品种,它们具有耐粗饲、抗逆性强、肉质细嫩且蛋白质丰富、遗传性稳定等优良的生物学特性。本试验以鲁西黄牛和渤海黑牛为研究对象,利用PCR-SSCP方法分析CAST基因单核苷酸多态性(SNP),旨在加快我国地方肉牛肉质改良并为育种工作提供可靠的标记辅助选择手段。
1材料与方法
1.1试验材料
以山东地方品种鲁西黄牛和渤海黑牛为研究对象,数量分别为160头和145头。静脉采血,血样EDTA抗凝,置于冰盒,带回实验室。
1.2基因组DNA的制备
牛血样基因组DNA的提取采用常规酚氯仿抽提法[10],提取后的DNA用TE缓冲液溶解后,经0.5%琼脂糖凝胶电泳检测和紫外分光光度计测定浓度后,-20℃保存备用。
1.3引物合成
试验所用CAST-5′UTR和CAST-3′UTR引物分别根据CAST基因5′UTR序列(GenBank No. AY834771)和3′UTR序列(GenBank No. DQ991097),应用Primer 5.0和Oligo 6.0软件设计,由上海博尚生物技术有限公司合成。引物序列、PCR产物大小及退火温度详见表1。
1.4PCR扩增反应
PCR扩增体系由7.5 μL 2×Easy Taq PCR SuperMix (TransGen Biotech Co., Ltd, Beijing, China)、6.4 μL ddH2O、上下游引物(10 μmol/L)各0.5 μL、0.1 μL模板DNA(50 ng/μL)组成,共15 μL。PCR反应条件为:94℃预变性5 min;然后94℃变性30 s、退火30 s、72℃延伸30 s,共35个循环;72℃再延伸10 min,最后4℃保存。PCR产物用1%琼脂糖凝胶电泳检测。
1.5PCR-SSCP法检测单核苷酸多态性
取4 μL PCR产物和8 μL loading buffer [95%去离子甲酰胺、1 mmol EDTA (pH 8.0)、0.025%二甲苯菁、0.025%溴酚蓝、10%甘油],98℃变性10 min,迅速放入碎冰中,冰浴15 min,使之保持单链状态。然后将冰浴的变性混合样在12%非变性聚丙烯酰胺凝胶(Acr∶Bis=29∶1)中电泳。先进行200 V、10 min的高压电泳,后120 V电泳15 h,银染显色。
1.6测序
经SSCP分析后,挑选特异性较好的呈现多态的PCR产物送至北京六合华大基因科技股份有限公司进行纯化后测序。
1.7数据统计分析
计算多态位点的等位基因频率(Allele frequency)、基因型频率(Genotype frequency)、遗传纯合度(Homozygosity)、遗传杂合度(Heterozygosity, He)、有效等位基因数(Effective number of alleles, Ne)和多态信息含量(Polymorphism information content, PIC),对位点基因型的分布进行Hardy-Weinberg平衡的卡方适合性检验。
2结果与分析
2.1PCR扩增结果
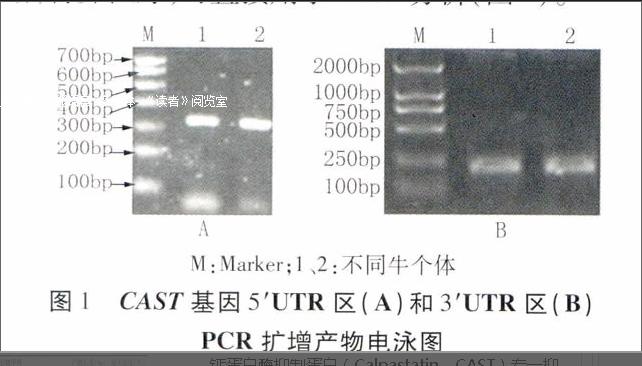
对不同品种的基因组DNA进行PCR扩增,所得产物用1%琼脂糖凝胶电泳检测。结果发现,每对引物的扩增片段与目的片段大小一致,且条带清晰,特异性好,可直接用于SSCP分析(图1)。
M:Marker;1、2:不同牛个体
因此,该位点的突变是同义突变。
2.4不同肉牛品种CAST基因型频率和基因频率分析
从遗传学角度统计了CAST基因5′UTR和3′UTR区PCR-SSCP位点的基因型频率和等位基因频率(见表2、表3),可以看出,在鲁西黄牛和渤海黑牛群体中,CAST-5′UTR以等位基因A、B为主,基因频率在0.4281~0.5438,CAST-3′UTR以等位基因E、F为主,基因频率在0.4594~0.5250。适合性χ2检验结果表明,鲁西黄牛和渤海黑牛均处于非Hardy-Weinberg平衡状态。
多态信息含量(PIC)和杂合度(He)都是评价群体内遗传多态性的一个指标,不同品种牛各位点纯合度、杂合度、有效等位基因数及多态信息含量分析结果见表4。可以看出,CAST基因在鲁西黄牛和渤海黑牛两个群体中的多态信息含量都处于中度多态,可以作为有效的遗传标记用于山东地方黄牛遗传多样性分析。
3讨论
肉品质改良成为当今畜禽遗传育种界的研究热点之一。在保持肉牛生长速度的基础上不断改善牛肉质量一直是肉牛育种的主要目标,但牛肉性状的形成是诸多因素参与的复杂过程,并与生长速度存在负相关,目前尚没有一种切实可行的解决方案。随着分子生物学技术的发展,利用候选基因策略寻找影响牛肉肉质性状的主效基因或与其紧密连锁的分子标记,并将MAS和MAI策略应用于肉质改良,从遗传基础上讲是可行的,也因此成为研究热点之一。
钙蛋白酶蛋白系统是一个高度可调的依赖于钙离子的蛋白水解酶系统,在细胞内普遍存在,在肌肉组织中,它位于肌纤维Z盘附近和肌质网膜上,控制着肌纤维蛋白的降解,是肌肉蛋白质降解的限速步骤[11]。钙蛋白酶抑制蛋白在钙蛋白酶系统中扮演着重要的作用,Pringle等试验证实,嫩度与钙蛋白酶抑制蛋白/μ-calpain的活性比值关系显著,活性比值越大,钙蛋白酶抑制蛋白的量相对越大,对蛋白酶的抑制作用越强,则肉的嫩度越好[12]。Melody等研究表明,钙蛋白酶及其抑制蛋白与肌肉发育之间存在着密切关系,钙蛋白酶抑制蛋白能提高肌肉的嫩度,而肌原纤维又占成熟骨骼肌蛋白重量的50%~60%,所以通过调节钙蛋白酶和钙蛋白酶抑制蛋白的活性可调节肌肉的发育,从而提高家畜的瘦肉率和产出率,提高肌肉的质量[13]。Geesink等研究认为,高水平的钙蛋白酶抑制蛋白能够抑制宰后肌肉蛋白的水解和嫩化,而且这种抑制作用是间接性的[14]。endprint
研究发现,CAST基因是影响牛肉嫩度的主要候选基因,定位于7号染色体上[15],相对位置为117.8 cM[16],基因全长约为130 kb,包含35个外显子,其中外显子2的上游有5个外显子[17]。CAST基因有4个启动子,编码为4个不同的转录本,分别命名为Ⅰ、Ⅱ、Ⅲ和Ⅳ型,它们主要是在5′端不同。Schenkel等研究发现CAST基因内含子5的一个SNP位点与胴体品质及肉质相关[18]。邓桂馨等研究也发现CAST基因内含子6的SNP位点与牛肉嫩度显著相关[19]。
真核生物mRNA的5′UTR和3′UTR区的功能复杂多样,5′UTR保护mRNA免遭5′端外切酶降解,为mRNA的核输出提供转运信号,提高翻译模板的稳定性和翻译效率;3′UTR不仅能调控其mRNA的稳定性、控制mRNA的亚细胞定位,而且还在特定氨基酸的编码过程中起指导作用[20]。研究发现,CAST 5′UTR区的DdeI多态位点和瘤牛及其与黄牛杂交后代的牛肉剪切值(SF)及肌原纤维断裂指数(MFI)相关[21];Casas等研究发现CAST 3′UTR区的G/A多态位点与牛肉的嫩度显著相关[22,23],可见牛CAST基因5′UTR和3′UTR区对其基因功能起重要的作用。本研究克隆了鲁西黄牛和渤海黑牛CAST基因5′UTR及3′UTR序列,并分析了这两段的多态性,得到5个单核苷酸多态性位点,这些多态位点是否调节CAST基因的表达还需要进一步的研究。
本试验仅对两个地方品种牛CAST基因多态性作了初步的探索,需要通过扩大样本量进一步研究CAST基因的多态性。同时,记录不同品种、不同个体的肉质性状,进一步分析基因多态性与生产性能的关系,寻找与肉质性状QTL相连锁的标记,通过MAS检测与标记连锁的目标基因,进行目的基因型选择。本研究得到的单核苷酸多态性位点为今后肉牛肉质性状的研究提供一定的分子基础。同时,不同肉牛品种中CAST基因多态性位点的分布也为我们进一步揭示遗传多样性提供了新的遗传标记。
参考文献:
[1]
Carragher N O, Westhoff M A, Riley D, et al. v-Src-induced modulation of the calpain-calpastatin proteolytic system regulates transformation[J]. Mol. Cell Biol., 2002, 22(1): 257-269.
[2]Goll D E, Thompson V F, Taylor R G, et al. Role of the calpain system in muscle growth[J]. Biochimie, 1992, 74(3): 225-237.
[3]Hood J L, Brooks W H, Roszman T L. Differential compartmentalization of the calpain/calpastatin network with the endoplasmic reticulum and Golgi apparatus [J]. Biol. Chem., 2004, 279(41): 43126-43135.
[4]孙立彬, 孟和, 李婧, 等. 猪钙蛋白酶抑制蛋白基因PCR-RFLP多态性与肉质性状及背膘厚间的关系分析[J]. 上海交通大学学报:农业科学版, 2005, 23(1): 57-62.
[5]薛慧良, 徐来祥. 猪CAST基因的单核苷酸多态性及其对肉质性状的效应[J].生态学报, 2008, 28(6): 2937-2944.
[6]Lindholm-Perry A K, Rohrer G A, Holl J W, et al. Relationships among calpastatin single nucleotide polymorphisms, calpastatin expression and tenderness in pork longissimus[J]. Animal Genetics, 2009, 40(5): 713-721.
[7]刘安芳, 刘益平, 蒋小松, 等. 鸡CAST基因编码区的单核苷酸多态与肌纤维性状的相关研究[J]. 畜牧兽医学报, 2008, 39(4): 437-442.
[8]Smith T, Thomas M G, Bidner T D, et al. Single nucleotide polymorphisms in Brahman steers and their association with carcass and tenderness traits[J]. Genet. Mol. Res., 2009, 8(1): 39-46.
[9]Schenkel F S, Miller S P, Jiang Z, et al. Association of a single nucleotide polymorphism in the calpastatin gene with carcass and meat quality traits of beef cattle[J]. Anim. Sci., 2006, 84(2): 291-299.
[10]Sambrook J, Russell D W. 分子克隆实验指南:上、下册[M]. 北京:科学出版社, 2002.
[11]Huang J, Forsberg N E. Role of calpain in skeletal-muscle protein degradation[J]. Proc. Natl. Acad. Sci. U S A, 1998, 95(21): 12100-12105.endprint
[12]Pringle T D, Harrelson J M, West R L, et al. Calcium-activated tenderization of strip loin, top sirloin, and top round steaks in diverse genotypes of cattle[J]. Anim. Sci., 1999, 77(12): 3230-3237.
[13]Melody J L, Lonergan S M, Rowe L J, et al. Early postmortem biochemical factors influence tenderness and water-holding capacity of three porcine muscles[J]. Anim. Sci., 2004, 82(4): 1195-1205.
[14]Geesink G H, Kuchay S, Chishti A H, et al. μ-Calpain is essential for postmortem proteolysis of muscle proteins[J]. Journal of animal science, 2006, 84(10): 2834-2840.
[15]Bishop M D, Koohmaraie M, Killefer J, et al. Rapid communication: restriction fragment length polymorphisms in the bovine calpastatin gene[J]. Anim. Sci., 1993, 71(8): 2277.
[16]Kappes S M, Keele J W, Stone R T, et al. A second-generation linkage map of the bovine genome[J]. Genome Res., 1997, 7(3): 235-249.
[17]Raynaud P, Jayat-Vignoles C, Laforet M P, et al. Four promoters direct expression of the calpastatin gene[J]. Arch. Biochem. Biophys., 2005, 437(1): 69-77.
[18]Schenkel F S, Miller S P, Jiang Z, et al. Association of a single nucleotide polymorphism in the calpastatin gene with carcass and meat quality traits of beef cattle[J]. Anim. Sci., 2006, 84(2): 291-299.
[19]邓桂馨, 张银花, 梁鸿斌. 肉牛CAST基因分子多态性与肉品质性状相关性的研究[J].北京农学院学报, 2007, 22(3): 25-27.
[20]王海震, 王莹, 刘定干. 真核生物mRNA 3′非翻译区的功能[J]. 生物化学与生物物理进展, 2008, 35(9): 980-985.
[21]Curi R A, Chardulo L A, Mason M C, et al. Effect of single nucleotide polymorphisms of CAPN1 and CAST genes on meat traits in Nellore beef cattle (Bos indicus) and in their crosses with Bos taurus[J]. Anim. Genet., 2009, 40(4): 456-462.
[22]Casas E, White S N, Wheeler T L, et al. Effects of calpastatin and micro-calpain markers in beef cattle on tenderness traits[J]. Anim. Sci., 2006, 84(3): 520-525.
[23]Barendse W J. DNAmarkers formeat tenderness[P]. International patent application PCT/AU02/00122. 2002. International patent publication WO 02/064820 A064821.endprint

