根皮苷对血吸虫病小鼠肝纤维化的作用*
毛志江,张 硕,2△,王庆林,2
(1.湖南省浏阳市中医医院,湖南 长沙 410000;2.湖南师范大学医学院,湖南 长沙 410153)
根皮苷对血吸虫病小鼠肝纤维化的作用*
毛志江1,张 硕1,2△,王庆林1,2
(1.湖南省浏阳市中医医院,湖南 长沙 410000;2.湖南师范大学医学院,湖南 长沙 410153)
方法 雄性昆明小鼠200只,适应性喂养1 w后,余20只做正常组,其余以腹部贴片法以血吸虫尾蚴感染小鼠,每只小鼠感染日本血吸虫尾蚴(30±1)条,建立血吸虫病肝纤维化小鼠动物模型。室温正常饲养6w后随机分:①模型组(n=20):7w末开始给以生理盐水灌胃,共15 w;②单纯吡喹酮杀虫组(n=20):以吡喹酮杀虫,剂量500 mg/kg,分两天给药,杀虫1 w后:予以生理盐水灌胃,每天一次,共15 w;③吡喹酮杀虫+IFN-γ(500 iu/kg/d)组(n=20):7 w末开始颈背部皮下注射用药,共15 w;④吡喹酮杀虫+根皮苷低、中、高剂量组(10 mg/kg/d、20 mg/kg/d、40 mg/kg/d):每组20只,7 w末开始灌胃用药,共15 w。正常组(n=20):不以尾蚴感染及吡喹酮杀虫,自尾蚴感染后第7 w开始给以生理盐水灌胃,共15 w。各组小鼠于末次给药12 h后眼球取血,断颈处死,留取血清、肝脾组织分别行:(1)生化检测:测定小鼠血清的Hyp、HA、PⅢNT、LN含量及TGF-β1和PDGF-BB含量;(2)肝组织病理学检查:应用HE染色观测虫卵结节大小,反映根皮苷各剂量组对血吸虫病肝纤维化的作用及机制。结果 Hyp、HA、PⅢNT、LN含量及TGF-β1和PDGF-BB含量在用药第4 w到第8 w呈降低趋势,且高剂量根皮苷的各项指标最接近空白组,抑制血吸虫病肝纤维化作用明显。HE染色显示高剂量根皮苷组肝脏变性坏死减轻明显,小叶结构完整。根皮苷各剂量组和IFN-γ组计分较模型组显著降低(P<0.01),根皮苷低、中量组与IFN-γ组有显著性差异(P<0.05),根皮苷各剂量组之间有显著性差异(P<0.05)。结果表明,根皮苷剂量呈量效增强关系。结论 ① 单纯吡喹酮杀虫后血吸虫肝纤维化仍能进展;② 在杀虫的基础上,联合根皮苷治疗可降低促纤维化因子TGF-β1、PDGF-BB,减轻小鼠肝组织炎症反应,保护肝细胞;减少胶原纤维表达,从而抑制血吸虫病性肝纤维化进程;根皮苷3个剂量组呈量效增强关系,以根皮苷(40 mg/kg/d)效果最好。
血吸虫;根皮苷;纤维化
血吸虫病最主要的病理改变是虫卵肉芽肿和肝纤维化,肝纤维化是肉芽肿的间接延伸,是影响患者生活质量与导致死亡的主要原因。肝星状细胞是肝纤维化发生发展的中心环节,为正常肝脏或者纤维化肝脏细胞外基质主要产生的细胞[1]。肝星状细胞活化、增殖以及合成各种细胞外基质成分受到多种因素影响,其中转化生长因子-β1(TGF-β1)、血小板衍生生长因子(PDGF),特别是TGF-β1与相应受体结合后能促进肝星状细胞大量增殖和胶原的表达和过度合成[2-3],导致肝纤维化的特征是肝胶原和其它基质蛋白的增高,使肝脏结构紊乱,肝功能下降[4]。目前尚无理想的抗肝纤维化的药物。根皮苷(Phlorizin,AP)是一种低毒和无诱变性的黄酮类物质。根皮苷对CCl4致小鼠肝纤维化具有作用[5],但未见其对血吸虫病肝纤维化的作用进行研究。本研究通过观察根皮苷对日本血吸虫病肝纤维化小鼠肝脏羟脯氨酸(Hyp)、透明质酸(HA)、血清Ⅲ型胶原(PCⅢ)、层连蛋白、转化生长因子-β1(TGF-β1)及血小板衍生生长因子(PDGF)表达的影响,观察肝组织病理变化,为探讨根皮苷抗日本血吸虫病肝纤维化的作用机制提供科学依据。
1 对象与方法
1.1 实验药物 根皮苷为99% 纯度的原料药购自南京泽朗生物医药公司;吡喹酮粉末由湖南师范大学医学院寄生虫教研室提供。
1.2 小鼠血吸虫病肝纤维化模型建立及动物分组 健康昆明小鼠140只,雌雄各半,体重(20±2)g,鼠龄6~8 周,湖南斯莱克景达实验动物有限公司提供,合格证号:SCXK(湘)2009-0004。实验对照组(A组)每只小鼠均不感染日本血吸虫尾蚴,其它小鼠每只感染血吸虫尾蚴(30±2)条,第56日用吡喹酮(500mg/kg,诺华制药)灌胃治疗2 d。治疗后小鼠随机分为单纯吡喹酮杀虫组(B 组)、根皮苷低(C组)、中(D组)、高(E组)剂量组、γ干扰素(F组)。B组每日灌胃生理盐水0.2 mL/20 g;C组每鼠每日灌胃根皮苷10 mg/kg/d;D 组每鼠每日灌胃根皮苷20 mg/kg/d;E组每鼠每日灌胃根皮苷40 mg/kg/d;F 组每鼠每日灌胃γ干扰素150 mg/kg/d。第4周和第6周每组各处死3只小鼠用于各项指标测定,第八周则处死各组除自然死亡后剩余小鼠用于各项指标测定。
1.3 检测项目和方法
1.3.1 肝纤维化指标检测 取右叶肝组织匀浆,离心,取上清,按照南京建成生物工程研究所提供的测试盒说明书测定肝组织羟脯氨酸(Hyp)含量。透明质酸(HA)、血清Ⅲ型胶原(PCⅢ)、层连蛋白、转化生长因子-β1(TGF-β)1和血小板衍生生长因子(PDGF)使用美国R&D公司的试剂盒测定含量。
1.3.2 病理学检查 小鼠肝组织石蜡切片经HE染色后作病理检查。

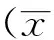
2 结 果
2.1 对血清因子及肝组织羟脯氨酸影响 小鼠的肝脏或者血液的Hyp、HA、PⅢNT和LN含量见间接反映根皮苷对血吸虫病肝纤维化的影响(见表1)。Hyp、HA、PⅢNT和LN含量第11周到第15周呈降低趋势,显示根皮苷对早期肝纤维化作用明显。Hyp、HA、LN水平组高于A 组,低于B、C、E 组(P<0.01,P<0.05);PⅢNT水平D 组高于A 组,低于B、C组(P<0.05)。吡喹酮组的肝纤维化指标显著高于空白对照组(P<0.05),发生肝肿胀现象,而给药组大幅降低。给药组中低剂量根皮苷组与吡喹酮组相比部分指标,但统计学分析未见显著性差异。中高剂量根皮苷的各项指标最接近空白组,抑制血吸虫病肝纤维化作用明显。结果表明,根皮苷剂量水平,呈量效增强关系,其中高剂量组40mg/kg 综合效果较佳。
2.2 对肝脏组织病理学影响 小鼠予相应药物治疗15w后,单纯吡喹酮杀虫组:肝脏虫卵肉芽肿、纤维增生、炎细胞浸润及小叶结构紊乱等病变较模型组轻,但大多数肝小叶结构被破坏,门管区纤维组织增生明显,纤维间隔多而粗大、致密。杀虫+根皮苷(10 mg/kg/d)组:虫卵肉芽肿大小范围和密集程度略少于单纯吡喹酮杀虫组,虫卵周围胶原纤维及炎症细胞浸润减少。杀虫+根皮苷(20 mg/kg/d、40 mg/kg/d)及杀虫+IFN-γ组:与单纯吡喹酮杀虫组相比,肉芽肿面积缩和纤维组织明显减少,其中杀虫+根皮苷(40 mg/kg/d)组尤其明显(见图1)。

表1 根皮苷影响小鼠血吸虫病肝纤维化Hyp、HA、PⅢNT和LN含量
注:a.与空白组比较,在P<0.05时差异显著;b.与吡喹酮比较,在P<0.05时差异显著。A:正常组;B:单纯吡喹酮杀虫组;C:杀虫+根皮苷(10mg/kg/d)组;D:杀虫+根皮苷(20mg/kg/d)组;E:杀虫+根皮苷(40mg/kg/d)组;F:杀虫+IFN-γ组。
HE染色肉芽肿少卵结节大小结果(见表2):单纯毗哇酮杀虫组和各给药组较正常对照组明显升高(P<0.01);杀虫+根皮苷各剂量组和杀虫+IFN-γ组较模型组显著降低(P<0.01);杀虫+根皮苷各剂量组比单纯吡喹酮杀虫组显著性小(P<0.05),杀虫+根皮苷各剂量组之间相互比较无显著差异(P>0.05),杀虫+根皮苷各剂量组与IFN-γ组比较无显著差异(P>0.05);杀虫+IFN-γ组比单纯吡喹酮杀虫组显著缩小(P<0.05)。

表2 根皮苷对各组小鼠肝组织虫卵结节的影响(×104 um2)
备注:aP>0.05;bP<0.05。A:正常组;B:单纯吡喹酮杀虫组;C:杀虫+根皮苷(10mg/kg/d)组;D:杀虫+根皮苷(20mg/kg/d)组;E:杀虫+根皮苷(40mg/kg/d)组;F:杀虫+IFN-γ组。
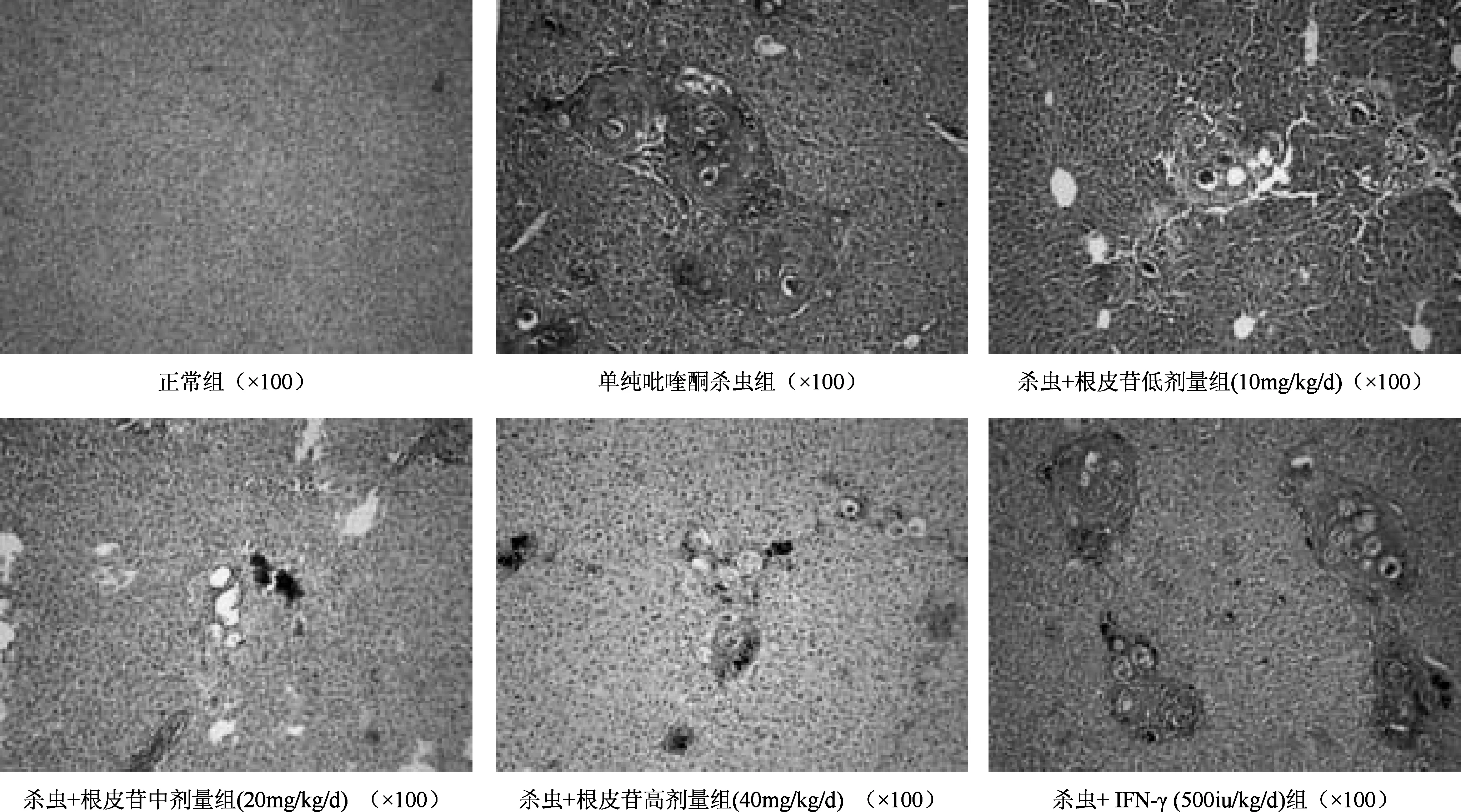
图1 各组小鼠肝脏虫卵结节HE染色
2.3 对TGF-β1、PDGF-BB的表达的影响 TGF-β1、PDGF-BB在正常组微量表达,单纯吡喹酮杀虫组在杀虫后血清中TGF-β1、PDGF-BB仍在增加,根皮苷各剂量组和IFN-γ组相对单纯吡喹酮杀虫组TGF-β1、PDGF-BB血清含量均有下降,根皮苷中、高剂量组对TGF-β1、PDGF-BB影响较显著,其中根皮苷高剂量组对TGF-β1、PDGF-BB影响接近IFN-γ组(见表3)。

表3 根皮苷对各组小鼠TGF-β1和PDGF-BB含量的影响
A:正常组;B:单纯吡喹酮杀虫组;C:杀虫+IFN-γ组;D:杀虫+根皮苷(10mg/kg/d)组;E:杀虫+根皮苷(20mg/kg/d)组;F:杀虫+根皮苷(40mg/kg/d)组。a:与单纯吡喹酮杀虫组比较差异显著P<0.05;b:与杀虫+IFN-γ组比较差异显著P<0.05。
[1]Alcolado R,Arth MJP,Iredale JP.Pathogenesis of liver fibrosis[J].Clin Sci,1997,92(2):103.
[2]Friedman SL,Arthur MH.Activation of cultured rat hepatic lipocytes by Kupffer cellconditioned medium.Direct enhancement of matrix synthesis and stimulation of cell proliferation via induction of platelet-derived growth factor receptors[J].J Clin Lnvest,1989,84(6):1780.
[3]Czaja MJ,Werner FR,Flanders KC.In vitro and in vivo association of transforming growth factor with hepatic fibrosis[J].J Cell Biol,1989,108(6):2477.
[4]Molecular regulation of hepatic fibrosis,an integrated cellular response to tissue injury[J].J Biol Chem,2000,275(4):2247-2250.
[5]张硕,洪波,王庆林,等。四种黄酮类化合物对CCl4致小鼠肝纤维化的防治作用[J].华西药学杂志,2012.
[6]Gryseels B,Polman K,Clerinx J,Kestens L.Human schistosomiasis[J]. Laneet,2006,368(9541):1106-1118.
[7]杨艳宏,蔡卫民,金国梁,朱善济,陈峰,翁红雷,刘荣华.日本血吸虫感染兔肝肌成纤维细胞的动态变化及其意义[J].中华医学杂志,1999,79:870-873.
[8]魏屏,罗端德,熊莉娟,曾令兰.毗哇酮对血吸虫病肝纤维化小鼠肝组织Bcl-2和Bax表达的影响[J].中国寄生虫病防治杂志,2005,18:419-421.
[9]Okazaki I,Watanabe T,Hozawa S.Reversibility of hepatic fibrosis:from the first report of collagen as e in the liver to the possibility of gene therapy for recovery[J].Keio J Med,2001,50(2):58-65.
[10]宋东眷,刘平.星状细胞在肝纤维化中的作用[J].肝脏,2000,5:157.
[11]贾皑,苌新明,张盈涛.螺内酯对实验大鼠肝组织TGF-β1、PDGF-BB 及α-SMA 表达的影响[J].西安交通大学学报(医学版),2004,25(1):64-75.
湖南省教育厅科研基金重点项目(NO:10A073)
毛志江(1981~),女,研究方向:主要从事医学检验与微生物研究.
△通信作者:张硕,硕士,E-mail:fullhouse66@163.com.
R285.5
A
1007-2349(2015)07-0073-03
2015-05-11)

