复方熊胆茵陈颗粒微生物限度检查及控制菌检查方法验证*
吴 仲,张 勋,孔祥佳,徐 伟,洪振丰
(福建中医药大学,福建 福州 350122)
复方熊胆茵陈颗粒微生物限度检查及控制菌检查方法验证*
吴 仲,张 勋,孔祥佳,徐 伟,洪振丰△
(福建中医药大学,福建 福州 350122)
目的 建立复方熊胆茵陈颗粒的微生物限度检查方法,保证检验结果的准确可靠。方法 按中国药典方法进行菌回收率试验及控制菌检查方法验证。结果 5种试验回收率试验均为70%以上,其中细菌以培养基稀释法进行检查,酵母菌、霉菌以常规法即可。控制菌检查中,大肠埃希菌、大肠菌群、沙门菌3者试验组均可检出试验菌,阴性组均无菌生长,阴性菌对照组亦无菌生长。结论 本试验建立的方法可作为复方熊胆茵陈颗粒的微生物限度检查方法学验证的依据。
复方熊胆茵陈颗粒;微生物限度;控制菌检查
复方熊胆茵陈颗粒是本校阮时宝教授的验方,由熊胆粉、茵陈、山楂等 7 味中药组成,具有清肝利湿、化痰祛瘀的功效,用于肝胆湿热、痰浊血瘀型脂肪肝,目前已开发为院内制剂[1]。为控制复方熊胆茵陈颗粒的质量,我们对本品的质量标准进行了研究,根据2010版《中华人民共和国药典》的相关规定[2],为有效反映本品的污染情况,建立复方熊胆茵陈颗粒的微生物限度检查方法并对其进行验证,以期建立适合该制剂的微生物限度检查方法,为制剂进一步开发提供依据。
1 材料
1.1 仪器 超净工作台、电热恒温培养箱(HH-B11-500型、30-35℃)、生化培养箱(SPX-150型25-28℃)、匀浆器(300-8000r/min)、电热恒温水浴锅(HH-8型)、立式压力蒸汽灭菌锅(LDZX-75KBS型)、电子天平(SE602F型)。
1.2 试液
1.2.1 稀释剂与培养基 pH7.0无菌氯化钠-蛋白胨缓冲液、0.9%无菌氯化钠溶液,均由中检所提供。营养琼脂培养基、改良马丁培养基、改良马丁琼脂培养基、营养肉汤培养基、乳糖胆盐发酵培养基购自广东环凯微生物科技有限公司,玫瑰红钠琼脂培养基、胆盐乳糖培养基(BL)、4—甲基伞形酮葡糖苷酸培养基(MUG)、四硫磺酸钠亮绿培养基(TTB)、胆盐硫乳琼脂培养基(DHL)、曙红亚甲蓝琼脂培养基(EMB)购自北京陆桥技术有限公司。上述培养基配方与中国药典2010版配方均相同。
1.2.2 供试药 复方熊胆茵陈颗粒(由福建中医药大学生产,批号20120901、20121012、20121203)。
1.2.3 试验菌株 大肠埃希菌(Escherichia coli)[CMCC(B)44 102]、金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26 003]、枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63 501]、白色念珠菌(Candida albicans)[CMCC(F)98 001]、黑曲霉菌(Aspergillus niger)[CMCC(F)98 003]、乙型副伤寒沙门菌(Salmonella paratyphi B)[CMCC(B)50 094]等均由福建省药品检验所提供。
2 方法
2.1 菌液的制备
2.1.1 细菌、霉菌及酵母菌计数用菌液的制备 取经30~35℃培养18~24 h的大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的营养肉汤培养物1ml至9 mL 0.9%无菌氯化钠溶液中,梯度稀释,使之含菌数约为50~100 cfu/mL的菌悬液,作为试验菌计数备用。
经23~28℃培养24~48 h的白色念珠菌的改良马丁培养物1 mL至9 mL 0.9%无菌氯化钠溶液中,梯度稀释至使之含菌数约为50~100 cfu/mL的菌悬液,作为试验菌计数备用。
经23~28℃培养5~7 d的黑曲霉改良马丁琼脂斜面培养物,加入3~5 mL 0.9%无菌氯化钠溶液(含0.05%(mL/mL)聚山梨酯80)洗脱孢子,并将孢子悬液吸出转入无菌试管内[3],以0.9%无菌氯化钠溶液梯度稀释至使之含孢子数约为50~100 cfu/mL的孢子悬液,作为试验菌计数备用。
2.1.2 控制菌检查方法验证用菌液的制备 接种新鲜培养的大肠埃希菌至营养肉汤培养基,于30~35℃培养18~24 h。取上述营养肉汤培养物梯度稀释,制成每1 mL含菌数为10~100 cfu的菌悬液,备用。
接种乙型副伤寒沙门菌至营养肉汤培养基中,于30~35℃培养18~24 h。取上述营养肉汤培养物梯度稀释,制成每1 mL含菌数为10~100 cfu的菌悬液,备用。
2.2 供试液的制备 取供试品10 g,流加pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,充分摇匀,作为1∶10供试液备用。
3 回收率的测定
3.1 常规法测定
3.1.1 试验组 取供试液、试验菌液1ml分别注入平皿内,并倾入15~20 mL琼脂培养基,摇匀,平行重复2次,按平皿法计数。
3.1.2 菌液组 测定所加的试验菌数,取试验菌注入平皿内,并倾入15~20 mL琼脂培养基,摇匀,平行重复2次,按平皿法计数。
3.1.3 供试品对照组 取供试液1 mL注入平皿内,分别倾入15~20 mL琼脂培养基,摇匀,平行重复2次,按菌落计数法测定供试品本底菌数。
3.1.4 阴性对照组 取试验用的稀释液(pH7.0无菌氯化钠-蛋白胨缓冲液)1 mL,注入平皿内,并倾入培养基,凝固,倒置培养。每种计数用的培养基各平行制备2个平皿。
3.2 培养基稀释法测定(金黄色葡萄球菌)
3.2.1 试验组 取供试液1 mL等量分注5个平皿内,试验菌加1 mL,倾注15~20 mL琼脂培养基,摇匀,每株试验菌平行制备2个平皿,按平皿法计数。
3.2.2 菌液组 测定所加的试验菌数,取试验菌注入平皿内,并倾注15~20 mL琼脂培养基,摇匀,每株试验菌平行制备2个平皿,按平皿法计数。
3.2.3 供试品对照组 取供试液1 mL等量分注5个平皿内,并倾注15~20 mL琼脂培养基,摇匀,平行制备2个平皿,按菌落计数法测定供试品本底菌数。
3.2.4 阴性对照组 取试验用的稀释液0.2 mL,注入无菌平皿内,倾入培养基,恒温培养。
3.3 分别统计上述各组菌落数,分别计算每株试验菌的回收率,结果见表1。
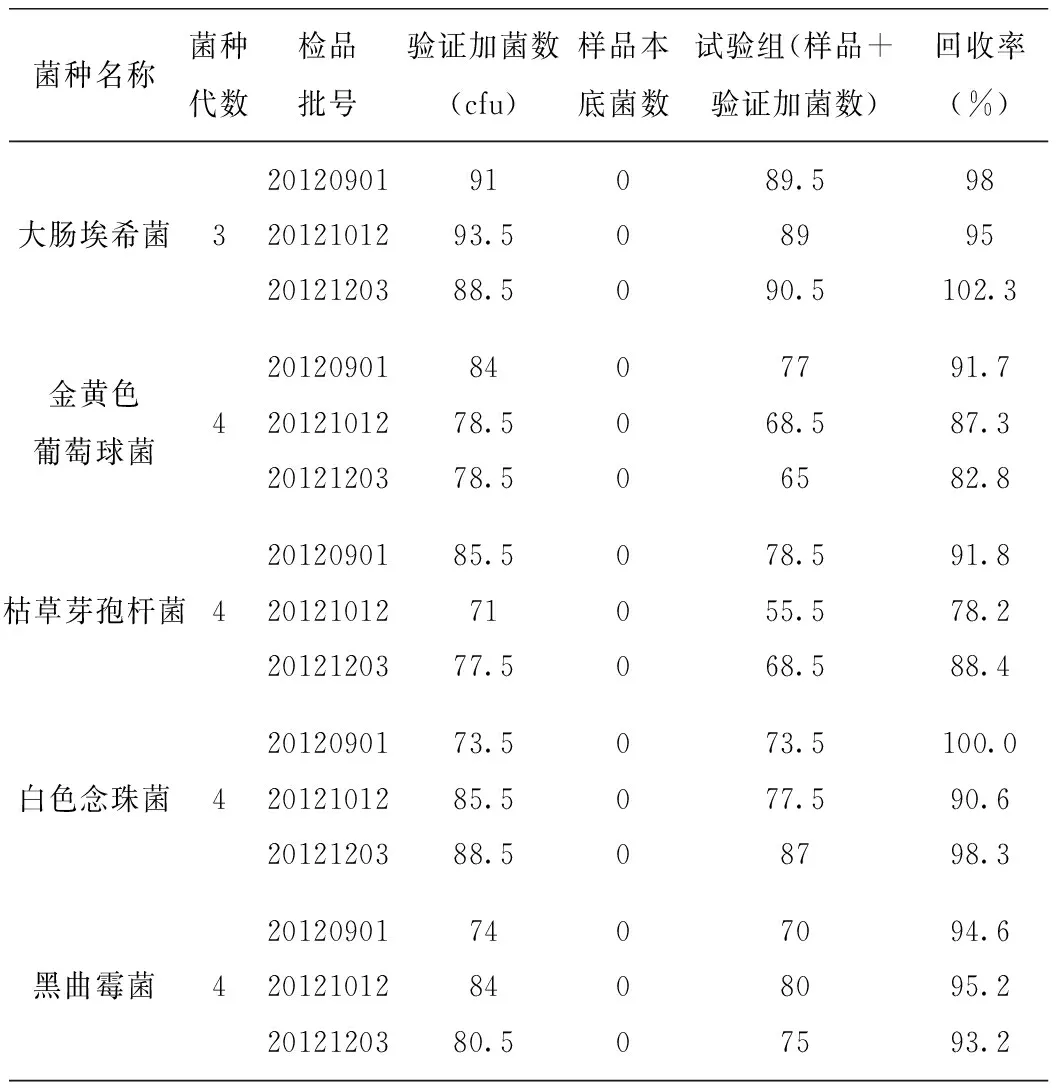
表1 3批熊胆茵陈颗粒的菌种回收率试验结果
4 控制菌的测定
4.1 大肠埃希菌的检查
4.1.1 胆盐乳糖培养基增菌 试验组:取胆盐乳糖培养基100 mL,加入供试液10 mL及大肠埃希菌菌悬液1 mL。供试品对照组:取胆盐乳糖培养基100 mL,加入供试液10 mL。阴性对照组:取胆盐乳糖培养基100 mL,加入稀释液10 mL。上述各组于30~35℃培养18~24 h,必要时则延长至48 h。
4.1.2 大肠埃希菌检查 按《中国药典》(2010版)规定的“微生物限度检查法”,将上述3组培养、观察,结果见表2。结果表明:按照常规法,3批样品大肠埃希菌试验组均可检出试验菌,阴性组及阴性菌对照组无菌生长。

表2 大肠埃希菌检查结果
4.2 大肠菌群的检查
4.2.1 试验分组 试验组:取3批供试液各1 mL和大肠杆菌试验菌液,于10 mL胆盐乳糖(BL)发酵培养基内。阴性菌对照组:取三批供试液各1 mL和金黄色葡萄糖球菌试验菌液,置10 mL胆盐乳糖(BL)发酵培养内。阴性对照组:取三批供试液各1 mL和pH7.0蛋白胨-氯化钠缓冲液1 mL置10 mL胆盐乳糖(BL)发酵培养基内。
4.2.2 大肠菌群检查 按《中国药典》(2010版)规定的“微生物限度检查法”将上述3组分别进行培养、观察,结果见表3。结果表明:按照常规法,3批大肠菌群试验组均可检出试验菌,阴性组及阴性对照菌均无菌生长。

表3 大肠菌群检查结果
4.3 沙门菌的检查 分别取本品10 g 加入3瓶200 mL营养肉汤中,1瓶加入1 mL沙门菌菌液作为试验组,1瓶加入1 mL金黄色葡萄球菌菌液作为阴性菌对照组,另取1瓶加入1 mL沙门菌菌液作为沙门菌阳性对照组,按沙门菌检查法检查。

表4 沙门菌检查结果
由表可知,阴性对照组未检出沙门菌,试验组可检出沙门
菌。可采用常规法进行本品的沙门菌检查。
5 讨论
根据《药典》规定,微生物限度检查回收率试验中,若试验组的菌回收率不低于70%,则照该供试液制备方法和计数法测定供试品的细菌、霉菌及酵母菌的菌数;若低于70%,可能存在抑菌现象,可尝试培养基稀释法。结合预实验及本试验结果,本品细菌用培养基稀释法检查,霉菌、酵母菌用常规法测定即可[4-6]。
控制菌检查验证时,阴性菌对照组不得检出阴性对照菌;若试验组检出试验菌,按此供试液制备方法和控制菌检查法进行供试品的该控制菌检查。由试验结果可知,可用常规方法进行控制菌的检查。
[1]李煌,徐伟,郑海音,等.复方熊胆茵陈颗粒质量标准研究[J].中国中医药信息杂志,2013,20(9):52-54.
[2]国家药典委员会.中华人民共和国药典[M].一部.北京:化学工业出版社,2010.
[3]吴宗彬.重感灵片微生物限度检查及控制菌检查方法验证[J].河北医学,2007,13(7):831-834.
[4]何进,高军,白杨,等.参黄流感颗粒微生物限度检查方法的验证[J].药学服务与研究,2012,12(1):76-78.
[5]杜凤霞,刘峰群,张诗龙,等.复方青花颗粒微生物限度检查方法的验证[J].解放军医药杂志,2012,24(8):50-52.
[6]刘淑娟,冯梅.金莲清热颗粒微生物限度检查法验证[J].北方药学,2014,11(10):10-11.
Microbial Limit Test and Control Bacteria Method Validation ofCompoundBearBileandCapillaryHerbGranule
WU Zhong1, ZHANG Xun1, KONG Xiang-jia1, XU Wei1, HONG Zhen-feng2
(1.SchoolofPharmacy,FujianUniversityofTraditionalChineseMedicine,Fuzhou350122,Fujian;2.SchoolofChinese-WesternMedicineIntegration,FujianUniversityofTraditionalChineseMedicine,Fuzhou350122,Fujian)
Objective: To establish a microbial limit test method forCompoundBearBileandCapillaryHerbGranuleto ensure accurate and reliable test results. Methods: Bacteria recovery rate tests and control bacteria method validation were conducted according to Chinese Pharmacopoeia. Results: The rate of five recovery tests was more than 70%, wherein the bacteria were checked by culture medium dilution method. Yeasts and molds could go in the conventional method. In the control bacteria check, test organisms could be detected from Escherichia coli, coliform bacteria and Salmonella groups and no bacteria growth was in Gram-negative group. There was also no bacteria growth in the negative control. Conclusion: The method established in the test may provide a basis for microbial limit test and control bacteria method validation ofCompoundBearBileandCapillaryHerbGranule.
CompoundBearBileandCapillaryHerbGranule, microbial limit, control bacteria check
福建省科技重大专项(NO:2010YZ0001-1)
R285.5
A
1007-2349(2015)07-0066-03
2015-03-16)
△通信作者:洪振丰,E-mail:wzrenwz@sohu.com。

