不同林下套种模式对油茶幼林根区土壤化学特性及微生物的影响
郑 灏, 杨志坚, 冯金玲, 陈世品, 林文俊, 白玉娜, 郑国华, 陈 辉
(福建农林大学经济林研究所,福建 福州 350002)
不同林下套种模式对油茶幼林根区土壤化学特性及微生物的影响
郑 灏, 杨志坚, 冯金玲, 陈世品, 林文俊, 白玉娜, 郑国华, 陈 辉
(福建农林大学经济林研究所,福建 福州 350002)
采用磷脂脂肪酸方法评估套种圆叶决明(YY1)、羽叶决明(YY2)、花生(HS)、黄豆(HD)、豇豆(JD)、绿豆(LD)和对照(CK)7种不同措施对油茶幼林根区土壤微生物群落结构的影响.结果表明:不同套种模式间土壤养分和微生物群落结构存在差异.各模式中真菌(18∶1ω9c)和细菌(16∶0、i16∶0和18∶0)均为优势种群.与CK相比,套种圆叶决明和羽叶决明模式显著提高了土壤总PLFA、细菌和真菌的含量;细菌/真菌的比例在套种圆叶决明、套种羽叶决明模式中提高,其余均低于CK.相关分析表明,土壤PLFA总量、细菌和革兰氏阳性菌等与土壤有机质、有效磷、有效氮和全氮显著相关.
油茶幼林; 套种; 土壤微生物群落; 磷脂脂肪酸
油茶(Camelliaoleifera)是山茶属植物,是我国特有的优质食用木本油料树种.油茶幼林树冠扩展缓慢,种植后林地内有一定的空间适合生长周期较短的作物种植[1].油茶幼林套种被认为是一种合理林地经营模式,不仅节约管理成本,还可获得林地的早期收益,实现以耕代抚,提高土壤肥力,促进油茶生长结实[2],已成为油茶丰产林集约经营的关键技术.油茶林地间种大豆可有效提高土壤有机质和氮、磷、钾的含量[3];间作花生和黄豆可促进新造油茶幼林的生长[4];间种花生和红薯可改善土壤的理化性质和提高油茶生长量[5].
土壤微生物种类繁多、数量巨大,是土壤—植被生态系统中最活跃、最具有决定性影响的组成部分之一.土壤的演变过程在很大程度上受到土壤微生物群落组成的限制[6],另外,外界环境条件如耕作方式,管理措施等的变化对土壤微生物的影响十分明显,而土壤微生物群落结构的变化能够及时反映出土壤的健康或土壤质量的变化,被认为是最有潜力的敏感性生物指标之一[7].相对于传统的微生物培养方法,磷脂脂肪酸(phospholipid fatty acid, PLFA)图谱分析技术因能直接、快速、精确地揭示土壤微生物生物量、组成以及群落信息等优点,被广泛应用于土壤微生物分析[8-11].近年来,对油茶林土壤微生物的研究主要采用传统的培养方式,而运用PLFA分析技术研究油茶林下套种对土壤微生物群落结构影响的报道较少.据此,本文选择6种豆科作物,采用磷脂脂肪酸分析法,研究不同套种模式下土壤养分以及土壤微生物群落变化规律,以期阐明油茶幼林套种模式的生物学意义,为油茶的增产机理和品质的提高等研究提供依据.
1 材料与方法
1.1 试验地概况
试验地位于福建省闽侯县桐口国有林场(东经119°17′,北纬26°05′),气候温暖,雨量充沛.年平均气温19.6 ℃ ,年降水量1343 mm,相对湿度77%,≥10 ℃年积温645 7 ℃,日照时数1888 h,无霜期326 d.试验地坡向东北,坡度约20°.
1.2 试验设计
试验材料为5年生油茶(Camelliaoleifera)幼林,林分株行距为2 m×3 m,树体长势良好.套种均为豆科作物,即圆叶决明(CassiarotundifoliaPers)(用“YY1”表示)、羽叶决明(Chamaecristanictitans)(用“YY2”表示)、豇豆(Vignasesquipedalis)(用“JD”表示)、花生(ArachishypogaeaLinn.)(用“HS”表示)、黄豆(Glycinemax)(用“HD”表示)和绿豆(Vignaradiata(Linn.) Wilczek)(用“LD”表示).
套种措施于2013年3月下旬开始,2014年3月进行重复处理.试验设置林地套种6种不同豆科作物处理和不套种任何作物作为空白对照(其它抚育管理措施一致),共设7个小区,配置完全随机,小区面积100 m2,每种处理均设置3个重复试验,小区周围设保护行.在套种前,先清除林地杂草、挖净茅草蔸等,对林地进行翻耕,耙碎,开挖竹节沟.套种作物据油茶根部20-30 cm,套种密度以各作物生长后能覆盖地表为宜.试验期间采用正常的周年抚育管理措施,同时为了促进套种作物生长,在播种前对各小区进行等量施肥,为复合肥710 kg·hm-2、钙镁磷肥710 kg·hm-2.
1.3 土壤样品采集及处理
于2014年9-10月,分别在套种作物的开花初期采集油茶幼苗根区范围内土壤,土层深度为0-20 cm,每小区按“S”形混合法,设5个样点,每个样点取土1 kg,每个小区土样混匀,四分法取1 kg后立即带回实验室.土样分为2份,一份鲜土直接过2 mm筛,以除去植物根系及土壤入侵物,冷冻干燥后,-80 ℃冷冻保存,用于磷脂脂肪酸测定;另一份自然风干后,用于土壤基本化学性质的测定.每个样品重复3次.
1.4 土壤样品测定方法
1.4.1 土壤化学性质测定 全氮采用碳氮元素分析仪测定;全磷用氢氧化钠碱熔—钼锑抗比色法(LY/T 1232-1999);全钾用氢氧化钠碱熔—火焰光度法(LY/T 1234-1999);有效磷用盐酸和硫酸溶液浸提法(LY/T 1233-1999);水解氮用碱解—扩散法(LY/T 1229-1999);速效钾用乙酸铵浸提—火焰光度法(LY/T 1236-1999);pH值用电位法(LY/T 1239-1999);有机质用水合热重铬酸钾氧化—比色法[12].
1.4.2 磷脂脂肪酸的提取与测定 磷脂脂肪酸的提取步骤和分析参考Frostegård et al[13],Kourtev et al[14]和刘波等[15]的方法.以正十九烷酸甲酯为内标,采用 Varian450GC-240MS气质联用仪检测:进样口温度为280 ℃,分流比为20∶1,柱温箱程序升温为70 ℃起始,保持1 min,以20 ℃·min-1升温至170 ℃,保持2 min,再以5 ℃·min-1升温至280 ℃,保持5 min,最后以40 ℃·min-1升温至300 ℃,保持1.5 min.PLFA含量用nmol·g-1表示.
1.5 数据处理
数据均为3次重复的平均值.Excel 2003软件进行数据初步统计,Origin 9.0作图,运用spss 20.0进行单因素方差分析(one-way ANOVA)、相关性分析,同组数据间采用LSD法检验差异显著性.
不同磷脂脂肪酸生物标记表征的各类微生物见表1.微生物群落的总生物量用磷脂脂肪酸总量来表征;细菌的含量用PLFA生物标记(14∶0、15∶0、a15∶0、16∶0、i16∶0、16∶1ω7c、16∶1ω9t 、i17∶0、a17∶0、18∶0、cy17∶0和cy19:0)的总和来表征;真菌的含量用18∶1ω9c来表征;革兰氏阴性菌的量用 PLFA生物标记(16∶1ω7c、16∶1ω9t、cy17∶0、和 cy19∶0 )的总和来表征;革兰氏阳性菌的量用 PLFA生物标记(a15∶0、i16∶0、i17∶0和a17∶0)的总和来表征[24].

表1 表征微生物的脂肪酸1)Table 1 PLFA signatures of microbes
1)前缀i、a分别表示甲基支链的异构和反异构;c、t表示顺式和反式;cy表示环丙基;10Me表示第10个碳原子甲基分枝.
2 结果与分析
2.1 不同套种模式下油茶幼林根区土壤化学性质的变化
套种模式显著改变了土壤化学性质,土壤养分状况有所改善.由表2可知,全氮和全磷含量在YY1和HD模式中较大,且显著高于CK,全氮含量分别提升16.8%和18.9%,全磷增加57.6%和93.6%.与CK对比,全钾、有效氮和有效钾在各套种模式中显著提高,其中JD模式大于其它模式.有效磷含量大小顺序为YY2>HD>YY1>JD>LD>CK>HS,YY2与HD差异显著,HD与YY1不显著,而YY1与CK显著.有机质含量均高于CK,但只有YY1模式和HS模式达显著水平,分别增加了19.4%和22.2%.JD和YY2模式土壤pH值与CK差异达到显著水平,但其余处理差异未达到显著水平,均呈酸性.综合考虑,YY1和YY2模式相较于其它模式,更有利于改善土壤养分状况.
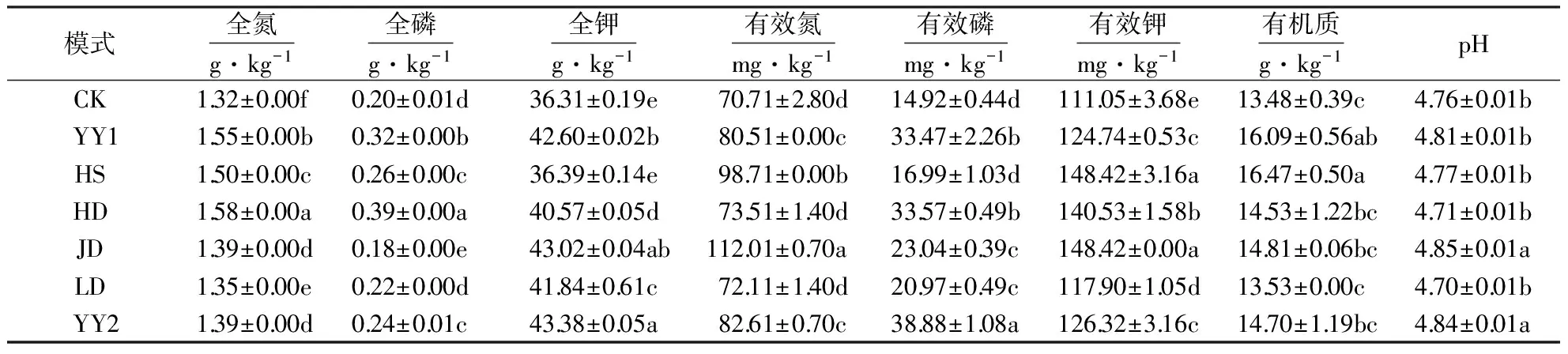
表2 不同套种模式下油茶幼林根区土壤养分含量1)Table 2 The nutrient contents in root zone soil of young Camellia plantation under different interplanting models
1)数据均为平均值±标准差;不同小写字母表示差异显著(P<0.05).
2.2 不同套种模式油茶幼林根区土壤微生物磷脂脂肪酸的变化
磷脂脂肪酸(PLFA)生物标记结果表明,油茶幼林根区土壤微生物PLFA的种类丰富,含有各种不饱和的、饱和的、具环丙基和支链的磷脂脂肪酸生物标记.试验检测到C12-C20共30种磷脂脂肪酸(如图1).其中,有革兰氏阳性细菌,生物标记如i14∶0、a15∶0、i16∶0、i17∶0等;革兰氏阴性细菌,生物标记如16∶1ω7c、16∶1ω9t、cy17∶0;真菌,生物标记如18∶1ω9c、18∶2ω6,9;放线菌,生物标记如10Me18∶0、10Me19∶0;原生生物,生物标记如20∶4ω6,9,12,15c.
由图1可知,在不同模式下,18∶1ω9c含量最高,是油茶根区土壤微生物中的绝对优势特征磷脂脂肪酸类群,约占总磷脂脂肪酸含量的14.55%-23.53%,其次是16∶0和i16∶0,它们分别占磷脂脂肪酸总量的16.21%-21.84%和4.25%-22.93%,表征细菌(16∶0、i16∶0)和真菌(18∶1ω9c、18∶2ω6,9)的磷脂脂肪酸百分比总和约50%,说明这两种微生物类群在油茶根区微生物群落中起主体作用.与CK相比,表征细菌的磷脂脂肪酸16∶0、i16∶0、18∶0百分比在各套种模式中有所提高,而表征真菌的磷脂脂肪酸18∶1ω9c和18∶2ω6,9百分比下降,经方差分析差异显著,其中在YY1和YY2模式中细菌和真菌所占百分比的变化最为明显,而HS模式下变化较小,其余模式介于二者之间.这说明林下套种土壤微生物的群落组成产生了差异.可能是由于不同豆科作物的根系分泌物的差异,从而影响油茶根区微生物的生存环境造成的.
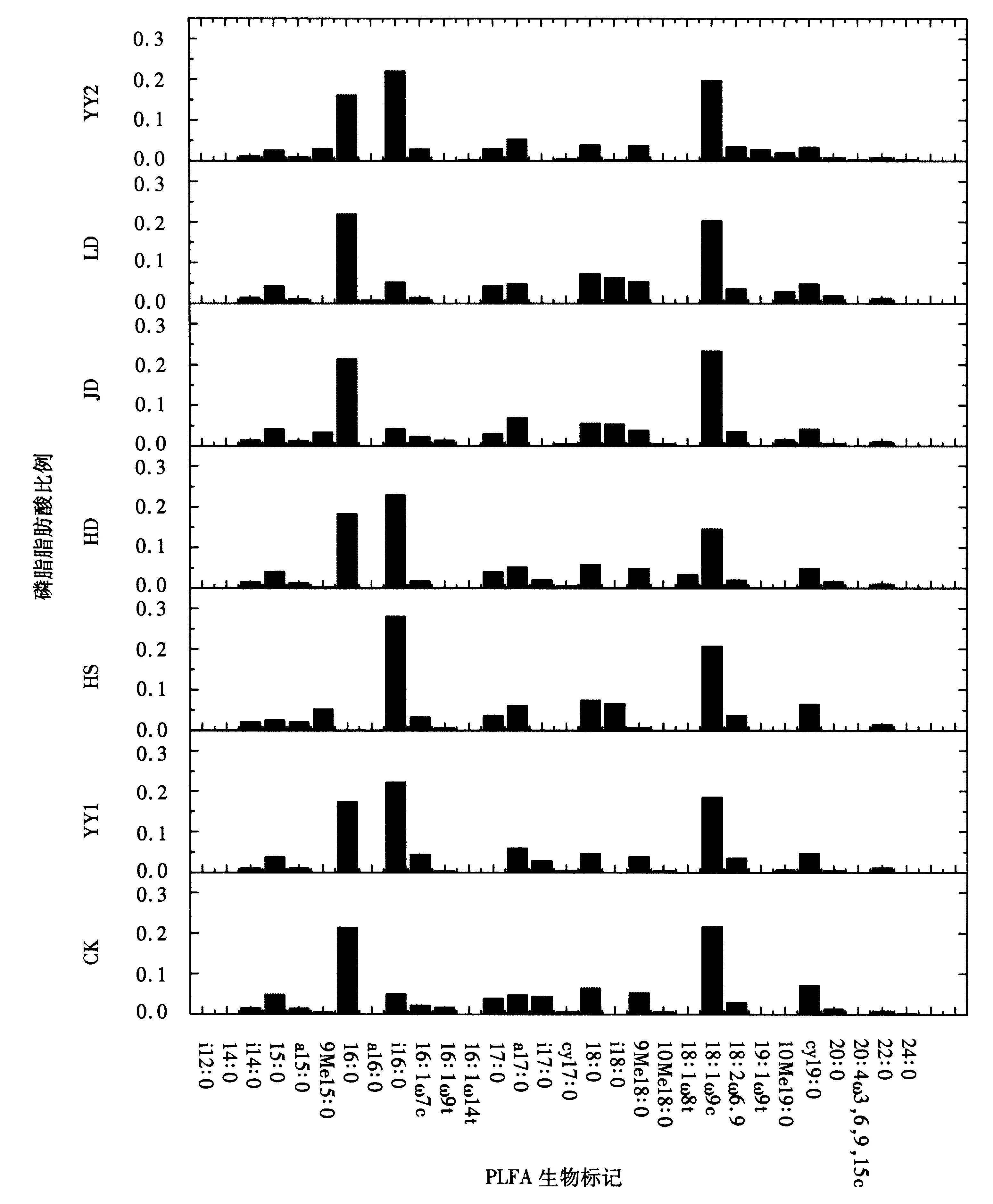
图1 不同处理油茶根区土壤微生物特征磷脂脂肪酸生物标记分析Fig.1 Analysis of PLFA biomarkers related to the microbial in the Camellia root region soil of different interplanting patterns
2.3 不同的套种模式对油茶幼林根区土壤微生物PLFA总含量的影响
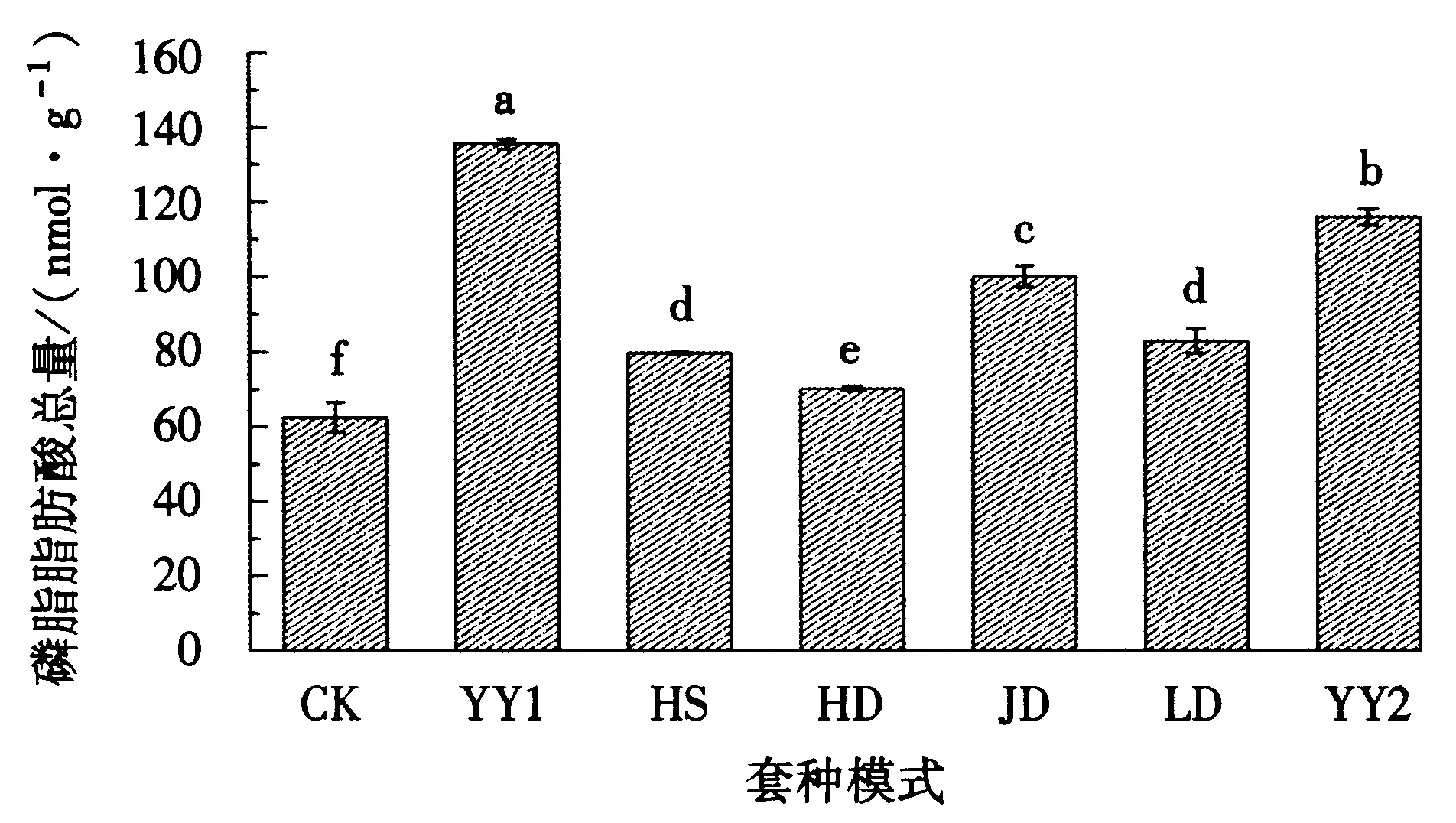
柱形图上的不同小写字母表示差异显著(P<0.05),下同.图2 不同套种处理下PLFA总含量的变化Fig.2 Total PLFA in root region soil under different treatments
不同套种模式对油茶幼林根区总磷脂脂肪酸(PLFA)含量存在影响,变化幅度为62.44-135.44 nmol·g-1(图2).CK处理的PLFA总含量最低,其余6种套种模式下PLFA总含量均高于CK处理,并且差异显著,其中YY1和YY2模式中的总PLFA含量较大,分别为135.44 nmol·g-1和116.00 nmol·g-1,显著高于其它处理,其次是JD处理、LD处理和HS处理,HD处理最低,仅为70.12 nmol·g-1.由此可见,油茶林下套种豆科作物能促进其根区土壤微生物的积累,而YY1和YY2模式使其增加的最明显,可能是因为这两种模式能为微生物提供更充足营养物,使其代谢活动更频繁,从而提高了微生物的总含量.
2.4 不同套种处理下油茶幼林根区土壤中各类群特征PLFA生物标记含量比较
如图3所示,不同套种模式下油茶幼林根区细菌和真菌的含量均显著高于CK处理.细菌含量在不同模式下的大小顺序为YY1>YY2>JD>HD>HS>LD>CK,并且YY1模式显著高于YY2模式.真菌含量在套种模式中的变化趋势与细菌相似,在YY1和YY2模式中显著高于其它处理.说明套种处理对细菌和真菌的影响是一致的.细菌/真菌比值是能反映出土壤微生物群落结构的重要指标.根区土壤细菌/真菌在HD、YY1、YY2、CK、HS、LD、和JD模式中呈递减趋势,但仅有HD和YY1处理显著高于CK.这表明,HD、YY1模式下微生物群落结构与CK存在明显的差异.
从图4可知,革兰氏阳性菌和革兰氏阴性菌的含量分别在9.66-41.91 nmol·g-1和5.01-13.45 nmol·g-1之间变化.革兰氏阳性菌含量大小顺序为YY1>YY2>HS>HD>JD>LD>CK,其中YY1模式显著大于其它模式.革兰氏阴性菌含量在YY1模式中仍然最大.G+/G-表现为YY2和HD模式显著高于CK,也显著大于其它模式.
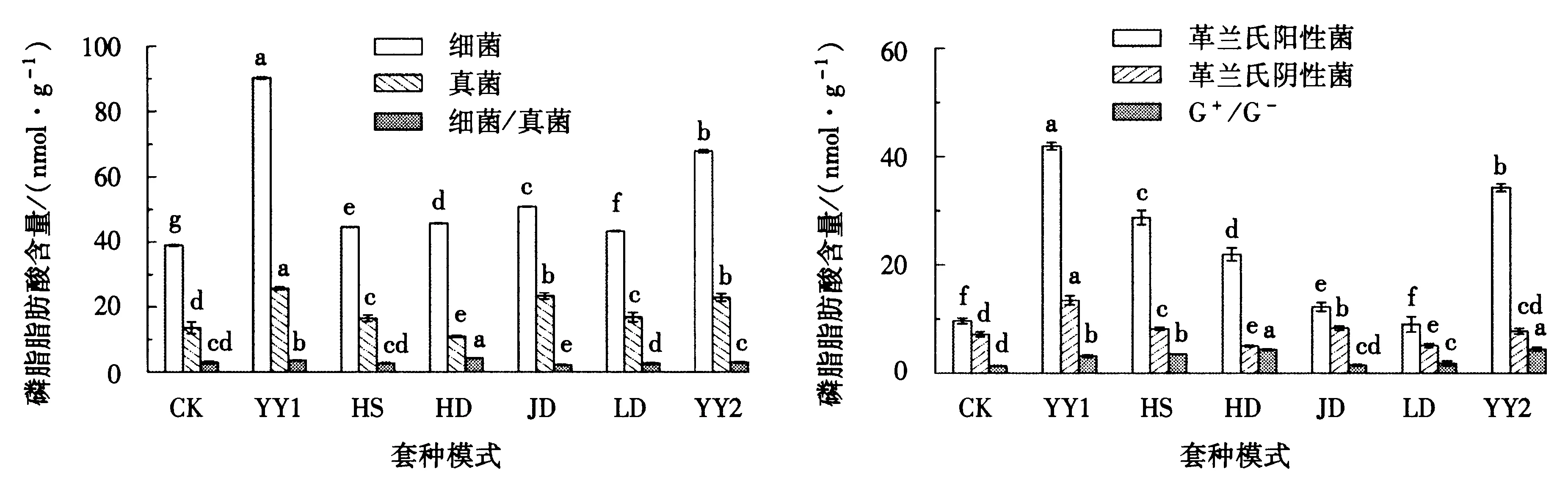
图3 不同套种处理下细菌、真菌含量及细菌/真菌Fig.3 The contents of PLFA for bacteria,fungi and the value of bacteria/fungi in soils under different interplangting models图4 不同套种处理下G+、G-的含量及G+/G-Fig.4 The contents of PLFA for Gram-positive bacteria, Gram-negative bacteria and the valueof G+/G- in soil under different interplangting models
2.5 土壤不同磷脂脂肪酸类型含量与土壤养分因子的相关性分析
不同处理油茶幼林根区土壤中各菌群PLFA与土壤养分联系紧密.从表3可见,土壤有效氮和有机质与PLFA总量、细菌、真菌和革兰氏阳性菌等都显著或极显著相关;全氮、全磷和有效磷的含量与细菌、革兰氏阳性菌、细菌/真菌和G+/G-极显著正相关;全钾与细菌、真菌的含量极显著正相关;而pH值仅与细菌和真菌的比例显著负相关.

表3 微生物生物量与土壤化学性质相关分析1)Table 3 Correlation analysis between the soil microbial biomass and chemical characteristics
1)*代表P<0.05,**代表P<0.01.
3 讨论
3.1 不同套种模式下土壤微生物群落结构的变化
在本研究中共检测到30中磷脂脂肪酸单体,表明套种处理下油茶根区土壤微生物种类丰富,其中表征细菌(16∶0、i16∶0)和真菌(18∶1ω9c、18∶2ω6,9)的磷脂脂肪酸含量总和占总PLFA含量的50%左右,并且细菌总量大于真菌总量,说明在微生物群落结构中以细菌为主体,这与胡婵娟等[25]的研究结果相似.6种豆科作物套种模式对微生物群落中的优势类群所占的比例发生变化,表明套种在一定程度上使微生物群落结构发生改变,其中以套种圆叶决明和羽叶决明两种模式最为明显,而花生模式最不明显.由于油茶幼林套种作物的生长直接或间接影响土壤生态系统,一方面套种作物改变了土壤的全氮、有效氮和有机质等养分含量,提高了土壤质量,另一方面通过其根系分泌物,为能高效利用碳源等能源的微生物种群提供有利环境,促进其生长,进而改变了微生物群落结构.
3.2 不同套种模式下各类群微生物生物量的变化
磷脂脂肪酸(PLFA)总含量能反映出土壤微生物的总生物量[21],PLFA的总量越高代表微生物的种类越多、数量越大,微生物群落结构越丰富,微生物分泌活动频繁,有利于植物对土壤养分的吸收[26];张爱加等对3种不同种植模式对甘蔗根际土壤微生物的研究表明,甘蔗套种大豆模式与单一宿根连作相比提高了土壤微生物总量,同时具有产量优势[27].本研究表明,套种圆叶决明和羽叶决明模式与其它模式相比更有效的提高了PLFA总量、真菌、革兰氏阳性菌、革兰氏阴性菌磷脂脂肪酸含量,总体来讲,两种决明模式比其它模式更有效的提高了微生物各菌群的含量.不同豆科作物的套种以及植物后期的生长特性,使土壤营养环境得到不同程度改善,从而造成了各菌群PLFA含量存在差异.细菌与真菌的比越高,土壤的生态系统越趋于稳定,油茶林下不同套种模式细菌与真菌的比值存在差异,其比值较高的是两种不同决明模式,这说明了油茶幼林套种圆叶决明和羽叶决明模式中根区土壤的生态系统更稳定.这可能是因为两种决明模式能有效的提高土壤有机质,全氮等养分含量,为微生物提供更丰富的碳源和氮源等能源,而且与细菌相比,土壤中真菌的群落结构更容易受到环境因子的干扰,由于豆科作物的套种,使固氮类微生物数量大幅度增加,从而影响了细菌与真菌的的结构比例[28].
3.3 不同套种模式下各类群土壤微生物与养分相关性
土壤各类群微生物PLFA含量与土壤磷元素密切相关.施瑶等人研究表明,在磷限制的条件下,添加适宜的磷能显著影响内蒙古温带典型草原土壤微生物的群落结构,提高微生物活性[29].本研究表明,套种圆叶决明和羽叶决明模式与其它模式相比能更有效提高土壤有效磷含量,而有效磷与PLFA总量、细菌生物量、G+生物量、细菌/真菌、G+/G-均存在极显著的正相关,故推测微生物代谢过程中需要从土壤中吸收一定量的磷元素参与到自身合成与代谢活动中,有效磷含量的提升增强了微生物活性,加快了微生物的繁殖,提高了微生物生物量.土壤各类群微生物PLFA含量与土壤碳、氮元素密切联系.孙锋等在土壤微生物研究中发现施用有机肥提高总微生物量和阳性菌与阴性菌的比例[30];陈晓娟等对不同土地利用方式的土壤微生物群落结构的研究发现,微生物生物量与总氮含量密切相关[31].本研究结果表明,不同豆科作物套种模式下土壤中各微生物菌群PLFA含量与有机质、全氮和有效氮含量成极显著或显著正相关,说明不同的套种模式下,碳和氮营养元素的输入可能是造成微生物PLFA含量产生差异的主要原因之一.在本研究中还发现,速效钾与各类群微生物均不相关,pH值与细菌与真菌比值呈负相关,这与裴雪霞等[32]、胡婵娟等[25]的研究不同,可能由于本试验地的土壤类型、林地植被、林地管理方式以及气候条件等因素共同作用的结果.
4 结论
不同的豆科套种措施提高了土壤养分含量,同时也改善了油茶幼林根区土壤微生物的群落结构,增加了各微生物菌群的生物量.套种使细菌与真菌的比值的增大,说明土壤生态更系统趋于稳定.整体上看,与其它模式相比,套种羽叶决明和羽叶决明模式的效果最佳.土壤养分与微生物生物量存在紧密的联系,其中土壤有机质、全氮、有效磷和有效氮含量的变化是影响土壤微生物PLFA含量的主要养分因素.
虽然,本研究通过PLFA分析技术发现了不同套种模式对微生物存在影响,但并不确定具体是哪些微生物,为此下一步将结合其它技术对这些内容进行更深入的分析.
[1] 杨曾辉,杨文英.我国油茶产业发展面临的问题及对策[J].作物研究,2011,25(2):103-104.
[2] 姚小华,王开良,罗细芳,等.我国油茶产业化现状及发展思路[J].林业科技开发,2005,19(1):3-6.
[3] 李云,黄永芳,叶小萍,等.油茶幼林间种大豆对土壤养分含量的影响[J].经济林研究,2013,31(2):54-59.
[4] 严邦祥,夏金元,周林明,等.不同间作对油茶生长量影响分析[J].华东森林经理,2013,27(1):20-21.
[5] 陈永忠,王玉娟,王湘南,等.间种对油茶林地土壤理化性质及幼林生长量的影响[J].南京林业大学学报:自然科学版,2011,35(5):118-120.
[6] CAVIGELLI M A, ROBERTSON G P. The functional significance of denitrified community composition in a terrestrial ecosystem[J]. Ecology, 2000,81:1402-1414.
[7] MANICKAM N, PTHAK A, SAINI H S, et al. Metabolic profiles and phylogenetic diversity of microbial communities from chlorinated pesticides contaminated sites of different geographical habitats of India[J]. Journal of Applied Microbiology, 2010,109(4):1458-1468.
[8] 白震,何红波,张威,等.磷脂脂肪酸技术及其在土壤微生物研究中的应用[J].生态学报,2006,26(7):2387-2394.
[9] 张妤,郭爱玲,崔烨,等.培养条件下二氯喹啉酸对土壤微生物群落结构的影响[J/OL].生态学报,2015,35(3):1-10[2014-04-03].http://www.cnki.net/kcms/doi/10.5846/stxb201304150707.html.
[10] 林生,庄家强,陈婷,等.不同年限茶树根际土壤微生物群落PLFA生物标记多样性分析[J].生态学杂志,2013,32(1):64-71.
[11] 张亚玉,孙海,宋晓霞,等.林下参根区土壤微生物群落结构的研究[J].水土保持研究,2011,18(2):169-173.
[12] 鲁如坤主编.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000.
[13] FROSTEGÅRD A, TUNLID A, BÅÅTH E. Phospholipid fatty acid composition, biomass, and activity of microbial communities from two soil types experimentally exposed to different heavy metals[J]. Appl Environ Microbiol, 1993,59:3605-3617.
[14] KOURTEV P S, EHRENFELD J G, HGGELOM M. Exotic plant species alter the microbial community structure and function in the soil[J]. Ecology, 2002,83:3152-3166.
[15] 刘波,胡桂萍,郑雪芳,等.利用磷脂脂肪酸(PLFAs)生物标记法分析水稻根际土壤微生物多样性[J].中国水稻科学,2010,24(3):278-288.
[16] KIMURA M, ASAKAWA S. Comparison of community structures of microbiota at main habitats in rice field ecosystems based on phospholipid fatty acid analysis[J]. Biol Fertil Soils, 2006,43:20-29.
[17] OHANSEN A, OLSSON S. Using phospholipid fatty acid technique to study short term effects of the biological control agent Pseudomonas fluorescens DR54 on the microbial microbiota in barley rhizosphere[J]. Microb Ecol, 2005,49:272-281.
[18] WHITE D C, DAVIS W M, NICKELS J S, et al. Determination of the sedimentary microbial biomass by extractible lipid phosphate[J]. Oecologia, 1979,40:51-62.
[19] VESTAL J R, WHITE D C. Lipid analysis in microbial ecology: Quantitative approaches to the study of microbial communities[J]. Bioscience, 1989,39:535-541.
[20] FROSTEGÅRD A, BÅÅTH E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biol Fertil Soils, 1996,22:59-65.
[21] JOERGENSEN R G, POTTHOFF M. Microbial reaction in activity, biomass and community structure after long-term continuous mixing of a grassland soil[J]. Soil Biol Biochem, 2005,37:1249-1258.
[22] KAISER C, FRANK A, WILD B, et al. Negligible contribution from roots to soil-borne phospholipid fatty acid fungal biomarkers 18∶2ω6, 9 and 18∶1ω9[J]. Soil Biol Biochem, 2010,42:1650-1652.
[23] YU S, HE Z L, HUANG C Y. Advances in their search of soil microorganisms and theirmediated processes underheavy metal stress[J]. J Appl Ecol, 2003,14:618-622.
[24] YING J Y, ZHANG L M, WEI W X, et al. Effects of land utilization patterns on soil microbial communities in an acid red soil based on DNA and PLFA analyses[J]. J Soils Sediments, 2013,13:1223-1231.
[25] 胡婵娟,郭雷,刘国华.黄土丘陵沟壑区不同植被恢复格局下土壤微生物群落结构[J].生态学报,2014,34(11):2986-2995.
[26] 刘涛,刁治民,祁永青,等.根际微生物及对植物生长效应的初步研究[J].青海草业,2008,17(4):41-44.
[27] 张爱加,周明明,林文雄.不同种植模式对甘蔗根际土壤生物学特性的影响[J].植物营养与肥料学报,2013,19(6):1525-1532.
[28] 刘岳燕,姚槐应,黄昌勇.水分条件对水稻土微生物群落多样性及活性的影响[J].土壤学报,2006,43(5):828-834.
[29] 施瑶,王忠强,张心昱,等.氮磷添加对内蒙古温带典型草原土壤微生物群落结构的影响[J].生态学报,2014,34(17):4943-4949.
[30] 孙锋,赵灿灿,何琼杰,等.施肥和杂草多样性对土壤微生物群落的影响[J/OL].生态学报,2015,35(18):1-10[2014-11-19].http://www.cnki.net/kcms/doi/10.5846/stxb201401090071.html.
[31] 陈晓娟,吴小红,刘守龙,等.不同耕地利用方式下土壤微生物活性及群落结构特性分析:基于PLFA和MicroRespTM方法[J].环境科学,2013,34(6):2375-2382.
[32] 裴雪霞,党建友,张定一,等.不同耕作方式对石灰性褐土磷脂脂肪酸(PLFA)及酶活性的影响[J].应用生态学报,2014,25(8):2275-2280.
(责任编辑:吴显达)
Effects of interplanting patterns on chemical properties and microbialcommunity in root zone soils of youngCamelliaoleiferaforest
ZHENG Hao, YANG Zhi-jian, FENG Jin-ling, CHEN Shi-pin, LIN Wen-jun,BAI Yu-na, ZHENG Guo-hua, CHEN Hui
(Nontimber Product Forest Institute, Fujian Agriculture and Forestry University, Fhzhou, Fujian 350002, China)
Phospholipids fatty acid (PLFA) analysis was employed to examine the effects of seven interplanting patterns, namely interplanting withCassiarotundifoliaPers (YY1), soybean (HD), peanut (HS), mungbean (LD), cowpea (JD), andChamaecristanictitans(YY2), and interplanting with no crop(CK), on microbial community. The results showed that there were a greatly differences of soil nutrient and microbial community structure among different intercropping patterns. In each mode, fungus (18∶1ω9c) and bacteria (16∶0, i16∶0 and 18∶0) were the dominant species. Compared with CK treatment, interplanting withCassiarotundifoliaPers mode andChamaecristanictitansmode significantly increased the total soil PLFA, bacterial and fungal content. The ratio of bacteria/fungi increased in interplanting withCassiarotundifoliaPers andChamaecristanictitans, and the rest were decreased. Correlation analysis indicated that the total amount of soil PLFA, bacteria and Gram-positive bacteria was significantly correlate to soil organic, total N, available nitrogen and phosphorus.
youngCamelliaoleiferaforest; interrplanting; soil microbial community structure; phospholipid fatty acid
2014-12-03
2015-01-12
福建省科技重大专项(2013NZ0001-1);高等学校博士学科点专项科研基金(20123515110010);福建省林木种苗科技攻关四期项目(HX09007).
郑灏(1988-),男,硕士研究生.研究方向:森林生态学.Email:232319660@qq.com.通讯作者陈辉(1957-),男,教授,博士生导师.研究方向:森林培育学.Email:zjchchenh@163.com.
S714.3
A
1671-5470(2015)02-0147-07
10.13323/j.cnki.j.fafu(nat.sci.).2015.02.007

