蝙蝠蛾被毛孢(Hirsutellasinensis)菌丝体发酵液免疫活性的研究
赵 萍,刘 冰,2,竹 军,王 聪,丁毛毛
(1.兰州理工大学生命科学与工程学院,甘肃兰州 730050;2.合肥工业大学生物与食品工程学院,安徽合肥 230009)
蝙蝠蛾被毛孢(Hirsutellasinensis)菌丝体发酵液免疫活性的研究
赵 萍1,刘 冰1,2,竹 军1,王 聪1,丁毛毛1
(1.兰州理工大学生命科学与工程学院,甘肃兰州 730050;2.合肥工业大学生物与食品工程学院,安徽合肥 230009)
对蝙蝠蛾被毛孢菌丝体发酵液(HSFL)制剂进行体内和体外免疫活性研究。结果表明:该制剂在体外对ConA诱导的小鼠脾淋巴细胞的转化能力显著增加,并且在体外显著提高了小鼠脾脏中NK细胞的活性;在体内实验中,该制剂可以显著改善DNFB诱发的小鼠迟发型变态反应;显著提高小鼠腹腔巨噬细胞吞噬鸡红细胞的能力。蝙蝠蛾被毛孢菌丝体发酵液制剂具有调节免疫的生物活性。
菌丝体,发酵液制剂,免疫活性
冬虫夏草Cordyceps sinensis(Berkeley)Saccardo.是我国传统名贵中药材,主要产于我国,分布在西藏、青海、四川、云南等地。冬虫夏草是菌虫复合体,即蝙蝠蛾幼虫躯体上的一种子囊真菌[1]。冬虫夏草主要功效成分为虫草酸(D-甘露醇)、虫草素(3-脱氧腺苷)及抗菌活性物质、麦角甾醇、多肽和氨基酸、多种维生素等[2]。
虫草菌丝体液态深层发酵在虫草菌丝体和发酵产物的获得上大大缓解了虫草自然资源的破坏[3]。严林[4]首次报道了冬虫夏草的寄主之一——青海拉脊蝙蛾(Hepialus lagii Yan)幼虫头、胸、腹各部分的形态特征。目前,国家批准应用蝙蝠蛾拟青霉菌(Paecilomyces hepiali)和蝙蝠蛾被毛孢菌(Hirsutella sinensis)发酵产物作为人工发酵的虫草菌丝体。蝙蝠蛾被毛孢虫草菌丝体粉对大、小鼠急性毒性属于无毒级[5]。冬虫夏草及虫草菌丝体对肝脏、肾脏、心脏、免疫系统、抗肿瘤、调节血糖水平的作用[6-12],还具有改善睡眠的作用[13]。
以青海地区蝙蝠蛾被毛孢菌丝体发酵液(HSFL,fermented liquor of mycelium of Hirsutella sinensis)为研究对象,对其基本组成研究分析发现,其中虫草多糖和虫草素含量较高,也含有一些氨基酸和微量元素。蝙蝠蛾被毛孢菌丝体液态深层发酵在获得虫草菌丝体的同时,也得到了大量的菌丝体发酵液。鉴于HSFL含有的活性成分和高产量,HSFL可以作为保健食品的很好来源[14]。本实验将蝙蝠蛾被毛孢菌丝体发酵液配制成HSFL制剂,对该制剂进行免疫调节功能的研究。
1 材料与方法
1.1 材料与仪器
蝙蝠蛾被毛孢菌丝体发酵液 青海珠峰虫草药业有限公司;昆明种清洁级小鼠 160只,雌性,体质量为18~22 g,兰州大学动物实验中心(许可证号:SCXK(甘)2009-0004);YAC-1细胞株 西北民族大学医学院;刀豆蛋白A(ConA) 美国Sigma公司产品;RPMI-1640培养基 Hyclone公司产品;四甲基偶氮唑盐(MTT) 美国Sigma公司产品;胎牛血清 四季青公司产品;吉姆萨染液试剂盒 南京建成公司产品;2,4-二硝基氟苯(DNFB) 使用前称取50 mg,溶解于5 mL的丙酮麻油溶液中(丙酮∶麻油=1∶1)待用;酶标仪 Elx808 Bio Tek;二氧化碳培养箱 CB210 Binder。
1.2 HSFL制剂的配制
蝙蝠蛾被毛孢菌丝体发酵液60 ℃减压浓缩,抽滤、静置过夜去除沉淀,用苯酚-硫酸法测定的多糖含量,使浓缩液中多糖含量达到≥15 mg/mL,保证HSFL制剂具有增强免疫力的生物活性。浓缩去杂后的HSFL按比例加入甜味剂纽甜,得到HSFL制剂。
使用时,高剂量组取样液30 mL加蒸馏水至50 mL,混匀;中剂量组取样液30 mL加蒸馏水至100 mL,混匀;低剂量组取样液30 mL加蒸馏水至150 mL,混匀。
1.3 HSFL制剂体外免疫活性实验
1.3.1 ConA诱导的体外小鼠淋巴细胞转化实验 参考文献[15-18],常规制备小鼠脾淋巴细胞悬液,活细胞数>95%,调整细胞浓度为3×106/mL。将脾细胞悬液加入24 孔培养板中1 mL/孔,再加入ConA液1 mL/孔,空白组加双蒸水1 mL/孔,实验组分别加入不同稀释度HSFL制剂1 mL/孔。置于5% CO2、37 ℃孵箱中孵育68 h。之后离心,弃上清,加入MTT 50 μL/孔,继续培养4 h。培养结束后,每孔加入1 mL酸性异丙醇,吹打均匀,分装到96 孔培养板中,每个孔设置三个平行孔。用酶标仪在570 nm波长处测定光密度值。加ConA孔的光密度值减去不加ConA孔的光密度值,代表小鼠脾淋巴细胞的增殖能力。
1.3.2 小鼠体外NK细胞活性测定实验 参考文献[19-21],将YAC-1传代培养,调整细胞浓度为4×105/mL。制备小鼠脾淋巴细胞悬液,完全培养液调整细胞浓度3×106/mL。96 孔培养板中加入YAC-1细胞和小鼠脾淋巴细胞悬液各100 μL,自然释放孔加培养液100 μL,最大释放孔加1% NP40 100 μL。实验组加不同稀释度HSFL制剂各100 μL,每组设置三个平行孔,于37 ℃、5%二氧化碳培养箱中培养4 h,之后离心,弃上清液,加入LDH基质液,反应10 min,每孔加入1 mol/L的HCl 30 μL,在酶标仪490 nm处测定光密度值。按下述方法计算NK细胞活性。
NK细胞活性(%)=(反应孔OD-自然释放孔OD)/(最大释放孔OD-自然释放孔OD)×100
1.4 HSFL制剂体内免疫活性实验
将实验动物分为三大组,分别为免疫一组(体质量增重、脏器/体质量比值实验)、免疫二组(二硝基氟苯诱导小鼠迟发型变态反应)、免疫三组(小鼠腹腔巨噬细胞吞噬鸡红细胞实验),每大组随机分配40 只实验动物,按每千克体质量的实验剂量分为4个小组,分别为:对照组(0 mg/kg),低剂量组(25 mg/kg),中剂量组(50 mg/kg),高剂量组(100 mg/kg),对照组用生理盐水。按照以上分组和剂量,连续灌胃30 d。
1.4.1 体质量增重、脏器/体质量比值实验 末次称重后,颈椎脱臼处死小鼠并解剖,取出脾脏、肝脏和胸腺并称量,计算脏器和体质量间的比值。
1.4.2 二硝基氟苯诱导小鼠迟发型变态反应(DTH) 每只小鼠腹部脱毛,用DNFB溶液50 μL均匀涂抹致敏。5 d后,用DNFB溶液10 μL均匀涂抹于小鼠右耳(两面)。24 h后颈椎脱臼处死小鼠,剪下左右耳壳,用打孔器取下直径8 mm的耳片,称重。小鼠左右两耳质量之差表示DTH程度。
1.4.3 小鼠腹腔巨噬细胞吞噬鸡红细胞实验 每只小鼠腹腔注射20%的鸡红细胞悬液1 mL,间隔30 min处死小鼠,腹腔注射2 mL生理盐水,吸出腹腔洗液0.5 mL,滴于预先处理过的载玻片的琼脂圈内,37 ℃孵育30 min后,迅速用生理盐水冲洗,4%的吉姆萨溶液染色3 min,蒸馏水冲洗晾干。显微镜下计数,计算吞噬指数和吞噬百分率。
吞噬百分率(%)=吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞数×100
吞噬指数=被吞噬的鸡红细胞总数/计数的巨噬细胞数
1.5 统计学分析
采用SPSS17.0统计软件对实验数据进行分析。
2 结果与分析
2.1 HSFL制剂在体外对免疫活性的影响
2.1.1 HSFL制剂对ConA诱导的体外小鼠淋巴细胞转化实验的影响 通过人为添加抗原(ConA),使之侵入机体,通过观察淋巴细胞的转化能力来判断细胞免疫的强弱。高浓度的HSFL制剂对T淋巴细胞的免疫调节功能产生影响,而ConA刺激T细胞产生的增殖细胞中的线粒体水解酶活力也受到影响,从而使得光密度差值增大,显示出调节免疫的作用。表1结果显示,中剂量组和高剂量组与对照组比较有显著性差异(p<0.05),低剂量组与对照组比较无显著性差异(p>0.05)。根据《保健食品检验与评价技术规范(2003)》中“细胞免疫功能测定项目中的任一实验的两个剂量组结果阳性”,可判定HSFL制剂对ConA诱导的小鼠淋巴细胞转化实验结果为阳性。

表1 HSFL制剂对ConA诱导的小鼠淋巴细胞转化的影响
注:*表示与对照组比较p<0.05;光密度差值=OD加ConA孔-OD不加ConA孔。
2.1.2 HSFL制剂对小鼠体外NK细胞活性的影响 NK细胞是区别于T、B淋巴细胞的淋巴细胞群,主要存在于外周血、脾脏、骨髓及淋巴结中,因此可以通过测定机体脾脏中NK细胞的活性来反映机体的免疫功能。表2结果显示,中剂量组和高剂量组与对照组比较有显著性差异(p<0.05),低剂量组与对照组比较无显著性差异(p>0.05),根据《保健食品检验与评价技术规范(2003)》中“NK细胞活性测定实验的一个以上剂量组结果阳性”,可判定HSFL制剂对NK细胞活性实验结果为阳性。
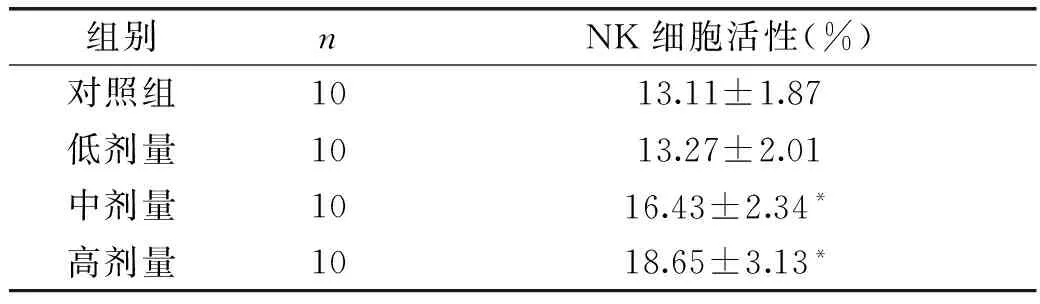
表2 HSFL制剂对NK细胞活性的影响
注:*表示与对照组比较p<0.05,表3~表5同。
2.2 HSFL制剂在体内对免疫活性的影响
2.2.1 HSFL制剂对小鼠肝脏、脾脏、胸腺指数的影响 胸腺和脾脏是机体重要的免疫器官,与细胞免疫、体液免疫相关,当机体接受外界免疫调节剂时,会使胸腺和脾脏的重量发生变化,因此测量其重量可作为判断机体免疫功能的辅助指标。如表3所示,与空白对照组相比,中、高剂量组肝脏系数显著增加(p<0.05);低剂量组无显著性差异(p>0.05);低、中、高剂量组脾脏系数显著增加(p<0.05);低、中、高剂量组胸腺系数无显著差异(p>0.05)。而与低剂量组相比,中、高剂量组的HSFL制剂能提高小鼠肝脏系数、脾脏系数和胸腺系数。
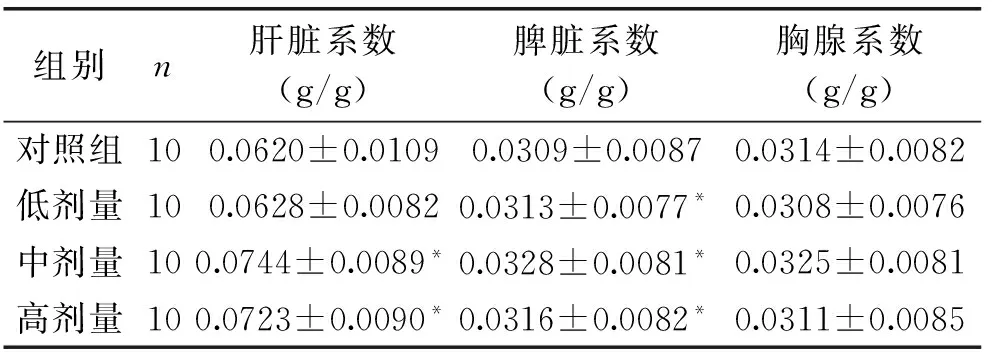
表3 HSFL制剂对小鼠肝脏、脾脏、胸腺指数的影响
2.2.2 HSFL制剂对小鼠迟发型变态反应的影响 T淋巴细胞经特异性抗原活化后,合成并分泌细胞因子,其中,细胞因子IL-2、TNF-β等使得吞噬细胞活化,引起以单核-巨噬细胞为主的迟发型超敏反应;细胞因子IFN-γ介导机体的细胞免疫;效应T细胞与同一抗原再次结合后刺激B细胞增殖分化,从而介导机体的体液免疫。因此,测定T淋巴细胞活性可以用来判定机体免疫功能的强弱。表4结果显示,低剂量、中剂量、高剂量的HSFL制剂对小鼠迟发型变态反应的影响差异显著(p<0.05),根据《保健食品检验与评价技术规范(2003)》中“细胞免疫功能测定项目中的任一实验的两个剂量组结果阳性”,可判定HSFL制剂对DNFB诱发的小鼠迟发型变态反应实验结果为阳性。

表4 HSFL制剂对迟发型变态反应的影响
2.2.3 HSFL制剂对小鼠腹腔巨噬细胞吞噬鸡红细胞的影响 单核-巨噬细胞是参与机体非特异性免疫防御的重要细胞,具有吞噬及杀伤能力,它的功能强弱可以反映机体非特异性免疫功能的强弱。表5结果显示低剂量HSFL制剂对小鼠腹腔巨噬细胞吞噬鸡红细胞的影响差异不显著(p>0.05),而中、高剂量对小鼠腹腔巨噬细胞吞噬鸡红细胞的影响差异显著(p<0.05),说明一定剂量的HSFL制剂能够提高机体的抗异物能力,从而增强机体的非特异性免疫能力。根据《保健食品检验与评价技术规范(2003)》中“单核-巨噬细胞功能测定项目中的任一实验的两个剂量组结果阳性”,可判定HSFL制剂对小鼠腹腔巨噬细胞吞噬鸡红细胞实验结果为阳性。

表5 HSFL制剂对腹腔巨噬细胞吞噬鸡红细胞的影响
3 结论
根据上述实验,HSFL制剂在体外免疫活性实验的结论为:HSFL制剂对ConA诱导的小鼠淋巴细胞转化实验结果为阳性,对NK细胞活性实验结果为阳性。HSFL制剂在体内免疫活性实验的结论为:HSFL制剂对DNFB诱发的小鼠迟发型变态反应实验结果为阳性,对小鼠腹腔巨噬细胞吞噬鸡红细胞实验结果为阳性。
根据中华人民共和国卫生部《保健食品检验与评价技术规范(2003)》[22]对保健食品评价结果判定的标准“在细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK细胞活性四个方面任两个方面结果阳性,可判定该受试样品具有增强免疫力功能作用”,可判定:HSFL制剂在体外具有免疫力调节功能,HSFL制剂在体内具有免疫力调节功能。最终表明,蝙蝠蛾被毛孢菌丝体发酵液制剂具有调节免疫的生物活性。
[1]张永杰,孙炳达,张姝,等.分离自冬虫夏草可培养真菌的多样性研究[J].菌物学报.2010,29(4):518-527.
[2]李连德,李增智,樊美珍,等.虫草多糖研究进展[J].安徽农业大学学报.2000,27(4):413-416.
[3] Y J Chen,M S Shiao,S S Lee,S.Y. Wang,Effect of Cordyceps sinensis on the proliferation and differentiation of human leukemic U937 cells[J]. Life Science. 1997,10(60):2349-2359.
[4]严林.青海拉脊蝠蛾幼虫分类特征研究[J].青海大学学报(自然科学版),2001,19(1):5-9.
[5]查捷,项华,孙建荣.蝙蝠蛾被毛孢虫草菌丝体粉急性毒性和致突变作用[J].浙江预防医学,2008,20(6):92-93.
[6]赵祥军,邱瑞桂,袁海龙,等.冬虫夏草道地药材与人工虫草菌丝体的分析比较[J].中药材,2003,26(6):408-409.
[7]张小强,浦跃朴,仲伟鉴.冬虫夏草及虫草菌丝体的药理作用研究现状[J].环境与职业医学,2002,19(2):122-123.
[8]许建明,丁长海,李连德,等.冬虫夏草多糖保护小鼠免疫性肝损伤的筛选研究[J].安徽医科大学学报,1999,34(3):173-175.
[9]戴春笋,刘志红,李恒,等.冬虫夏草防治环孢素A肾毒性的体内与体外实验研究[J].肾脏病与透析肾移植杂志,2000,9(4):322-328.
[10]俞宙,何建新.冬虫夏草水提取液对触发性心律失常的治疗作用[J].中国医药学报,1999,14(1):32-34.
[11]刘超,卢珊,姬美蓉,等.冬虫夏草对白血病NK细胞影响的体外研究[J].中国中西医结合杂志,1992,12(5):267-269.
[12]季晖,涂红湖,李耐三.人工虫草菌丝多糖的分离提取及其降血糖作用研究[J]. 中国药科大学学报,1993,24(1):39-42.
[13]俞萍,徐德洲.蝙蝠蛾被毛孢菌丝体改善小鼠睡眠的作用[J].中国医院药学杂志,2006,26(9):1179-1180.
[14]赵萍,曹心张,张新国等.冬虫夏草菌丝体发酵液中多糖的抗氧化活性研究[J].中医药学报,2014(05):27-29.
[15]周妍,王凌,孙利芹,等. 5种海洋微藻多糖体外免疫调节活性的筛选[J].海洋通报,2010(4):194-198.
[16]黄文凯,华欲飞,贺大伟,等.超滤处理对大豆肽体外免疫功能的影响[J].食品与生物技术学报,2010,26(5):31-34.
[17]马伟伟,李丽,周革非,等.海黍子硫酸多糖体外免疫与抗肿瘤活性[J].食品科学,2013,34(7):70-74.
[18]齐春会,张永祥,乔善义,等.六味地黄多糖体外对正常及衰老小鼠脾细胞免疫功能的影响[J].中国药理学通报,1999,15(2):157-160.
[19]王剑,蒲蔷,何开泽,等.川牛膝多糖的体外免疫活性研究[J].应用与环境生物学报,2008,14(4):481-483.
[20]徐明生,林日新,汤群,等.卵转铁蛋白体外免疫活性研究[J].食品与机械,2012,28(2):115-118.
[21]董国霞,陈靠山,石 磊,等.柘树根多糖的体外免疫增强作用[J].现代免疫学,2005,25(3):247-248.
[22]中华人民共和国卫生部.保健食品检验与评价技术规范[M].2003:22-34.
Evaluation of immune function of fermented liquor of mycelium ofHirsutellasinensis
ZHAO Ping1,LIU Bing1,2,ZHU Jun1,WANG Cong1,DING Mao-mao1
(1. School of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China;2.Institute of Bbiological and Food Engineering of Hefei University of Technology, Hefei 230009, China)
The purpose of this paper was to prove immune biological activity of preparation prepared by the fermented liquor of mycelium ofHirsutellasinensis(HSFL)invitroandinvivo. The preparation of HSFL could significantly influence both proliferation of ConA-induced spleen lymphocytes and activity of natural killer cellinvitro. Delayed-type hypersensitivity(DTH)and phagocytosis function of mononuclear-macrophage in high-dose and intermediate-dose of preparation of HSFL were significantly enhancedinvivo. These data indicated that the preparation of HSFL had immunomodulatory activity.
mycelium ofHirsutellasinensis;the preparation of fermented liquor;immunomodulatory activity
2015-04-09
赵萍(1964-),女,硕士,教授,主要从事食品科学、农产品加工与副产物综合利用方面的研究,E-mail:pingzhaogdqg@lut.cn。
甘肃省自然科学研究基金计划(0803RJZA044)。
TS201.4
B
1002-0306(2015)23-0363-04
10.13386/j.issn1002-0306.2015.23.067

