拟南芥蔗糖合酶基因合成、重组表达及其在酶催化合成莱鲍迪甙A中的初步应用
杜 婷,王 钰,陈量量,成采虹,李 艳,陈可泉
(南京工业大学生物与制药工程学院,江苏南京211816)
蔗糖合酶(EC2.4.1.13,sucrose synthase,SuSy)是植物蔗糖代谢的关键酶之一。该酶可催化蔗糖和UDP(二磷酸尿核苷)生成果糖和UDPG(尿苷二磷酸葡萄糖)的可逆反应,但目前研究认为该酶偏向于蔗糖裂解反应方向[1-3]。SuSy的活性可被己糖抑制并造成裂解反应的中止[4]。反应生成的UDPG是一种重要的尿苷二磷酸单糖,可在UDP糖基转移酶所催化的葡萄糖基转移反应中作为辅底物提供活化的葡萄糖基[5]。利用蔗糖合酶与糖基转移酶的偶联可使反应体系中的UDPG循环再生[6-8]。实验室前期研究的甜叶菊糖基转移酶UGT76G1能特异性催化甜菊糖中含量高并且具有较强后苦味的ST甙(甜菊糖甙)生成高甜度的RA甙(莱鲍迪甙A)[9],其催化反应由UDPG提供葡萄糖基。采用全细胞催化技术,通过外加葡萄糖生成胞内UDPG,可避免添加昂贵的UDPG作为反应底物[10],但涉及ST甙和RA甙进出细胞的问题,影响了催化效率。本研究中采用基于蔗糖合酶再生UDPG的双酶体系催化ST甙合成RA甙(图1)。先采用两步PCR合成蔗糖合酶AtSUS1的编码基因,然后构建其与糖基转移酶UGT76G1共表达的重组菌。采用重组菌制备粗酶液进行催化反应,并考察了UDP起始浓度、pH、温度,以及反应时间的影响。这一工作为建立高效、经济合成RA甙的酶催化工艺奠定了基础。

图1 基于蔗糖合酶的UDPG再生系统Fig.1 Cyclic utilizationof UDPG based on sucrose synthase
1 材料与方法
1.1 试剂与仪器
实验所用基因和引物 由南京金斯瑞公司合成;CloneEZ PCR Cloning Kit购自南京金斯瑞公司;Taq DNA聚合酶、T4 DNA连接酶、限制性内切酶和2000、15000 DNA Marker 购自Takara公司;质粒抽提试剂盒、DNA片段纯化与胶回收试剂盒 购于上海申能博彩有限公司;ST甙和RA甙 购自曲阜海根甜菊制品有限公司。
超声波细胞粉碎机JY92-IIN 购于宁波新芝生物科技股份有限公司;高速冷冻离心机eppendorf 5810R;ST甙和RA甙浓度测定采用安捷伦1290液相色谱系统和无锡加莱克色谱科技有限公司的NH2柱(4.6 ×250 mm,5 μm 120 Å)。
1.2 菌株和质粒
大肠杆菌菌株E.coli Rosetta(DE3)和载体pET-22b(+)为本实验室保藏;载体pMDTM-18T 购自TaKaRa公司;质粒pET28a-UGT为本实验室之前构建的在pET-28a(+)质粒的Nde I和Xho I位点间插入UGT76G1糖基转移基因的重组质粒。
1.3 培养基
大肠杆菌LB培养基:蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L;自诱导培养基(修改的TB培养基[11]):酵母提取物 24 g/L,胰蛋白胨 12 g/L,甘油5 g/L,磷酸氢二钾12.5 g/L,磷酸二氢钾2.3 g/L,葡萄糖2 g/L,乳糖3 g/L。
1.4 实验方法
1.4.1 蔗糖合酶AtSUS1的基因合成 检索National Center for Biotechnology Information(NCBI)数据库,根据已公布的拟南芥蔗糖合酶的基因序列(NM_122090),采用 DNAWorks[12]设计 72 条寡核苷酸引物,采用两步法合成基因[13],如图2所示。
第一步:将72条引物分为四组,每组18条引物等量混合作为模板,两端的两条寡核苷酸作为引物,先合成四个600 bp左右的小片段。PCR采用Primer STAR HS DNA Polymerase(TAKARA)在 50 μL 体系中进行。反应条件为:98℃变性10 s,68℃延伸1 min,30 个循环。
第二步:重叠PCR。将第一部中合成的四个小片段等量混合作为模板,采用第1条和第72条寡核苷酸引物进行重叠PCR合成大小为2.4 kb的大片段AtSUS1基因。PCR在50 μL体系中进行,反应条件为:98℃变性10 s,68℃延伸2.5 min,30个循环。
合成的基因用TAKARA公司的DNA产物胶回收试剂盒纯化。对纯化回收后的基因片段用Nde I和Xho I酶切,对质粒pET-22b(+)采用相同的酶进行双酶切处理,将以上处理完的表达载体和AtSUS1基因采用T4 DNA Ligase进行16℃过夜连接,次日转化到E.coli DH5α中涂布于氨苄平板(含氨苄青霉素100 μg/mL)并挑取单克隆,重组质粒为pET22b-SUS,对抽提质粒采用Nde I和Xho I双酶切鉴定,重组质粒测序工作由南京金斯瑞完成。

图2 两步PCR法合成基因AtSUS1Fig.2 Gene synthesis of AtSUS1 by two-step PCR
1.4.2 双基因表达质粒 pEUGT-SUS的重组构建 采用CloneEZ®试剂盒将AtSUS1基因亚克隆到质粒pEUGT,得到新的重组质粒pEUGT-SUS,将其转化到E.coli Rosetta(DE3)中,得到含双酶基因的重组菌E.coli Rosetta(pEUGT-SUS)。构建过程示意图如图3。
以上述pET22b-SUS质粒为模板,用引物P3和P4进行PCR扩增,得到基因AtSUS1。

划线部分为Xho I酶切位点,用相同的酶对质粒pET28a-UGT进行酶切得到线性化载体,用CloneEZ®试剂盒将PCR产物与线性载体进行重组。重组体系为 20 μL:线性化载体 6 μL,PCR 产物 6 μL,10 ×CloneEZ buffer 2 μL,CloneEZ Enzyme 2 μL,去离子水4 μL。得到的表达质粒 pEUGT-SUS导入 E.coli Rosseta(DE3)。

图3 表达质粒pEUGT-SUS构建过程示意图Fig.3 Construction of recombinant plasmid pEUGT-SUS
1.4.3 pEUGT-SUS重组菌的诱导表达 挑取重组菌E.coli Rosetta(pEUGT-SUS)单菌落和含pET-28a(+)的对照菌单菌落至5 mL含50 μg/mL卡那霉素和34 μg/mL氯霉素的LB培养基中,37℃,250 r/min培养12 h。然后按2%接种量分别接种到带相应抗性的自诱导培养基[14]中,37℃培养2 h,转30℃培养10 h诱导表达。4℃ 8000 r/min离心10 min收集菌体,用0.1 mol/L磷酸钾缓冲液(pH7.2)悬浮洗涤两次。用同样的磷酸钾缓冲液充分重悬裂解菌体,然后进行超声破碎(功率300 W,超声3 s,间歇5 s,共进行10 min)。破碎结束后,4℃ 8000 r/min离心20 min,所得上清液即粗酶液。
1.4.4 糖基转移酶活性测定 在5 mL的反应体系中 (ST 甙 1mmol/L、UDPG2mmol/L、MgCl21.5 mmol/L、pH7.2),加入1.4.3中的粗酶液进行反应,35℃反应1 h。高温95℃加热5 min终止反应,12000 r/min,离心1 min收集上清,然后用高效液相色谱(HPLC)分析RA甙浓度。酶活力单位定义为:在上述反应条件下,每分钟催化形成1 μmol RA甙所需要的酶量为1个活力单位(U)。
1.4.5 酶催化反应体系 取1.4.3小节中制备的粗酶液,转移至小三角瓶中,10 mL反应体系中包括以下物质:ST甙10 g/L、蔗糖10 g/L、粗酶液 82.3 mU/mL、UDP 0.001 mmol/L、MgCl21.5 mmol/L、CaCl210 mmol/L、磷酸钾缓冲液 0.1 mol/L,pH7.2,35 ℃,反应12 h取样。高温95℃加热5 min终止反应,12000 r/min,离心1 min收集上清,将上清液稀释10倍,然后用高效液相色谱(HPLC)进行分析。
主要考察了UDP起始浓度、pH、温度以及反应时间对酶催化反应的影响。在其他条件不变的情况下,分别改变这四个因素。UDP的起始浓度分别为0、0.001、0.01、0.1、0.5、1.0 mmol/L;反应的 pH 分别为6.4、6.8、7.2、7.6、8.0;反应温度分别为 25、30、35、37、40 和 45 ℃;反应时间分别为 3、6、9、12、16、20、24、30、36 和48 h。
1.4.6 RA甙测定 色谱柱:Lichrospher NH2柱(250 mm ×4.6 mm,5 μm);流动相为乙睛∶水(80∶20,V∶V),用冰醋酸调节pH至4.56;流速:1 mL/min;柱温:40℃;检测波长:210 nm[15]。
2 结果与分析
2.1 AtSUS1基因的合成
采用两步PCR法合成,第一步先合成四个600 bp左右的小片段,以此为模板进行第二步重叠PCR,合成2.4 kb左右的大片段。PCR产物用0.8%琼脂糖凝胶电泳鉴定,电泳结果如图4所示。可知,PCR产物有明显的特异条带(泳道2~4为平行制备的三份样品),对应片段大小与预期结果相符合。
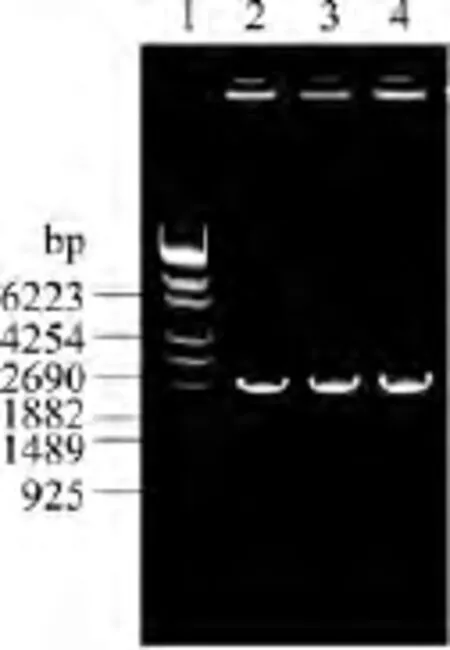
图4 AtSUS1基因的PCR电泳图Fig.4 PCR of AtSUS1
回收上述基因片段,采用Nde I和Xho I酶切之后与同样处理的pET-22b(+)质粒进行连接,连接产物转化E.coli DH5α中经氨苄平板筛选后,对获得的阳性克隆提取质粒用Nde I和Xho I进行酶切验证,结果如图5所示。在2.4 kb和5.5 kb处出现两条清晰条带,分别为目的基因与载体片段对应的大小,说明目的基因已成功连接到质粒pET-22b(+)。通过测序进一步确认目的基因已正确合成,该重组质粒命名为pET22b-SUS。
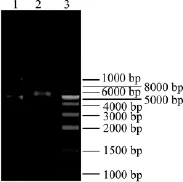
图5 pET22b-SUS酶切鉴定Fig.5 Enzyme digestion of pET22b-SUS
基因合成技术通过优化密码子和基因修饰为增强异源蛋白表达提供了最有力的工具。本研究中采用了二步PCR法合成了长约2.4 kb的基因片段,在第一步PCR中无需对PCR产物进行纯化,其产物直接作为第二步PCR的模板;采用Primer STAR HS DNA Polymerase(TAKARA)在每轮PCR中只需设计两步不同温度循环;在引物设计时将酶切位点带入基因两端的引物中,获得的目的片段可经酶切后一步克隆到表达载体上。因此,该方法具有便捷、快速的优点。
2.2 表达质粒pEUGT-SUS 的鉴定
用CloneEZ®试剂盒将AtSUS1基因亚克隆到pET28a-UGT质粒。对重组质粒进行Nde I和Xho I双酶切鉴定,酶切产物经凝胶电泳在2.4、1.4 kb处出现两条清晰条带,分别对应AtSUS1和UGT76G1编码基因的大小,如图6所示。结果表明目的基因已成功构建到 pET28a-UGT中,所得质粒命名为pEUGT-SUS。

图6 pEUGT-SUS酶切鉴定Fig.6 Enzyme digestion of pEUGT-SUS
2.3 双酶催化反应
为了测试蔗糖合酶AtSUS1和UDP糖基转移酶共表达效果,将重组菌E.coli Rosetta(pEUGT-SUS)表达后制备的粗酶液用于催化反应。分别考察了UDP起始浓度、pH、温度和反应时间对酶法合成RA甙的影响。
UGT76G1催化的糖基转移反应,需要UDPG作为活化的糖基供体,而UDPG极其昂贵。蔗糖合酶AtSUS1能将蔗糖与UDP催化生成果糖和UDPG。通过共表达这两个酶将两个反应偶联,该反应体系只需要添加少量相对廉价的UDP就可起始反应,通过蔗糖合酶实现UDPG的再生。分别考察了不同的UDP起始浓度对酶催化合成RA甙的影响,结果如图7所示。UDP浓度为0~0.01 mmol/L时,随着 UDP浓度上升,RA甙产量增加;而在此后UDP浓度为0.01~0.5 mmol时,RA甙产量下降,之后几乎保持不变。在0.01 mmol/L的UDP浓度条件下,10 g/L ST甙转化生成6.73 g/L RA甙,对应RA甙收率为56.2%。
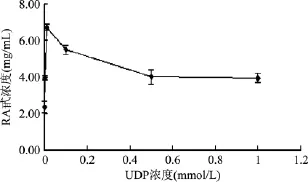
图7 不同UDP浓度对RA甙产量的影响Fig.7 The influence of different UDP concentration on the yield of RA
分别考察了不同pH缓冲液对酶催化反应的影响,结果如图8所示,在pH低于7.2时,RA甙生成量较低,这可能是由于在酸性缓冲液中糖基转移酶的活性较低,且蔗糖合酶反应方向倾向UDPG分解所致[16];当 pH 大于7.2时,RA 甙生成量减少,这可能是由于碱性溶液中Mg2+易沉淀,从而影响酶活性。因此,本反应中缓冲液的最佳pH为7.2。

图8 不同pH对RA甙产量的影响Fig.8 The influence of different pH on the yield of RA
分别考察了不同的反应温度对酶催化反应的影响,结果如图9所示,当催化反应温度小于40℃时,RA甙生成量随着温度的升高而增加,说明在25~40℃温度范围内,提高温度对RA甙量有一定促进作用。这可能是温度的提高,有利于提高糖基转移酶UGT76G1和蔗糖合酶AtSUS1的活性。在40~45℃,RA甙量逐步减少,说明较高温度会影响两个酶的活性。在40℃时,RA甙的浓度最高,为2.36 mg/mL,因此,本反应中最佳温度为40℃。这一温度也是重组糖基转移酶UGT76G1的最适反应温度[9]。
分别考察了不同的反应时间对酶催化反应的影响,结果如图10所示,当反应时间小于16 h时,RA甙生成量随反应时间延长而增加,说明在0~16 h范围内,随着反应进行,RA甙的量一直在积累。16 h以后,RA甙浓度开始下降,可能是由于产物RA甙存在一定的降解。在16 h时,RA甙的量达到最高,为6.39 mg/mL,因此,本反应中最佳催化反应时间以16 h。

图9 不同温度对RA甙产量的影响Fig.9 The influence of different temperature on the yield of RA

图10 不同反应时间对RA甙产量的影响Fig.10 The influence of different time on the yield of RA
3 结论与讨论
本研究中糖基转移酶和蔗糖合酶基因均属植物来源,尽管选用了携带稀有密码子表达质粒的E.coli Rosetta(DE3)作为宿主菌,但重组酶大部分依然以包涵体形式存在,因此,后续考虑采用融合标签来增加重组酶的可溶表达。本研究的实验条件下UDP浓度、反应pH、及温度等对催化产物合成的影响,是对反应体系中的两种酶的影响的综合体现,对糖基转移酶和蔗糖合酶的反应动力学性质分别表征有利于加深对双酶系统的了解,进一步提高其转化效率。
本研究构建了共表达甜叶菊UGT糖基转移酶和拟南芥AtSUS1蔗糖合酶的重组大肠杆菌E.coli Rosetta(pEUGT-SUS),将重组菌粗酶液用于催化合成RA甙的研究中,初步建立了循环利用UDPG,催化ST甙合成RA甙的“一锅双酶”反应体系,只需要添加相对廉价且远低于理论值用量的UDP为起始材料。这一策略有利于降低生产成本,推动酶法改质甜菊糖甙的实际应用。
[1]Geigenberger P,Stitt M.Sucrose synthase catalyses a readily reversible reaction in vivo in developing potato tubers and other plant tissues[J].Planta,1993,189:329-339.
[2]Heim U,Weber H,Baumlein H,et al.A sucrose synthase gene of Vicia faba L:expression pattern in developing seeds in relation to starch synthesis and metabolic regulation[J].Planta,1993,191:394-401.
[3]柴静,俞嘉宁,屈生宪.蔗糖合酶基因AtSUS3干涉后对拟南芥角果发育的影响[J].西北植物学报,2013,33(4):678-683.
[4]Elling L.Effect of metal ions on sucrose synthase from rice grains-a study on enzyme topograghy[J].Glycobiology,1995,5:201-206.
[5]陈圣,李艳,刘欢,等.生物法合成尿苷二磷酸葡萄糖的研究进展[J].中国生物工程杂志,2012,32(9):125-130.
[6]Masada S,Kawase Y,Nagatoshi M,et al.An efficient chemoenzymatic production of small molecule glucosides with in situ UDP- glucose recycling[J].FEBS Lett,2007,581(13):2562-2566.
[7]Terasaka K,Mizutani Y,Nagatsu A,et al.In situ UDP-glucose regeneration unravels diverse functions of plant secondary product glycosyl transferases[J].FEBS Lett,2012,586(24):4344-4350.
[8]Liu Z,Lu Y,Zhang J,et al.P1 Trisaccharide(Galα1,4Galβ1,4GlcNAc)synthesis by enzyme glycosylation reactions using recombinant Escherichia coli[J].Appl Environ Microbiol.2003,69(4):2110-2115.
[9]刘欢,李艳,严明,等.甜叶菊糖基转移酶UGT76G1的克隆表达及其性质研究[J].食品工业科技,2012,33(20):187-190.
[10]刘欢,李艳,严明,等.重组酿酒酵母全细胞催化合成莱鲍迪甙 A[J].食品与发酵工业,2012,38(7):6-10.
[11]萨姆布鲁克J,拉塞尔DW.分子克隆实验指南[M].黄培堂,译.3版.北京:科学出版社,2002:1597.
[12]Hoover DM,Lubkowski J.DNAWorks:an automated method for designing oligonucleotides for PCR-based gene synthesis[J].Nucleic Acids Res,2002,30(10):e43.
[13]Xiong AS,Yao QH,Peng RH.A simple,rapid,high-fidelity and cost-effective PCR-based two-step DNA synthesis method for long gene sequences[J].Nucleic Acids Res,2004,32(12):e98.
[14]Studier FW.Protein production by auto-induction in high density shaking cultures[J].Protein Expr Purif,2005,41(1):207-234.
[15]Kolb N,Herrera JL,Ferreyra DJ,et al.Analysis of sweet diterpene glycosides from Stevia rebaudiana:improved HPLC method.J Agric Food Chem,2001,49(10):4538-4541
[16]Sauerzapfe B,Engels L,Elling L.Broadening the biocatalytic properties of recombinant sucrose synthase 1 from potato(Solanum tuberosum L.)by expression in Escherichia coli and Saccharomyces cerevisiae[J].Enzyme Microb Tech,2008,43:289-296.

