大豆玉米复合肽液态发酵工艺优化
朱志红,徐艳阳,仇 洋,关欢欢,缪彬彬
(吉林大学 生物与农业工程学院,吉林长春 130022)
大豆玉米复合肽液态发酵工艺优化
朱志红,徐艳阳*,仇 洋,关欢欢,缪彬彬
(吉林大学 生物与农业工程学院,吉林长春 130022)
以豆粕和玉米蛋白粉为原料,应用枯草芽孢杆菌液态发酵制备大豆玉米复合肽。首先考察豆粕和玉米蛋白粉配比、发酵温度、摇床转速、发酵时间和接种量对复配蛋白的水解度和肽转化率的影响。在此基础上应用四因素三水平响应面实验设计对液态发酵工艺进行优化,并建立了相应的回归模型。结果表明,豆粕和玉米蛋白粉配比为2∶1时,液态发酵的优化工艺参数为:发酵温度为37 ℃、摇床转速为184 r/min、发酵时间为51 h、接种量为4%。在此条件下发酵的蛋白水解度为25.73%±1.78%、肽转化率为33.23%±1.06%,与理论预测值基本相符。该研究结果为豆粕和玉米蛋白粉的深加工及综合利用提供科学参考。
豆粕,玉米蛋白粉,液态发酵,枯草芽孢杆菌,大豆玉米复合肽
生物活性肽是指分子结构介于氨基酸和蛋白质之间的不同氨基酸组成片段,因其结构介于氨基酸和蛋白质之间而具有多种生物功效,近年来备受关注[1]。植物蛋白是制备生物活性肽的常用原料之一,豆粕和玉米蛋白粉分别是大豆提取油脂和玉米提取淀粉后的副产物,二者均含丰富的蛋白质,是优良的植物蛋白资源。我国的豆粕和玉米蛋白粉多用于饲料工业,利用率和附加值均较低[2-3]。国内外的研究表明将植物蛋白制成生物活性肽,不仅提高其应用价值,而且具有多种生物功效[4-5]。如张强[6]、王莉娟[7]、Zaelk shin[8]等研究表明大豆肽具有降血压、抗氧化等功效;昌友权[9]、朱艳华[10]、Yamaguchi M[11]等研究表明玉米肽具有抗运动疲劳、抗氧化、醒酒等功效。将大豆蛋白和玉米蛋白混合,通过发酵法或酶法水解得到的肽混合物即为大豆玉米复配肽。如王进[12]应用酶法水解豆粕和玉米黄粉获得了的复合肽,结果表明不仅使蛋白增加附加值,氨基酸的构成和蛋白质的消化率得以改善,而且复合肽的降血压功效比单一蛋白获得的活性肽高。
生产活性肽的制备技术有酶法和微生物发酵法。目前,工业化酶法生产的活性肽主要是用商业化的蛋白酶,安全性好、品质高,但是蛋白酶的种类少、成本高,限制了活性肽的生产和发展。微生物发酵法是将微生物酶和蛋白质降解结合起来生产活性肽,既能简化生产工艺又能降低生产成本,同时提高了蛋白资源的利用率和营养价值,具有较好的应用前景[13]。其中,液态发酵法因具有生产周期短、占地面积小、操作简便、生产条件稳定,并且可以机械化生产等优点,具有广阔的应用前景。目前对大豆和玉米复合蛋白的微生物发酵制备方面的研究较少,因此,本文应用酶系较优的枯草芽孢杆菌对豆粕和玉米蛋白粉液态发酵制备大豆玉米复配肽的工艺进行研究,旨在为豆粕和玉米蛋白粉的综合利用和深加工提供科学参考。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌(Bacillusnatto) 本院食品微生物实验室提供;玉米蛋白粉(蛋白质含量61.26%) 长春大成实业集团有限公司;豆粕(蛋白质含量40.77%) 吉林华裕食品公司。
蛋白胨、葡萄糖 北京奥博星生物技术有限责任公司;氢氧化钠、磷酸氢二钾、磷酸二氢钾、硫酸镁、酚酞、溴麝香草酚蓝、硫酸铜、酒石酸钾钠、三氯乙酸、乙醇、甲醛等 均为分析纯,北京化工厂;杆菌肽(Mr 1422.69) 上海源叶生物科技有限公司。
F80型高速粉碎机 金城市金城国胜实验仪器厂;DHP060型恒温培养箱 上海实验仪器厂;LD4-2A型低速离心机 北京市雷勃尔离心机有限公司;DSX-280A型高压蒸汽灭菌锅 上海宜川仪器厂;BS-IE振荡培养箱 国华电器有限公司;JJ200电子天平 常熟市双杰测试仪器厂;TU-1810型紫外分光光度计 北京普析通用仪器有限责任公司。
1.2 种子菌悬液的制备
种子培养液配方:1.5 g葡萄糖、3.0 g蛋白胨、0.4 g磷酸氢二钾、0.2 g磷酸二氢钾、0.05 g硫酸镁、45 mL去离子水,调节pH至7.0~7.2。
用无菌接种环挑取枯草芽孢杆菌干粉于种子培养液中,在30 ℃、180 r/min恒温振荡箱中培养42 h,得初始菌悬液。再取3%(mL/mL)的初始菌悬液于种子培养液中,同样条件下培养,获得酶活力1000~1200 U/mL的种子菌悬液,备用。
1.3 实验方法
1.3.1 蛋白水解度(DH)的测定 蛋白水解度的测定采用甲醛滴定法[14]。其计算公式如下:
式(1)
式(1)中,DH:蛋白水解度;V1:滴定蛋白水解液消耗氢氧化钠的体积(mL);V2:滴定空白消耗氢氧化钠的体积(mL);V3:蛋白水解液的体积(mL);M1、M2:豆粕、玉米蛋白粉中蛋白质的质量(g);1.4008∶1mL0.1mol/L氢氧化钠溶液相当的氮量(mg);6.25、6.24:豆粕、玉米蛋白粉中氮与蛋白质的换算系数。
1.3.2 肽转化率测定
1.3.2.1 杆菌肽标准曲线的绘制 杆菌肽标准曲线参考徐艳阳[15],并加以修改。将杆菌肽溶于5%(g/mL)三氯乙酸(TCA)中,配成浓度为1.8mg/mL杆菌肽溶液,依次稀释为0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8mg/mL杆菌肽溶液。分别吸取3mL不同浓度的杆菌肽溶液于相应试管中,各加入2mL双缩脲试剂,混匀,静止显色30min,在紫外分光光度540nm下测其吸光度。以杆菌肽的浓度为横坐标,吸光度(OD值)为纵坐标,绘制杆菌肽的标准曲线。
1.3.2.2 肽转化率的测定 用双缩脲法测定肽转化率。量取2mL发酵液,加入等体积10%(g/mL)TCA溶液,混匀、静置10min后以3000r/min离心10min,取上清液1mL于各试管中,加2mL去离子水和2mL双缩脲试剂,混匀,静止显色30min,相应做空白实验,在紫外分光光度540nm下测吸光度。肽转化率的计算公式如下:
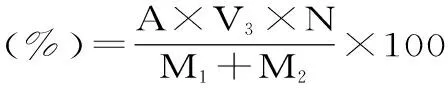
式(2)
式(2)中,A:大豆玉米复配肽的浓度,(mg/mL);M1、M2:豆粕、玉米蛋白粉中蛋白质的质量,(g);V3:蛋白水解液的体积(mL);N:样液稀释倍数。
1.4 实验方案
1.4.1 枯草芽孢杆菌发酵复合蛋白工艺过程 准确称取玉米蛋白粉1.25 g和豆粕3.75 g,加100 mL去离子水,搅拌均匀,调节pH至8.0,于121 ℃蒸煮20 min,取出冷却至室温,即得5%(g/mL)的发酵原料。然后向发酵原料中加入3%(mL/mL)种子菌悬液,混匀,于37 ℃、180 r/min条件下振荡培养48 h后,置沸水浴中加热10 min灭酶,然后迅速冷却至室温,以4000 r/min离心20 min获取上清液,测定上清液的蛋白水解度和肽转化率。
1.4.2 单因素实验设计 操作同1.4.1,采用控制变量法进行单因素实验,分别为发酵时间:24、48、60、72、84 h;发酵温度:31、34、37、40、43 ℃;摇床转速:140、160、180、200、220 r/min;接种量:1%、2%、3%、4%、5%(mL/mL);豆粕与玉米蛋白粉的配比:1∶3、1∶2、1∶1、2∶1、3∶1。
1.4.3 响应面优化实验设计 在单因素实验结果的基础上,选发酵温度、摇床转速、发酵时间和接种量为自变量,蛋白水解度和肽转化率为响应值。采用Box-Benhnken中心组合进行优化实验设计,实验因素及水平如表1。

表1 实验因素及水平编码表
1.4.4 大豆肽、玉米肽、大豆玉米复合肽比较设计 取三个锥形瓶,分别装入一定量豆粕粉、玉米蛋白粉、玉米蛋白粉和豆粕混合物,加一定量去离子水,得不同的液态发酵原料,参考操作1.4.1,在最优发酵条件下分别获取液态发酵大豆肽、玉米肽和大豆玉米复合肽的上清液,测定各上清液的蛋白水解度和肽转化率进行比较、分析。
1.4.5 数据处理与分析 每次实验重复三次,采用Excel 2007计算平均值、标准偏差及绘图;采用SPSS17.0软件进行方差分析、LSD多重差异比较;采用Design-Expert 8.06 软件进行响应面法(RSM)分析。
2 结果与讨论
2.1 杆菌肽标准曲线
杆菌肽的标准曲线如图1。

图1 杆菌肽标准曲线Fig.1 Standard curve of Bacitracin
通过最小二乘法获得回归方程为:y=0.0667x-0.0124,R2=0.9971。由回归系数R2可知杆菌肽的浓度在0~1.8 mg/mL范围内线性关系良好。
2.2 单因素实验结果
2.2.1 不同发酵时间对蛋白水解度和肽转化率的影响 在其他液态发酵条件一致情况下,考察发酵时间对蛋白水解度和肽转化率影响,结果见图2。
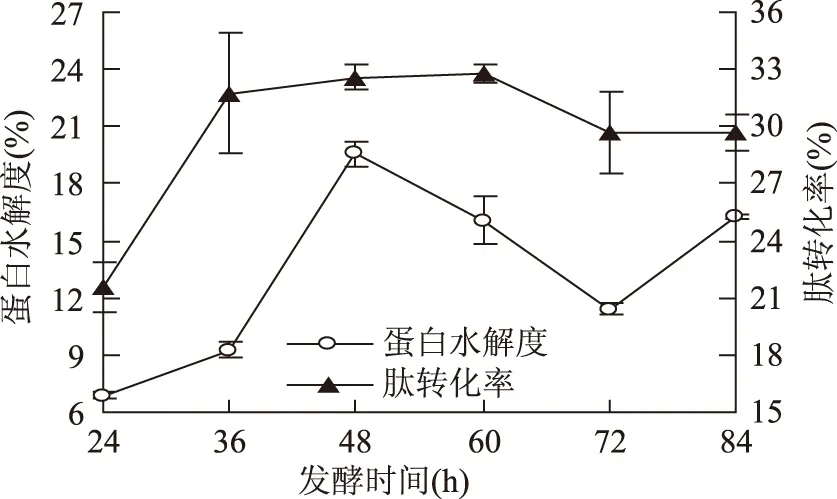
图2 发酵时间对蛋白水解度和肽转化率的影响Fig.2 Influence of fermentation time on DH of protein and peptide conversion rate
由图2可知,发酵时间在48 h时,蛋白水解度和肽转化率均达较高。蛋白水解度在48 h之前,呈上升趋势,其原因可能是随着发酵时间的延长,菌体产生蛋白酶增多,进而水解更多蛋白。超过48 h之后,蛋白水解度呈下降趋势,其原因大致是发酵液中的营养成分缺失或者复合蛋白成分减少,使菌的生长、产酶能力和酶作用力受到了抑制,超过72 h蛋白水解度再次增加,可能原因是液体发酵过程中,因含水量大,发酵时间影响发酵底物的pH变化,起初pH改变较小,随发酵时间的延长,pH逐渐减小,进而影响菌体对底物的水解[16]。经方差分析可知,不同发酵时间对蛋白水解度和肽转化率的影响极显著(p<0.01,p<0.01)。其中,经LSD多重差异比较分析,发酵时间48 h与36、60、72、84 h之间肽转化率差异不显著(p=0.574>0.05,p=0.862>0.05,p=0.065>0.05,p=0.062>0.05),且发酵时间为48 h用时较短。所以,综合考虑发酵时间选取48 h较佳。
2.2.2 不同发酵温度对蛋白水解度和肽转化率的影响 在其他液态发酵条件一致下,考察发酵温度对蛋白水解度和肽转化率影响,结果见图3。

图3 发酵温度对蛋白水解度和肽转化率的影响Fig.3 Influence of fermentation temperature on DH of protein and peptide conversion rate
由图3可知,液态发酵过程中,31~37 ℃时,蛋白水解度和肽转化率与发酵温度呈正相关,37 ℃时,其蛋白水解度和肽转化率最大,超过37 ℃后,蛋白水解度和肽转化率与发酵温度呈负相关,其原因是温度较低时,未达到菌生长繁殖和酶作用的最适温度。温度越高,菌体本身的蛋白质和酶易因热变性和失活也越快,菌体易于衰老,从而影响产物的变化[17]。经方差分析可知,不同发酵温度对蛋白水解度和肽转化率的影响极显著(p<0.01,p<0.01)。所以,综合考虑发酵温度选取37 ℃较佳。
2.2.3 不同摇床转速对蛋白水解度和肽转化率的影响 在其他液态发酵条件一致下,考察摇床转速对蛋白水解度和肽转化率影响,结果见图4。

图4 摇床转速对蛋白水解度和肽转化率的影响Fig.4 Influence of shaker speed on DH of protein and peptide conversion rate
由图4可知,摇床转速低于180 r/min时,蛋白水解度和肽转化率随着摇床转速变大而增加,摇床转速180 r/min时,蛋白水解度和肽转化率均达最高。摇床转速高于180 r/min时,蛋白水解度和肽转化率呈下降趋势,其原因是枯草芽孢杆菌为需氧菌种,发酵过程中,摇床转速不同改变了气态氧溶解于培养液的速度和含量,进而影响菌的生长、产酶及酶作用,即含氧量过高或过低均抑制菌种生长产酶[18],进而影响蛋白酶水解底物蛋白的活力。经方差分析可知,不同摇床转速对蛋白水解度和肽转化率的影响极显著(p<0.01,p<0.01)。其中,经LSD多重差异比较分析,摇床转速180 r/min与200、220 r/min之间蛋白水解度差异不显著(p=0.06>0.05,p=0.06>0.05);所以,综合考虑摇床转速选取180 r/min较佳。
2.2.4 不同接种量对蛋白水解度和肽转化率的影响 在其他液态发酵条件一致下,考察接种量对蛋白水解度和肽转化率影响,结果见图5。

图5 接种量对蛋白水解度和肽转化率影响Fig.5 Influence of Inoculum on DH of protein and peptide conversion rate
由图5可知,接种量为1%(mL/mL)时,蛋白水解度最大。随着接种量的增加,蛋白水解度呈下降趋势,接种量为4%时,肽转化率最大,明显高于其他接种量。经方差分析可知,不同接种量对蛋白水解度和肽转化率的影响极显著(p<0.01,p<0.01)。经LSD多重差异比较分析,接种量4%与2%、3%、5%(mL/mL)之间蛋白水解度差异不显著(p=0.188>0.05;p=1.000>0.05;p=0.121>0.05),接种量4%与1%之间蛋白水解度差异显著(p=0.007<0.05)。所以,综合考虑接种量选取4%较佳。
2.2.5 豆粕和玉米蛋白粉的不同比例对蛋白水解度和肽转化率的影响 在其他液态发酵条件一致下,考察豆粕和玉米蛋白粉的配比对蛋白水解度和肽转化率影响,结果见图6。

图6 豆粕和玉米蛋白粉配比对蛋白水解度和肽转化率影响Fig.6 Influence of Proportion of soybean and corn gluten meal on DH of protein and peptide conversion rate
由图6可知,在一定瓶装量下,随着豆粕质量的增加,玉米蛋白粉质量的减少,蛋白水解度先增加后减少,肽转化率呈上升趋势,主要原因可能是所采用的枯草芽孢杆菌更有利于豆粕的发酵水解[19]。经方差分析可知,豆粕和玉米蛋白粉的不同配比对蛋白水解度和肽转化率的影响极显著(p<0.01,p<0.01)。当豆粕和玉米蛋白粉的配比为2∶1时,蛋白水解度得最大值。此外,结合尤新[20]和王进[12]对复配蛋白和复配肽的研究成果(37%浓缩玉米蛋白粉和63%大豆蛋白粉复配),豆粕和玉米蛋白粉配比为2∶1时,豆粕和玉米蛋白粉的总氨基酸含量更接近食品FDA氨基酸推荐标准。所以,综合考虑豆粕和玉米蛋白粉配比确定2∶1为最佳。
2.3 响应面法优化与分析
2.3.1 响应面优化实验结果 在单因素实验的基础上,用Design-Expert 8.06 软件进行Box-Behnken优化设计与分析,实验结果见表2。
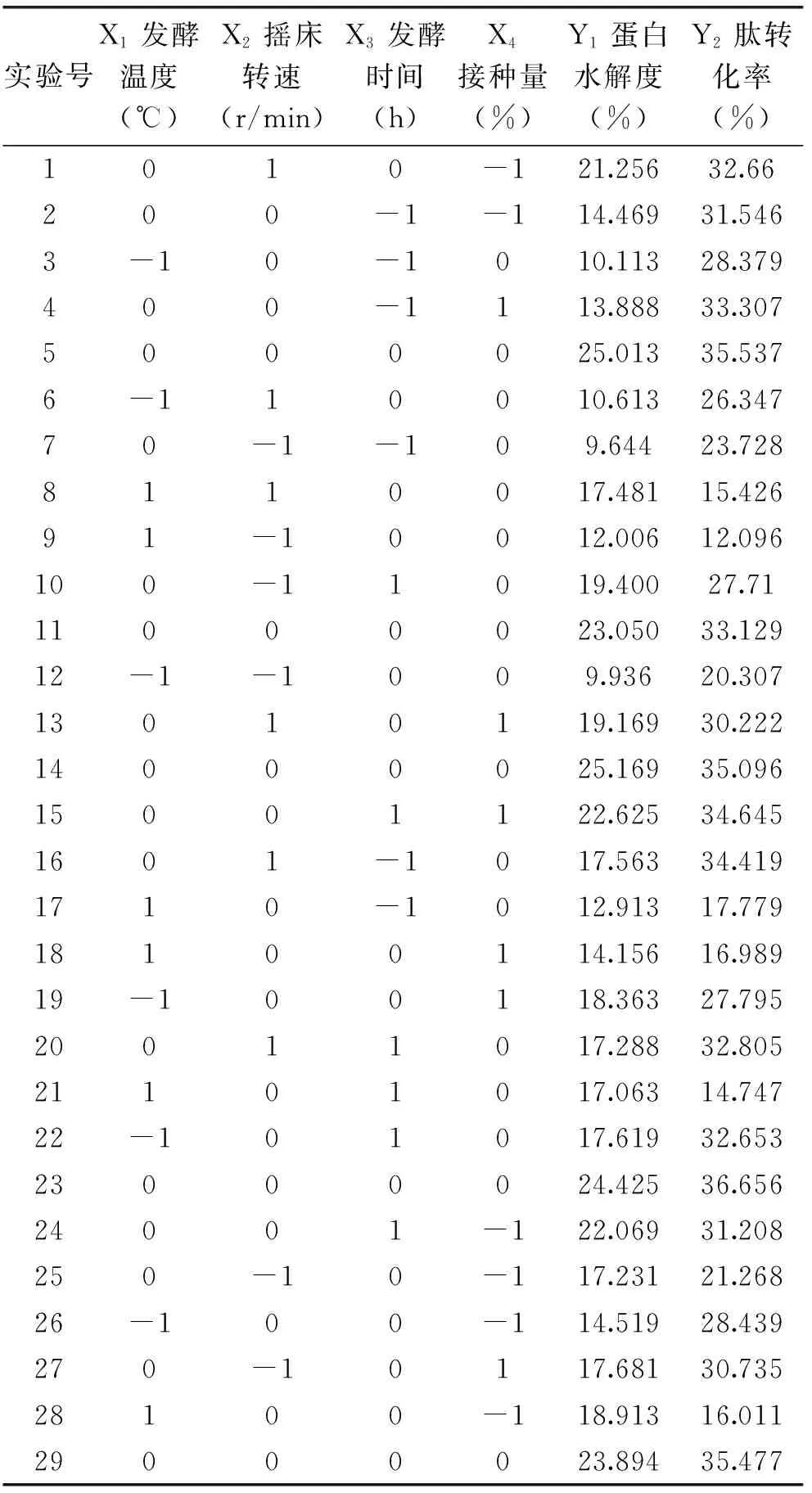
表2 Box-Behnken优化实验结果

表3 二次回归方程Y1的显著性和方差分析
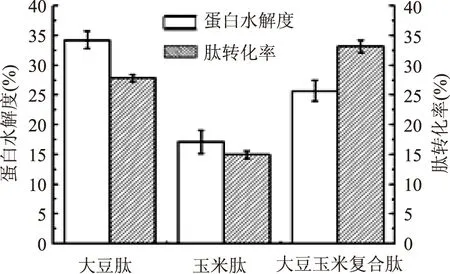
注:*差异显著(0.01 2.3.2 液态发酵工艺的回归模型的建立及显著性检验 应用Design-Expert 8.06软件对实验数据进行多元回归拟合,得蛋白水解度(Y1)、肽转化率(Y2)与发酵温度(X1)、摇床转速(X2)、发酵时间(X3)、接种量(X4)间的二次多项回归方程: Y1=24.31+0.95X1+1.46X2+3.12X3-0.21X4+1.20X1X2-0.84X1X3-2.15X1X4-2.51X2X3-0.63X2X4+0.28X3X4-6.53X12-4.58X22-3.91X32-1.45X42。 Y2=35.18-5.91X1+3.00X2+0.38X3+1.05X4-0.68X1X2-1.83X1X3+0.41X1X4-1.40X2X3-2.98X2X4+0.42X3X4-11.35X12-5.01X22-0.62X32-1.62X42。 回归方程Y1和Y2的显著性及方差分析结果见表3、表4。 影响蛋白水解度的因素中,发酵时间(X3)、摇床转速(X2)、发酵温度(X1)均具显著性(p3<0.0001,p2=0.0025<0.05,p1=0.0316<0.05)。各因素的显著性顺序依次是发酵时间>摇床转速>发酵温度>接种量。发酵温度和接种量(p=0.0074)、摇床转速和发酵时间(p=0.0026)之间存在交互作用,具有显著性。去除不显著项,得二次回归精简模型方程:Y1=24.31+0.95X1+1.46 X2+3.12X3-2.15X1X4-2.51X2X3-6.53X12-4.58X22-3.91X32-1.45X42,Y1方程可预测豆粕和玉米蛋白粉液态发酵的蛋白水解度。 影响肽转化率的因素中,发酵温度(X1)、摇床转速(X2)、接种量(X4)均具显著性(p1<0.0001,p1<0.0001,p4=0.0276<0.05),各因素的显著性顺序依次是发酵温度>摇床转速>接种量>发酵时间。发酵温度和发酵时间(p=0.0266)、摇床转速和接种量(p=0.0012)之间存在交互作用,具有显著性。去除不显著项,得二次回归精简模型方程:Y2=35.18-5.91X1+3.00X2+1.05X4-1.83X1X3-2.98X2X4-11.35X12-5.01X22-1.62X42,Y2方程可预测豆粕和玉米蛋白粉液态发酵的肽转化率。 表4 二次回归模型Y2系数显著性和方差分析 注:*差异显著(0.01 2.3.3 响应面分析 2.3.3.1 不同因素交互作用对蛋白水解度的影响分析 根据回归方程Y1绘制不同因素的交互作用对蛋白水解度有较显著影响的响应面立体分析图,结果见图7、图8。 图7 发酵温度与接种量交互作用对蛋白水解度影响的响应面图Fig.7 Response surface plot of interaction between fermentation temperature and inoculum volume on DH of protein 图8 发酵时间与摇床转速交互作用对蛋白水解度影响的响应面图Fig.8 Response surface plot of interaction between time and shaker speed on DH of protein 由图7中响应面图其曲面弧度变化可知,发酵温度对蛋白水解度的影响较显著(p1=0.0316<0.05),随着发酵温度增大,蛋白水解度增大,达到一定温度后,发酵温度的继续增大使蛋白水解度减小。因其弧度略平,接种量的变化对蛋白水解度的影响不显著(p1=0.5971>0.05)。由图8中响应面图曲面弧度变化可知,摇床转速和发酵时间对蛋白水解度的影响均极显著(p3<0.0001,p2=0.0025<0.05),随着发酵时间延长,蛋白水解度增大,达到一定时间后,蛋白水解度趋平,变化不明显。随着摇床转速的增大,蛋白水解度增大,达到一定转数后,蛋白水解度呈下降趋势。 2.3.3.2 影响肽转化率的不同因素交互作用分析 根据回归方程Y2绘制出对肽转化率影响较显著的不同因素交互作用的响应面立体分析图结果见图9、图10。 图9 发酵温度与发酵时间对复合蛋白肽转化率影响的响应面图Fig.9 Response surface plot of interaction between fermentation temperature and fermentation time on peptide conversion rate 图10 摇床转速与接种量对复合蛋白肽转化率影响的响应面图Fig.10 Response surface plot of interaction between shaker speed and inoculum volume on peptide conversion rate 由图9中响应面图曲面弧度变化可知,发酵温度对肽转化率的影响极显著(p1<0.0001),随着发酵温度增大,肽转化率增大,达到一定温度后,肽转化率下降。发酵时间对肽转化率的影响不显著(p3=0.3821>0.05)。 由图10中响应面图曲面弧度变化可知,摇床转速对肽转化率的影响极显著(p2<0.0001),随着摇床转速增大,肽转化率增大,达到一定转数后,肽转化率变化不显著。接种量对肽转化率的影响较显著(p4=0.0276<0.05),随着接种量的增大,肽转化率增大。 2.4 验证实验 根据响应面分析的最优发酵工艺条件:发酵温度37.83 ℃、摇床转速183.89 r/min,发酵时间50.85 h,接种量3.93%。进行实际修正为发酵温度37 ℃、摇床转速184 r/min、发酵时间51 h、接种量4%。在此条件下,测定的豆粕和玉米蛋白粉的蛋白水解度为25.73%±1.78%,肽转化率为33.23%±1.06%,理论预测蛋白水解度为24.65%,肽转化率32.83%,相对误差分别为4.06%和1.21%,表明枯草芽孢杆菌发酵制备大豆玉米复合肽工艺条件是可行的。 2.5 大豆肽、玉米肽、大豆玉米复合肽比较 大豆肽、玉米肽和大豆玉米复合肽的蛋白水解度和肽转化率的比较,如图11。 图11 大豆肽、玉米肽和大豆玉米复合肽比较Fig.11 Comparison of soybean peptide,corn peptide,soybean and corn composite peptides 由图11可知,大豆玉米复合肽的蛋白水解度和肽转化率均较高,枯草芽孢杆菌可有效发酵豆粕和玉米蛋白粉的复合蛋白,5 g复合蛋白发酵可获得的大豆玉米复合肽含量为0.791 g。 基于豆粕和玉米蛋白粉的配比为2∶1进行响应面优化,以发酵温度、摇床转速、发酵时间和接种量为考察因素,以蛋白水解度和肽转化率为考察指标,影响蛋白水解度的因素显著性依次是发酵时间>摇床转速>发酵温度>接种量;影响肽转化率的因素显著性依次是发酵温度>摇床转速>接种量>发酵时间。获得发酵豆粕和玉米蛋白粉的最优发酵工艺条件为:发酵温度37 ℃、摇床转速184 r/min、发酵时间51 h、接种量4%。通过3次验证实验,测定的豆粕和玉米蛋白粉的蛋白水解度为25.73%±1.78%,肽转化率为33.23%±1.06%,理论预测蛋白水解度为24.65%±1.375%,肽转化率为32.83%±1.475%,蛋白水解度和肽转化率的实际测定值与理论预测值相对误差分别为4.06%、1.21%。因此,枯草芽孢杆菌液态发酵制备大豆玉米复合肽的最佳工艺条件是可行的。 [1]赵新淮,徐红华,姜毓君.食品蛋白质:结构、性质与功能[M].北京:科学出版社,2009,270. [2]朱长生,尹荣华,赵艳平.发酵豆粕营养价值及其在猪生产中的应用[J].饲料研究,2014(3):50-52. [3]潘旭琳,曹龙奎.玉米蛋白粉研究进展[J]. 黑龙江八一农垦大学学报,2013(4):57-61. [4]陈锦瑶,张立实.生物活性肽的安全性评价研究进展[J].毒理学杂志,2013,27(2):142-146. [5] Moller N.P,Scholz-Ahrens KE,Roos N,et al. Bioactive peptides and proteins from foods:indication for health effects[J]. Eur J Nutr,2008,47(4):171-182. [6]张强. 酶解豆粕蛋白制备ACE抑制肽的研究[D].天津:天津商业大学,2012. [7]王莉娟,陶文沂.大豆肽体外抗氧化活性研究[J].生物加工过程,2008,6(4):69-73. [8]Zaelk shin,Yu R,Park Sooah,et al.His-His-Leu,an Angiotensin I Converting Enzyme Inhibitory Peptide Derived from Korean Soybean Paste,Exerts Antihypertensive ActivityinVivol[J]. Agri Food Chem,2001,49(6):3004-3009. [9]昌友权.玉米肽抗疲劳作用的实验研究[J].食品科学,2004,25(9):173-176. [10]朱艳华,谭军. 玉米多肽对大鼠体外抗氧化作用的研究[J].食品科学,2008,29(3):463-465. [11]Yamaguchi M,Nishikiori F,Yoshida M,et al.Water soluble vegetable oligopeptides:comparative study on alcohol metabolism and plasmaaminoacid concentrations in stroke-prone spontaneously hypertensive rats[J]. J Food Biochem,1998,22(3):227-244. [12]王进. 玉米大豆复合肽的特定酶解及其ACE抑制活性研究[D]. 武汉:华中农业大学,2007. [13]付清泉,李天全,万昌秀.几类生物活性肽的研究进展[J]. 医学工程,2002,15(3):227-230. [14]吴泽柱,曹龙奎. 微生物发酵玉米蛋白粉生产玉米肽的研究[D].大庆:黑龙江八一农垦大学,2009. [15]徐艳阳,黄胜男,郑丽. 大豆玉米复配肽的固态发酵工艺优化[J]. 食品科技,2015,40(4):118-127. [16]明强强. 微生物固态发酵花生粕制备抗氧化肽的研究[D]. 山东师范大学,2014. [17]盖梦. 液态发酵法制备燕麦ACE抑制肽的研究[D]. 内蒙古农业大学,2014. [18]杜晶娜,王新宇. 摇床转速对VB12发酵的影响[J]. 河北化工,2009,32(2):47-48. [19]姚小飞,叶璐,赵世敏. 枯草芽孢杆菌的选育及其发酵豆粕的工艺条件研究[J]. 安徽农业科学,2010,38(16):8476-8478. [20]尤新. 玉米深加工技术[M]. 北京:中国轻工业出版社,2008. Optimization on liquid-state fermentation process of composite peptides from soybean and corn proteins ZHU Zhi-hong,XU Yan-yang*,QIU Yang,GUAN Huan-huan,MIAO Bin-bin (College of Biological and Agricultural Engineering,Jilin University,Changchun 130022,China) Soybean and corn gluten meal were mixed as fermentation materials and inoculated with Bacillus subtilis to produce composite peptides from soybean and corn protein. Firstly,effects of fermentation temperature,shaker speed,fermentation time and inoculum volume on degree of hydrolysis(DH)of proteins mixture and conversion rate of peptides were discussed. On the basis of single factor experiments,liquid-state fermentation process conditions of soybean and corn composite peptides were optimized by using four-factor three-level response surface methodology,and corresponding regression models were established. Results showed that proportion of soybean and corn gluten meal was 2∶1 and that optimum fermentation process parameters were as follows:fermentation temperature of 37 ℃,shaker speed of 184 r/min,fermentation time of 51 h,inoculum volume of 4%. Under these liquid-state fermentation conditions,DH of composite proteins was 25.73%±1.78% and peptide conversion rate of 33.23%±1.06%,which was consistent with theoretical prediction values basically. These results contributed to scientific reference for deep manufacture and application of soybean and corn gluten meal. soybean meal;corn gluten meal;liquid-state fermentation;Bacillusnatto;composite peptides from soybean and corn proteins 2015-05-13 朱志红(1988-),女,硕士研究生,主要从事食品营养研究,E-mail:zhuzhihong1234@126.com。 *通讯作者:徐艳阳(1972-),女,博士,副教授,主要从事食品营养与安全研究,E-mail:xuyy@jlu.edu.cn。 吉林大学“挑战杯”大学生课外学术科技作品竞赛资助项目(450060497060);吉林大学本科教学改革研究项目(2013138);吉林省高等教育教学改革研究项目(2014044)。 TS201.1 B 1002-0306(2015)23-0245-08 10.13386/j.issn1002-0306.2015.23.042






3 结论

