表达谷氨酸脱羧酶重组枯草芽孢杆菌的构建及其发酵条件的优化
丁 伟,张明俐,史吉平,柳鹏福,宋礼华
(1.安徽医科大学基础医学院,安徽合肥 230032;2.中国科学院上海高等研究院可持续技术研究中心,上海 201210)
表达谷氨酸脱羧酶重组枯草芽孢杆菌的构建及其发酵条件的优化
丁 伟1,2,张明俐2,史吉平2,柳鹏福2,宋礼华1,*
(1.安徽医科大学基础医学院,安徽合肥 230032;2.中国科学院上海高等研究院可持续技术研究中心,上海 201210)
谷氨酸脱羧酶(GAD)是生物合成γ-氨基丁酸(GABA)的关键酶,本研究通过基因工程构建了一株产GAD的重组枯草芽孢杆菌,并对其产GAD的发酵条件进行优化。分别通过单因素法、正交实验、极差分析和响应面法确定了最佳培养基成分(g/L)及发酵条件为:蔗糖23.5,豆粕10、乙酸铵为8.5、磷酸二氢钾4.1、七水硫酸镁0.5,pH7.0,培养温度37 ℃。在优化条件下GAD酶活达到0.413 U/mL,与优化前的GAD酶活0.143 U/mL相比,酶活提高了188.8%。本研究有助于后续开发枯草杆菌生产γ-氨基丁酸的工艺,以克服现在γ-氨基丁酸生产工艺中,大肠杆菌安全性的问题和乳酸菌成本过高的问题。
谷氨酸脱羧酶,γ-氨基丁酸,重组枯草芽孢杆菌,发酵条件优化
γ-氨基丁酸(gamma-aminobutyric acid,GABA)是一种广泛存在的四碳骨架非蛋白氨基酸[1],具有神经传递、降低血压、利尿、镇定安神等生理作用[2-3],最近的研究还发现GABA可以提高大脑中蛋白质合成的速率[4]、抑制小气道肺部恶性胰腺增生[5]。在食品、化工、饲料、医药等行业都有巨大的应用前景[6]。
当前GABA的生产主要是利用微生物中的谷氨酸脱羧酶(glutamate decarboxylase,GAD,EC4.l.l.15)催化L-谷氨酸生成,谷氨酸脱羧酶广泛存在于各种生物体内,可以催化L-谷氨酸脱去羧基生成GABA和二氧化碳[7],是生物合成γ-氨基丁酸的关键酶。目前对通过GAD催化生产GABA的研究主要集中在乳酸菌(Lacticacidbacteria,LAB)和大肠杆菌(Escherichiacoli)上[8-9],乳酸菌催化生产安全性高,但发酵困难,产量低,成本高。大肠杆菌催化生产GABA研究也比较多,大肠杆菌催化产量高,成本低,但发酵过程容易产生内毒素,有安全隐患。对枯草芽孢杆菌(Bacillussubtilis)GAD转化L-谷氨酸产GABA的研究很少。枯草芽孢杆菌广泛应用在食品生产上,是公认安全(Generally recognized as safe,GRAS)的微生物[10]。有报道将从短乳杆菌(Lactobacillusbrevis)克隆得到的GAD基因片段,构建到大肠杆菌-枯草杆菌穿梭载体pLip上,电转化枯草168得到重组枯草芽孢杆菌[11],该重组菌相对于原始的枯草168,GAD的酶活和GABA转化浓度都得到一定提高,但远远还未达到理想中的结果[12]。
本文从大肠杆菌基因组上扩增得到编码L-谷氨酸脱羧酶的基因gadB,构建了一株高表达GAD的枯草杆菌,然后通过发酵条件的优化,使得发酵酶活提高了188.8%,确定了最佳发酵参数,为利用枯草芽孢杆菌生产GABA奠定了基础。
1 材料和方法
1.1 实验材料
1.1.1 菌株、质粒和主要试剂 枯草芽孢杆菌168,大肠杆菌E.coliDH5α为本实验室保存。枯草杆菌表达载体pHT01购自德国MoBiTec公司。
GABA标品 Sigma公司;其他试剂 均购自国药集团(分析纯)。引物合成和DNA测序 苏州金唯智公司;PCR清洁和质粒抽提试剂盒 Axygen公司;PrimeSTAR酶、连接酶和限制性内切酶 Takara公司。
1.1.2 培养基 液体LB培养基(g/L):蛋白胨10,酵母提取物5,氯化钠10;固体LB培养基(g/L):液体LB中加入1.5%(w/v)的琼脂粉。原始发酵培养基(g/L):葡萄糖20,蛋白胨10,氯化铵5,七水硫酸镁0.49,磷酸二氢钾2,调pH到7.0。
1.2 实验方法
1.2.1 表达载体pHT01-gadB的构建 根据大肠杆菌gadB基因序列(GenBank No:M840251)设计引物:F-gadB-BamHI:CATGGATCCATGGATAAGAA GCAAGTAAC;R-gadB-XbaI:CGATCTAGATCA GGTAGCTTTAAAGCTGTTC,高保真PrimeSTAR酶扩增,gadB片段用BamH I和XbaI双酶切,与双酶切的pHT01载体连接,转化大肠杆菌E.coliDH5α感受态,氨苄抗性平板上挑选阳性转化子。根据质粒pHT01设计引物,F-pHT01:CTTGAAATTGGAAGGG AGATT;R-pHT01:CAACCATTTGTTCCAGGTAAGG,对阳性菌落进行菌落PCR验证测序验证。
1.2.2 重组枯草杆菌168/pHT01-gadB的构建 将测序正确含有gadB基因的穿梭表达载体pHT01-gadB按文献中方法[13],电转化枯草芽孢杆菌168菌株,氯霉素抗性平板上挑选阳性转化子,接LB(氯霉素抗性)培养基37 ℃,200 r/min,12 h培养后,按1%接种量转接原始发酵培养基,37 ℃,200 r/min,5 h后,加IPTG至终浓度0.2 mmol/L诱导,继续培养24 h,按1.2.3所述酶活测定,具有GAD酶活的即为构建的工程菌。
1.2.3 GAD酶活测定 10 mL转化反应体系逐步加入以下物质:取10 mL发酵菌液,10000 r/min,10 min离心收菌体,加20 mmol/L磷酸氢二钠-柠檬酸缓冲液(pH4.2),磷酸吡哆(Pyridoxalphoshate,PLP)0.2 mmol/L,谷氨酸钠0.5 mol/L。温度30 ℃,200 r/min,反应30 min,立即沸水浴10 min,终止其反应。8000 r/min,10 min离心取上清液,计算酶活[14]其中按照文献[15]进行HLPC检测GABA浓度。
酶活力单位定义:反应液中,每分钟催化底物生产1 μmoLγ-氨基丁酸所需要酶量为1个活力单位(U)。
1.2.4 碳氮源单因素筛选 在原始发酵培养基的其他成分和发酵条件不变的情况下,分别选择不同的2%碳源:葡萄糖、可溶性淀粉、甘油、麦芽糖、山梨醇、蔗糖;1%有机氮源:蛋白胨、酵母粉、豆粕、牛肉膏、玉米浆和0.5%氮源:尿素、硫酸铵、氯化铵、乙酸铵、柠檬酸二铵进行发酵培养,然后测定不同碳氮源对酶活和生物量的影响。
1.2.5 二水平正交实验 根据原始发酵培养基选择要考察的6个因素:蔗糖、豆粕、乙酸铵、七水硫酸镁、磷酸二氢钾和起始pH,选择合适正交表进行实验,通过极差大小进行分析,确定最优因素水平组合[16]。
1.2.6 响应面法 根据二水平正交实验分析得到的3个主要因素蔗糖、乙酸铵和磷酸二氢钾,选用Design Expert8.0.6软件,通过RSM中的Box-Behnken设计进行响应面实验设计[17],各因素和水平见表1。

表1 因素与水平(BBD)
2 结果与分析
2.1 枯草芽孢杆菌168/pHT01-gadB的构建
大肠杆菌基因组DNA中PCR扩增得到gadB基因片段电泳检测大小为1400 bp,如图1,成功从大肠杆菌基因组DNA中扩增出了预期大小的片段。用BamH I和XbaI双酶切后,插入同样双酶切的pHT01载体中,随机挑取6个转化子用引物F-pHT01和R-pHT01做菌落PCR鉴定,电泳检测如图2,所扩增的6株菌均成功扩增出了1500 bp左右条带(由于引物设计位于多克隆位点上下游各100 bp左右,因此扩增片段比原插入片段略大),证实gadB基因片段成功插入表达载体中,质粒构建成功。将构建完成的pHT01-gadB质粒电转入枯草168菌株中,得到预期工程菌。

图1 gadB基因PCR片段Fig.1 The PCR fragmen of gadB gene注:M:2000 DNA Marker;1~5为gadB PCR片段。

图2 阳性克隆的菌落PCR鉴定Fig.2 Clony PCR identification of positive colonies M:2000注:DNA Marker;1~4,6、7为菌落PCR;5为对照片段。
2.2 碳源和氮源单因素法筛选结果
分别按照材料与方法中所述选择了碳源、有机氮源和无机氮源,检测了每种条件下的GAD酶活和发酵液OD600,从而判断发酵的生物量,结果如图3所示,确定最佳碳源为蔗糖,最佳的有机氮源为豆粕,最佳的无机氮源为乙酸铵。

图3 不同碳氮源对OD600和GAD酶活的影响Fig.3 The influence of OD600 and GAD activity bydifferent carbon source and nitrogen source
2.3 二水平正交实验结果及分析
二水平正交实验设计、GAD酶活及极差分析的结果见表2。
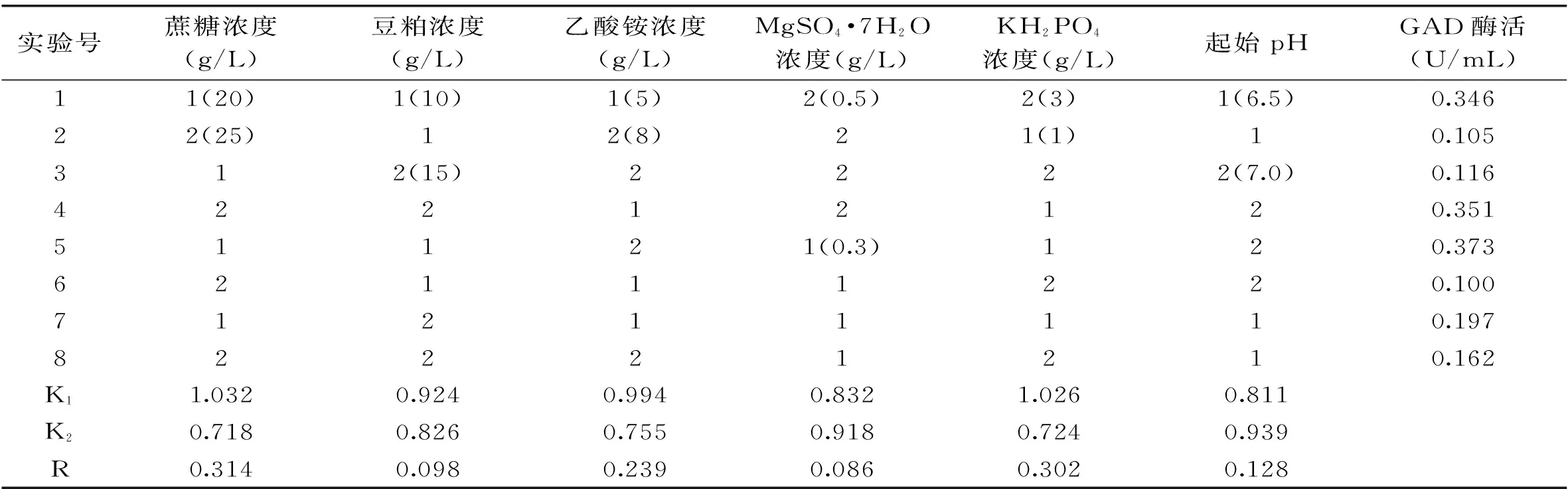
表2 正交试验设计和极差分析
根据极差分析结果,GAD酶活各因子影响顺序为:蔗糖>磷酸氢二钾>乙酸铵>pH>豆粕>七水硫酸镁。同时取豆粕、起始pH与七水硫酸镁选取各自最好的水平上,豆粕浓度为10 g/L,pH为7.0,七水硫酸镁为0.5 g/L。通过响应面法(RSM)重点研究蔗糖、磷酸二氢钾及乙酸铵这三个主要因素。
2.4 响应面法(RSM)
2.4.1 响应面实验设计和结果分析 利用RSM中的Box-Behnken设计(BBD)对蔗糖、磷酸二氢钾、乙酸铵三个因素为自变量,以GAD酶活(U/mL)为响应值,设计三因素三水平的响应面实验,共有17个实验点,每个实验点3个平行。
这17个实验点分为两类:一是中心实验点,该实验点以GAD酶活为响应值,自变量取值为实验设计水平的中间值,中心点实验重复5次,以估计实验误差。二是非中心实验点,共12个。表3为实验及结果。

表3 响应面试验方案及GAD酶活
根据响应面实验结果(表3),利用Design-Expert8.0.6软件对实验结果进行二元多项回归拟合,GAD酶活对蔗糖(A)、磷酸二氢钾(B)和乙酸铵(C)的二元多项回归模拟方程为Y=0.43+0.068A+0.018B+0.017C-0.018AB+0.015AC-4.000×10-3BC-0.098A2-0.12B2-0.12C2。


表4 模型可信度分析
2.4.2 响应面图分析 蔗糖(A)、磷酸二氢钾(B)和乙酸铵(C)三个变量交互作用的等高线和3D响应面图如图4A~图4C,各因子及其交互作用对响应值的影响结果通过图4可以直观反映出来。
图4A表示乙酸铵为8 g/L时,蔗糖含量和磷酸氢二钾含量对GAD酶活的影响,由响应面图知道,蔗糖含量和磷酸氢二钾含量的影响显著,GAD酶活响应值变化明显,曲线陡峭。碳源和磷酸盐维持在适宜水平对GAD酶活十分重要。
图4B表示磷酸二氢钾为4 g/L时,蔗糖含量和乙酸铵含量对GAD酶活的影响,由响应面图知道,蔗糖含量和乙酸铵含量的影响同样显著。磷酸二氢钾含量和乙酸铵含量有着相似的显著影响,维持合适的碳氮比对GAD酶活很重要。
图4C表示蔗糖为20 g/L时,磷酸二氢钾含量和乙酸铵含量对GAD酶活的影响,通过响应面图比较知道,图4C中磷酸二氢钾含量和乙酸铵含量的交互作用与图4A和图4B中的两因素交互作用明显不同,可能是由于磷酸盐离子和乙酸根离子在发酵液中的相互作用,形成缓冲体系,维持发酵液的稳态,对GAD酶活影响更显著。

图4 三个变量交互作用对GAD酶活影响的等高线图和响应面图Fig.4 Contour line and response surface plot between three factors on GAD enzyme activity
2.4.3 发酵条件最优组合及其验证 采用Design-Expert8.0.6软件的Optimization模块对实验结果处理,合理实验水平上,以GAD酶活最高值为指标,得到蔗糖、磷酸二氢钾和乙酸铵三个因素的最佳组合:蔗糖23.48 g/L,磷酸二氢钾4.14 g/L和乙酸铵8.48 g/L,相对的响应面模型预测的最大酶活值0.439 U/mL。
为检验模型预测的准确性,选择发酵培养基中蔗糖为23.5 g/L,磷酸二氢钾为4.1 g/L和乙酸铵为8.5 g/L,其他条件不变。重复实验3次,得到平均酶活为0.413 U/mL,与理论预测值0.439 U/mL的相对误差很小,说明预测准确。
3 结论及讨论
本文在成功构建产谷氨酸脱羧酶(GAD)枯草芽孢杆菌的基础上,对其发酵条件进行优化,确定了最佳培养基(g/L)为:蔗糖23.5,豆粕10、乙酸铵为8.5、磷酸二氢钾4.1、七水硫酸镁0.5,pH7.0,培养温度37 ℃,摇瓶平均GAD酶活为0.413 U/mL,相比于优化前(葡萄糖 20,蛋白胨 10,氯化铵 5,七水硫酸镁 0.49,磷酸二氢钾 2,调pH到7.0)的0.143 U/mL,酶活增加了188.8%。本研究有助于后续开发枯草杆菌生产GABA的工艺,以克服大肠杆菌安全性的问题和乳酸菌成本过高的问题,为工业化发酵生产提供基础。
[1]Li H,Cao Y.Lactic acid bacterial cell factories for gamma-aminobutyric acid[J].Amino Acids,2010,39(5):1107-1116.
[2]Bhargava K P,Bhattacharya S S,Srimal R C. Central cardiovascular actions of GABA[J]. Br. J. Pharmacol,1964,23(2):383-390.
[3]Fenalti G,Law RH,Buckle AM,et al.GABA production by glutamic acid decarboxylase is regulated by a dynamic catalytic loop[J].Nat Struct Mol Biol,2007,14(4):280-286.
[4]Tujioka K,Ohsumi M,Horie K,et al.Dietary gamma-aminobutyric acid affects the brain protein synthesis rate in
ovariectomized female rats[J].J Nutr Sci Vitaminol(Tokyo),2009,55(1):75-80.
[5]Schuller HM,Al-Wadei HAN,et al.Gamma-aminobutyric acid,a potential tumor suppressor for small airway-derived lung a denocarcinoma[J]. Carcinogenesis,2008,29(10):1979-1985.
[6]Shelp BJ,Bown AW,McLean MD.Metabolism and functions of gamma-aminobutyric acid[J].Trends Plant Sci,1999,4(11):446-452.
[7]Zhang Y,Song L,Gao Q,et al.The two-step biotransformation of monosodium glutamate to GABA by Lactobacillus brevis growing and resting cells[J].Appl Microbiol Biotechnol,2012,94(6):1619-1627.
[8]Park SJ,Kim EY,Noh W,et al.Synthesis of nylon 4 from gamma-aminobutyrate(GABA)produced by recombinantEscherichiacoli[J].Bioprocess Biosyst Eng,2013,36(7):885-892.
[9]Hudec J,Kobida L,Canigova M,et al.Production of gamma-aminobutyric acid by microorganisms from different food sources[J].J Sci Food Agric,2015,95(6):1190-1198.
[10]Schallmey M,Singh A,Ward OP.Developments in the use of Bacillus species for industrial production[J].Can J Microbiol,2004,50(1):1-17.
[11]Park KB,Oh SH. Enhancement of gamma-aminobutyric acid production in Chungkukjang by applying aBacillussubtilisstrain expressing glutamate decarboxylase form Lactobacillus brevis[J].Biotechnol Lett,2006,28(18):1459-1436.
[12]Radhika D,Vivek K,Bajpai,et al.Production of GABA(γ-aminobutyric acid)by microorganisms:a review[J].Brazilian Journal of Microbiology,2012,1230-1241.
[13]Rabbain M,Soleymani S,Sadeqhi HM,et al. Inactivation of aprE Gene inBacillussubtilis168 by Homologus Recombination[J]. Avicenna J Med Biotechnol,2014,6(3):185-189.
[14]毕金丽,刘娅,王建平,等.大肠杆菌L-谷氨酸脱羧酶定点突变及其酶学性质初步研究[J].食品工业科技,2014,19:162-167.
[15]谭少云,佘伟鸣,叶放.HPLC法测定脑复清胶囊中γ-氨基丁酸的含量[J].中国新药杂志,2002,11:865-867.
[16]钟环宇,徐建军,江波. 利用响应面分析法优化γ-氨基丁酸发酵培养基[J].无锡轻工大学学报,2004,23(3):19-23.
[17]Aydin B,Raja M.Efficient media for high menaquinone-7 production:response surface methodology approach[J].New Biotechonology,2011,28:1867-1871.
Construction of recombinantBacillussubtilisexpressing glutamate decarboxylase and the optimization of fermentation conditions
DING Wei1,2,ZHANG Ming-li2,SHI Ji-ping2,LIU Peng-fu2,SONG Li-hua1,*
(1.Basic Medical College,Anhui Medical University,Hefei 230032,China;2.Research Center for Sustainable Technology,Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai 201210,China)
Glutamate decarboxylase(GAD)is a key enzyme involved in the biosynthesis ofγ-aminobutyric acid. In this study,a recombinantBacillussubtilisexpressing glutamate decarboxylase was constructed through genetic engineering,and fermentation conditions for production of GAD were optimized by single-factor test,orthogonal test and response surface methodology,and the conditions were as follows,sucrose 23.5,soybean meal 10,ammonium acetate 8.5,potassium dihydrogen phosphate(KH2PO4)4.1,magnesium sulfate heptahydrate(MgSO4·7H2O)0.5,initial pH7.0 and 37℃ of culture temperature. Compared with the initial 0.143 U/mL,GAD activity was incresed by 188.8% and reached 0.413 U/mL under the optimized conditions. This study would contribute to the subsequent development ofγ-aminobutyric acid production process inB.subtilis,for the sake of bypassing the safty issue related toEscherichiacoliand high cost associated with Lactic acid bacteria duringγ-aminobutyric acid production nowadays.
glutamate decarboxylase(GAD);γ-Aminobutyric acid(GABA);recombinantBacillussubtilis;optimization of fermentation conditions
2015-03-25
丁伟(1990-),男,硕士,研究方向:微生物基因工程,E-mail:dingwei2008bengbu@163.com。
*通讯作者:宋礼华(1957-),男,博士,教授,研究方向:生物基因工程,E-mail:songlh@ankebio.com。
TS201.3
A
1002-0306(2015)23-0194-05
10.13386/j.issn1002-0306.2015.23.032

