依赖基质细胞衍生因子-1对心肌梗死血管生成及功能恢复的作用分析
张 鸥
(南阳医学高等专科学校第一附属医院心内科,河南南阳 473058)
依赖基质细胞衍生因子-1对心肌梗死血管生成及功能恢复的作用分析
张 鸥
(南阳医学高等专科学校第一附属医院心内科,河南南阳 473058)
目的 研究依赖基质细胞衍生因子-1(SDF-1)对心肌梗死血管生成及功能恢复的作用。方法 将大鼠随机分成检测组(n=65)和处理组(n=64),其中检测组在心肌梗死前后的1、2、4、7、14、28 d分别随机处死5只大鼠(梗死组),进行SDF-1蛋白水平测定,同时设置5只大鼠为假手术对照。处理组的64只大鼠另随机分成4个小组,每组16只:分别为梗死+SDF-1组、梗死+抗SDF-1组、梗死+生理盐水组、正常+生理盐水组。对各组进行相应处理后,对比心肌梗死后的SDF-1蛋白水平情况,对比各组骨髓间质干细胞(MSCs)归巢量及新生血管的密度水平,对比各组大鼠的心肌缩短分数(EF)和射血分数(FS)变化水平。结果 梗死组的SDF-1水平在1~7 d后显著高于假手术组,并达到峰值水平,随后逐渐下降,在14 d时恢复至正常,差异有统计学意义(P<0.05)。经过SDF-1处理后的组别MSCs归巢量和新生血管的密度水平显著高于其他各组,梗死+抗SDF-1组的水平则明显低于梗死+生理盐水组的水平,差异有统计学意义(均P<0.05)。梗死+SDF-1组大鼠的心功能改善情况显著优于其他各组,差异有统计学意义(P<0.05)。结论 SDF-1可促使心肌梗死血管生成,改善心功能。
心肌梗死;血管生成;功能恢复;基质细胞衍生因子-1;作用分析
急性心肌梗死通常是指因冠状动脉发生急性或持续性的缺血缺氧导致的一种心肌坏死性疾病,通过休息和硝酸酯类药物治疗尚无法完全缓解,同时常并发有心律失常、休克或心力衰竭等症状,危及患者生命[1]。近年来,有报道称,骨髓间质干细胞(MSCs)的移植被认为可改善患者的心脏功能[2]。由于移植的MSCs需要归巢至梗死区方可发挥相应的治疗效果,而依赖基质细胞衍生因子-1(SDF-1)于此过程中常发挥重要作用,鉴于此,本文通过研究SDF-1对于心肌梗死后血管形成及功能恢复的有关作用,旨在为治疗心肌梗死提供相应理论依据,现报道如下。
1 资料与方法
1.1 试剂材料 2013年8月,选择健康雄性的F344大鼠作为研究对象,所有大鼠均购自上海的斯莱克公司,体质量为(240±20)g。胎牛血清和IM-DM培养液均购自Gbico公司。SDF-1购自Peprotech公司,BrdU购自Sigma公司。兔抗大鼠型SDF-1α抗体及绵阳抗大鼠型BrdU抗体均购自US Biological公司。驴抗绵羊型IgG抗体购自Bethyl Laboratories INC公司。兔抗大鼠Ⅷ型抗体及山羊抗兔IgG型抗体均购自北京的中山生物公司。
1.2 方法
1.2.1 MSCs处理 将经乙醚过渡性麻醉死亡的F344大鼠在无菌条件下取其双下肢股骨,以10%的胎牛血清和双抗(100 U/mL的青霉素及100 U/mL的链霉素)IMDM培养液对骨髓腔进行冲洗后得到骨髓,经吸管吹打制成细胞悬液。以1 500 r/min的转速离心约10 min后清除上清液及脂肪,用PBS液将其洗涤2~3次。所得细胞通过上述培养液制成2×109cells/L的培养液。并接种至50 mL的培养瓶内,在温度37 ℃、湿度95%和5%的CO2下培养。于24 h后首次换液,清除未贴壁细胞,而后每隔3~4天换液1次。待细胞有70%~80%的融合后以0.125%的胰蛋白酶在室温下消化约4 min,再以2 000 r/min的转速离心约5 min后弃去上清液,使细胞沉淀经1∶2的比例进行传代,利用此法清除其造血系细胞。细胞在培养21~28 d后可开始移植。将待移植细胞通过3 μmol/L的BrdU实施24 h的培养,之后经PBS重悬制成2×106cells/mL的溶液,放置在冰上待移植。

表1 心肌梗死后的SDF-1蛋白水平情况比较(±s)
a:P<0.05,与假手术组相比。-:此项无数据。
1.2.2 心肌梗死模型的制备 将大鼠经乙醚麻醉后,以100 mg/kg的氯胺酮进行腹腔内注射维持麻醉,并通过ALC-V8呼吸机支持呼吸,利用心电图仪实施心电监测。在其左侧开胸行切口处理,于房室边缘的下方和左心耳和动脉圆锥的交界之处进针,经6-0 Prolene线对左前降支进行缝扎。在结扎后若发现左室前壁丧失原有光泽,并显得苍白,有搏动减弱现象,且心电监测发现ST段和Q波变化,则表明心肌梗死的模型已制作成功。之后观察3~5 min,待循环稳定之后即可关胸并饲养。对非梗死组仅单纯行开胸手术。
1.2.3 研究方法 将大鼠分成检测组(n=65)和处理组(n=64),其中检测组在心肌梗死前后的1、2、4、7、14、28 d分别随机处死5只大鼠(梗死组),进行SDF-1蛋白水平测定,同时设置5只大鼠为假手术对照(假手术组)。处理组的64只大鼠另随机分成4个小组,每组16只,分别为梗死+SDF-1组、梗死+抗SDF-1组、梗死+生理盐水组、正常+生理盐水组。在心肌梗死的模型建立的4 d后,梗死+SDF-1组在心肌梗死区和四周5个区域内各注入400 ng/mL的重组SDF-1 10 μL,梗死+抗SDF-1组通过尾静脉注入2 μg/mL的SDF-1抗体约1 mL,梗死+生理盐水组在心肌梗死区和四周5个区域内各注入10 μL的生理盐水。正常+生理盐水组在心肌梗死区和四周5个区域内各注入10 μL的生理盐水。各组在1 h后即可将已标记的MSCs(5×106Cells)通过尾静脉注入。在干细胞移植72 h之后,对每组选择8只大鼠,经50 mg/kg的戊巴比妥钠麻醉之后,通过主动脉注射10%的氯化钾溶液2 mL,让心脏在舒张期停搏。余下的大鼠饲养4周之后以同样方法处死。并在处死后开胸取心脏。
1.2.4 SDF-1蛋白水平测定 以4%的多聚甲醛磷酸盐液对心脏固定,并行脱水和石蜡包埋处理,以4 μm厚并间隔100 μm行长轴垂直切片,依照试剂盒的说明书操作。以Imagepro Plus 5.0系统选取梗死区和四周10个200倍的视野,检测SDF-1的阳性面积(即PA)和累积光密度(IOD),有关结果通过平均光密度值(即MOD)加以表示。其中MOD=IOD/PA。
1.2.5 BrdU阳性细胞检测 切片方法同上,实施BrdU标记MSCs免疫组织化学染色。随机抽选梗死区和四周10个200倍的视野,统计各视野中细胞核BrdU呈阳性的MSCs均数。
1.2.6 血管密度测定 切片方法同上,经免疫组织化学测定Ⅷ因子的表达,随机抽选梗死区和四周10个200倍的视野,统计各视野中血管数目均数。
1.2.7 心功能检测[3]在梗死模型完成建立之前和细胞移植之前,以及移植后的28 d经过SONOS 5500型超声心动图仪测定心肌的缩短分数(FS)及射血分数(EF),探头为11.5 MHz。全部指标检测3个心动周期,并选择平均值。在检查之前以50 mg/kg的氯胺酮进行药物镇静。

2 结 果
2.1 心肌梗死后的SDF-1蛋白水平比较 梗死组的SDF-1蛋白水平在1~7 d后显著高于假手术组,并达到峰值水平,随后逐渐下降,在14 d时恢复至正常,差异有统计学意义(P<0.05),见表1。
2.2 各组MSCs归巢量及新生血管的密度水平比较 经过SDF-1处理后的组别MSCs归巢量和新生血管的密度水平显著高于其他各组,梗死+抗SDF-1组的水平则明显低于梗死+生理盐水组的水平,差异有统计学意义(均P<0.05)。正常+生理盐水组的大鼠仅有少量MSCs归巢量及新生血管的密度,见表2。

表2 各组MSCs归巢量及新生血管的密度水平对比(±s,个/HP)
a:P<0.05,与正常+生理盐水组比较;b:P<0.05,与梗死+生理盐水组比较;c:P<0.05,与梗死+抗SDF-1组比较。
2.3 各组大鼠的EF和FS变化水平比较 梗死+SDF-1组的大鼠的心功能改善情况显著优于其他各组,差异有统计学意义(P<0.05)。梗死+抗SDF-1组的心功能较梗死+生理盐水组更差,但差异无统计学意义(P>0.05)。正常+生理盐水组的心功能情况变化不大,见表3。
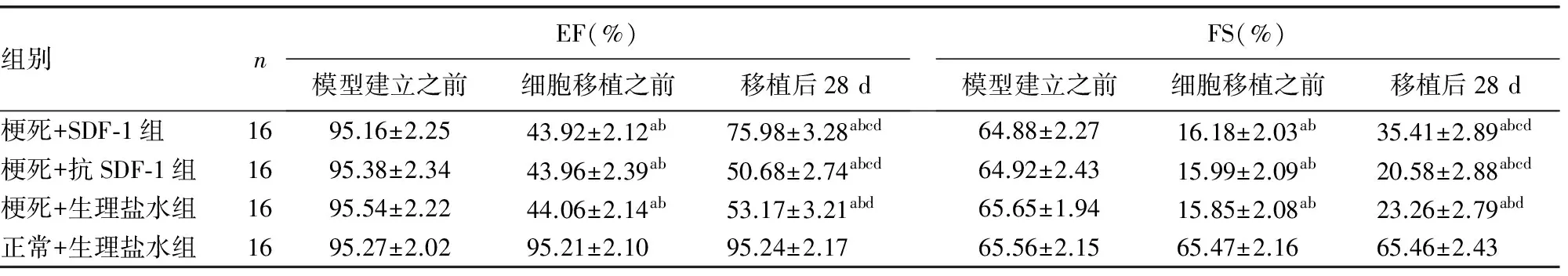
表3 各组大鼠的EF和FS变化水平比较
a:P<0.05,与模型建立之前相比;b:P<0.05,与正常+生理盐水组相比;c:P<0.05,与梗死+SDF-1组相比;d:P<0.05,与细胞移植前相比。
3 讨 论
在临床上,对于缺血型心脏病,通过干细胞移植疗法逐渐成为新型选择,有报道称[4],干细胞移植本身就拥有多类细胞亚型以及移植方法供选,然而均涉及一个核心问题,即进行移植之后的干细胞是否可归巢至目标组织内,由于这和干细胞特点以及各类细胞因子在机体中的表达有关,因此,对其展开研究显得十分必要。SDF-1是一种CXC趋化因子,其水平在心肌梗死之后的早期表达显著上升,通常在造血干细胞的表面进行表达,惟一受体则是CXCR4。Das Roy等[5]报道称,SDF-1可以有效促使形成CXCR4的CD34+细胞发生迁徙和归巢。而张晓慧等[6]在体外实验中发现,对于MSCs转染相应的CXCR4基因,可增大MSCs表层CXCR4水平的表达,同时可增大SDF-1对于MSCs产生的趋化作用。由此可知SDF-1对于心肌梗死的治疗具有一定的积极意义。
本研究发现,梗死组的SDF-1蛋白水平在1~7 d后显著高于假手术组,并达到峰值水平,但在14 d时恢复至正常。表明心肌梗死之后的SDF-1蛋白水平表达有时间窗,在治疗时可充分利用此时间窗。国外Gong等[7]通过在Lewis大鼠体内发现了SDF-1蛋白水平表达恢复至正常的时间是心肌梗死之后的56 d,同时,梗死区细胞重建SDF-1表达之后促使CD117+干细胞逐渐归巢至梗死心肌内。本次研究还发现,经过SDF-1处理后的组别MSCs归巢量和新生血管的密度水平显著高于其他各组,EF、FS等心功能指标亦有较大改善,但梗死+抗SDF-1组的水平则明显低于梗死+生理盐水组的水平。正常+生理盐水组的大鼠仅有少量MSCs归巢量及新生血管的密度被发现。表明心肌梗死之后输注外源性的SDF-1能够较好地促使MSCs归巢,同时亦可改善心功能[8]。注射有SDF-1抗体的组别中,MSCs归巢量和血管生成虽然有所增加,却不如仅注入生理盐水的组别,表明促使MSCs归巢的相关因子可能并不单一,除SDF-1外还有其他的类似因子,或注射抗体并不能完整阻断SDF-1趋化效果[9]。分析造成上述结果的原因,作者认为这可能是因为SDF-1能够增加机体组织中内皮前体细胞的数目和血管形成。而输注SDF-1能够导致更多外周血干细胞逐渐归巢到损伤部位,进而使到达机体局部的有关干细胞和缺血后水平增大的血管内皮生长因子(VEGF),以及SDF-1发生相互作用,产生出利于血管生成及心肌再生的作用,最终对机体功能恢复具有较大的促进作用[10]。作者在研究中还发现,MSCs数量越多,则心肌内新生血管密度也越高,符合Mierzejewska等[11]的报道结果,再次证实归巢至梗死区且移植的MSCs可促使血管新生,增大梗死区和四周区域内血供,抑制了梗死之后心肌细胞的进行性凋亡,促进心肌重构,最终改善心功能。此外,在实验中还可观察发现心脏周围的炎症粘连组织内含BrdU+细胞,且新生血管亦较多,表明炎性反应可能并非单纯趋化相应的炎症细胞,同时对于MSCs亦有损害作用,而炎性反应之后形成的细胞因子对于移植的MSCs亦有一定的趋化作用,这就解释了为何正常组大鼠心肌内能够被检测到MSCs[12-13]。还可提示通过MSCs移植与炎症调节性治疗方案联合治疗具有可行性。
[1]侯传举,齐岩梅,张端珍,等.物理损伤与基质细胞衍生因子-1α对大鼠心肌细胞增殖和细胞因子表达的影响[J].中华生物医学工程杂志,2012,18(6):431-436.
[2]刘俊,李海清,汪昊喆,等.17β-雌二醇对骨髓源性内皮祖细胞归巢的影响[J].中华实验外科杂志,2011,28(11):1872.
[3]Zgraggen S,Huggenberger R,Kerl K,et al.An important role of the SDF-1/CXCR4 axis in chronic skin inflammation[J].PLoS One,2014,9(4):665-667.
[4]李强,张红闯,郭艳萍,等.基质细胞衍生因子-1通过CXC趋化因子受体-4、CXC趋化因子受体-7提高脂肪干细胞促血管新生能力[J].中华实验外科杂志,2014,31(2):407.
[5]Das Roy L,Sahraei M,Schettini JL,et al.Systemic neutralization of IL-17A significantly reduces breast cancer associated metastasis in arthritic mice by reducing CXCL12/SDF-1 expression in the metastatic niches[J].BMC Cancer,2014,14(1):225-227.
[6]张晓慧,孙谕,王子妍,等.骨髓间充质干细胞与多发性骨髓瘤细胞共培养后CX43表达及SDF-1α分泌水平的变化及其意义[J].中华血液学杂志,2013,34(9):788-793.
[7]Gong J,Meng HB,Hua J,et al.The SDF-1/CXCR4 axis regulates migration of transplanted bone marrow mesenchymal stem cells towards the pancreas in rats with acute pancreatitis[J].Mol Med Rep,2014,9(5):1575-1582.
[8]黄荣,马根山,潘啸东,等.基质细胞衍生因子-1α对小鼠心脏干细胞凋亡的影响及其机制[J].中华心血管病杂志,2013,41(10):870-875.
[9]Dalonneau F,Liu XQ,Sadir R,et al.The effect of delivering the chemokine SDF-1 alpha in a matrix-bound manner on myogenesis[J].Biomaterials,2014,35(15):4525-4535.
[10]胡荣林,黄庆,杨学伟,等.转化生长因子β1协同基质细胞衍生因子1通过抑制β连环素活性影响肝卵圆细胞增殖[J].中华外科杂志,2013,51(5):442-446.
[11]Mierzejewska K,Klyachkin YM,Ratajczak JA,et al.Sphingosine-1-phosphate-mediated mobilization of hematopoietic stem/progenitor cells during intravascular hemolysis requires attenuation of SDF-1-CXCR4 retention signaling in bone marrow[J].Biomed Res Int,2013,2(1):549-550.
[12]何志承,杨万章,向云,等.基质细胞衍生因子-1及其受体CXCR4轴在内源性神经干细胞治疗脑梗死中的作用[J/CD].中华脑科疾病与康复杂志:电子版,2013,3(3):200-203.
[13]祖蓓蓓,刘琳,饶咏梅,等.系统性红斑狼疮患者外周血中趋化因子基质细胞衍生因子-1α及其受体CXC趋化因子受体4的检测及其临床意义[J].中华风湿病学杂志,2013,17(12):828-832.
Analysis on role of dependence of stromal cell derived factor-1 on myocardial infarction angiogenesis and function recovery
ZhangOu
(DepartmentofInternalMedicineCardiovascular,FirstAffiliatedHospitalofNanyangMedicalCollege,Nanyang,Henan473058,China)
Objective To study the role of dependence of stromal cell derived factor-1(SDF-1) on myocardial infarction angiogenesis and function recovery.Methods The rats were randomly divided into the test group (65 cases) and the treatment group (64 cases),in which 5 rats in the test group were randomly killed on 1,2,4,7,14,28 d before and after myocardial infarction(infarction group) and the SDF-1 protein level was detected.At the same time the sham operation group(5 cases) was set up;64 rats in the treatment group were randomly divided into four groups,16 cases in each group,which were infarction+SDF-1 group,infarct+anti-SDF-1 group,infarct+normal saline group and normal+normal saline group.After the corresponding processing in each group,the SDF-1 levels after myocardial infarction,MSCs homing amount,neovascularization density,EF and FS levels were compared among various groups.Results The SDF-1 level after 1-7 d in the infarction group was significantly higher than that in the sham operation group,and reached a peak level,then decreased gradually and restored to normal on 14 d,the difference was statistically significant (P<0.05).The MSCs homing amount and neovascularization density level in the SDF-1 treatment groups were significantly higher than those in other groups,which in the infarction+anti-SDF-1 group were significantly lower than those in the infarction+normal saline group,the differences were statistically significant (allP<0.05).The cardiac function improvement situation in the infarction +SDF-1 group was significantly better than that in other groups,the difference was statistically significant (P<0.05).Conclusion SDF-1 can promote angiogenesis in myocardial infarction,also improve the heart function.
myocardial infarction;angiogenesis;functional recovery;stromal cell derived factor-1;effect analysis
张鸥(1974-),博士,副主任医师,主要从事心内科危急重症处理工作。
·基础研究
10.3969/j.issn.1671-8348.2015.14.004
R542.2+2
A
1671-8348(2015)14-1882-03
2015-01-07
2015-03-04)

