慢病毒载体介导CGRP基因体外转染及对MSC生物学特性的影响
陈攀科,石 蓓,许官学,刘志江,龙仙萍,张 巍,马 帅
(遵义医学院附属医院心血管内科,贵州遵义 563000)
慢病毒载体介导CGRP基因体外转染及对MSC生物学特性的影响
陈攀科,石 蓓△,许官学,刘志江,龙仙萍,张 巍,马 帅
(遵义医学院附属医院心血管内科,贵州遵义 563000)
目的 探讨慢病毒载体介导降钙素基因相关肽(CGRP)基因体外转染间充质干细胞(MSC)及其对MSC生物学特性的影响。方法 大鼠MSC进行分离、培养及鉴定。CGRP重组慢病毒转染MSC后,采用荧光显微镜和流式细胞技术测定其转染率。实时定量PCR、免疫荧光细胞化学及ELISA法检测MSC中CGRP的表达。慢病毒转染后通过MTT、β-半乳糖苷酶染色和诱导分化评价MSC的增殖、衰老及分化能力。结果 慢病毒载体介导CGRP基因转染MSC后48 h可稳定表达,MOI=30时,转染率达80%以上。与MSC组和空载病毒转染(MSC-EGFP组)比较,CGRP修饰的MSC(MSC-CGRP组)中CGRP的mRNA和蛋白表达水平增高(均P<0.01)。MTT、β-半乳糖苷酶染色和诱导分化结果显示,病毒转染后对MSC增殖、衰老及向内皮分化基本没有影响。结论 MSC是一种理想的基因载体细胞,可作为CGRP基因转染的靶细胞用于基因治疗,为后续体内、体外实验奠定基础。
降钙素基因相关肽;转染;间充质干细胞;生物学特性
本研究小组前期的研究显示,骨髓间充质干细胞(MSC)移植能在一定程度上促进损伤动脉内皮的修复,但其对血管平滑肌细胞(VSMC)的影响较小[1-2]。降钙素基因相关肽(CGRP)具有抑制VSMC增殖的作用,但CGRP在外周血的半衰期很短,需要通过合适的载体和靶细胞将其带入体内来持续发挥作用[3]。因此,本研究旨在研讨慢病毒载体介导CGRP基因体外转染MSC后,CGRP的表达及对MSC生物学特性的影响,为进一步在细胞和动物模型中的研究奠定基础。
1 材料与方法
1.1 主要试剂与材料 雄性SD大鼠购自重庆第三军医大学动物实验中心。慢病毒载体Lv-EGFP和Lv-CGRP由上海英为信公司提供;CGRP引物由上海英为信公司合成。所用的抗体均购自美国Abcam 公司。ELISA试剂盒购自美国Biosciences公司。MTT购自美国Promega公司。细胞衰老特异性检测试剂盒购自上海杰美基因有限公司。
1.2 方法
1.2.1 MSC的培养和鉴定 SD大鼠(100 g左右)脱臼处死后,无菌条件下获取骨髓,离心纯化并获取MSC。MSC在10%胎牛血清的完全培养基中培养,每2~3天换液,弃悬浮细胞,细胞铺满瓶底约90%后传代,第2~4代细胞用于实验;取第3代细胞通过流式细胞术检测MSC表面标记物(CD29 和CD45)来鉴定,分别加入各自IgG作为对照。
1.2.2 MSC基因修饰和转染 空载病毒转染MSC设为MSC-EGFP,CGRP重组慢病毒转染设为MSC-CGRP。荧光显微镜初步评估转染效率和最佳感染复数,进而用流式细胞术进一步证实。
1.2.3 实时定量PCR检测 检测上述最佳感染复数下MSC中CGRP的mRNA表达水平。按RNA抽提试剂盒操作说明,提取每一克隆的总RNA。通过逆转录酶行逆转录和按SYBR Green 混合试剂盒说明书进行cDNA扩增。CGRP基因用特殊的低聚核苷酸引物,并以大鼠18S-QP基因作为内参对照。PCR引物序列如下,CGRP:5′-AGC CCC AGA TCT AAG CGG TGT G-3′ and 5′-TCC TTG GCC ATA TCC CTT TTC TTG-3′;18S:5′-AAA CGG CTA CCA CAT CCA AG-3′ and 5′-CCT CCA ATG GAT CCT CGT TA-3′。数据通过Ct比较法进行分析、定量(2-△△Ct)。
1.2.4 免疫荧光细胞化学(ICC)法 通过ICC法检测上述最佳感染复数下MSC中CGRP蛋白的表达。细胞爬片,多聚甲醛固定,0.3% Triton 破膜,山羊血清封闭,兔抗大鼠CGRP一抗4 ℃孵育过夜,用1∶100驴抗兔IgG-TRITC二抗37 ℃孵育 1 h,然后DAPI复染细胞核3~5 min,抗荧光淬灭剂封,激光共聚焦显微镜(LSCM)下拍照并定性分析。
1.2.5 ELISA 通过ELISA试剂盒检测被转染MSC上清中CGRP蛋白水平。取P3 MSC细胞按(0.5~1.0)×106个/孔的细胞密度接种于6孔板中,CGRP重组慢病毒按上述最佳转染复数转染MSC 48 h后,继续培养48 h,收集上清液,然后根据ELISA试剂盒说明书方法检测上清液中CGRP的蛋白水平(n=3)。
1.2.6 MTT检测 实验分MSC-CGRP组、MSC-EGFP组和对照组(MSC组)。取P3 MSC按(0.5~1.0)×104个/孔接种于96孔板中,细胞贴壁后按MOI=30进行病毒转染,每天各取3组(每组6孔)行MTT检测,通过紫外分光光度计(波长490 nm)进行比色,测定光密度(OD)值。
1.2.7 β-半乳糖苷酶检测法 分组同上,病毒转染后均按正常细胞培养,传至P5,将(1.0~2.0)×103个/孔细胞接种于6孔板中(即接种细胞为P6),培养48 h后,按试剂盒操作说明书进行染色。镜下观察衰老细胞(蓝染细胞)并根据公式[蓝染率=染色阳性细胞/总细胞数×100%(每孔观察3个视野,n=3)]计算衰老率。
1.2.8 病毒转染对诱导分化的影响 分组同上,病毒转染后予培养基(含血管内皮生长因子10 ng/mL、成纤维细胞生长因子β 5 ng/mL)连续培养14 d,收集细胞分别行流式细胞技术检测CD29、CD31的表达。

2 结 果
2.1 MSC的形态及表型特征 原代细胞培养至第4天可见小集落形成,并相互交联,7 d左右满瓶底,形态呈长梭型,漩涡状排列,每3~4天传代1次,传至第5代细胞形态未见明显改变(图1A);流式细胞术检测第3代MSC表面标记,结果显示,CD29达98.05%,而CD45为 3.74%(图1B),符合MSC的生物学特征。
2.2 CGRP基因体外转染MSC的效率 慢病毒载体介导(MOI=30)转染MSC后,通过明暗视野对比,转染率达80%以上(图2A),流式细胞术证实转染率为83.16%(图2B)。
2.3 CGRP修饰MSC中CGRP的表达 实时定量PCR检测CGRP修饰MSC后CGRP的mRNA表达水平,结果显示,与MSC组(1.00±0.12)、MSC-EGFP组(1.12±0.24)相比,MSC-CGRP组(9.85±0.28)表达明显增加,差异有统计学意义(P<0.01)。ICC法检测MSC中CGRP蛋白的表达,结果显示,CGRP修饰MSC中可见CGRP阳性表达,且表达部位位于细胞胞质中(图3)。ELISA检测其蛋白分泌水平,结果显示,培养48 h后与MSC组和MSC-EGFP组的上清液中几乎无CGRP表达,而MSC-CGRP组中水平为25.30 pg CGRP/5×105个细胞/mL,与前两组相比,差异有统计学意义(P<0.01)。
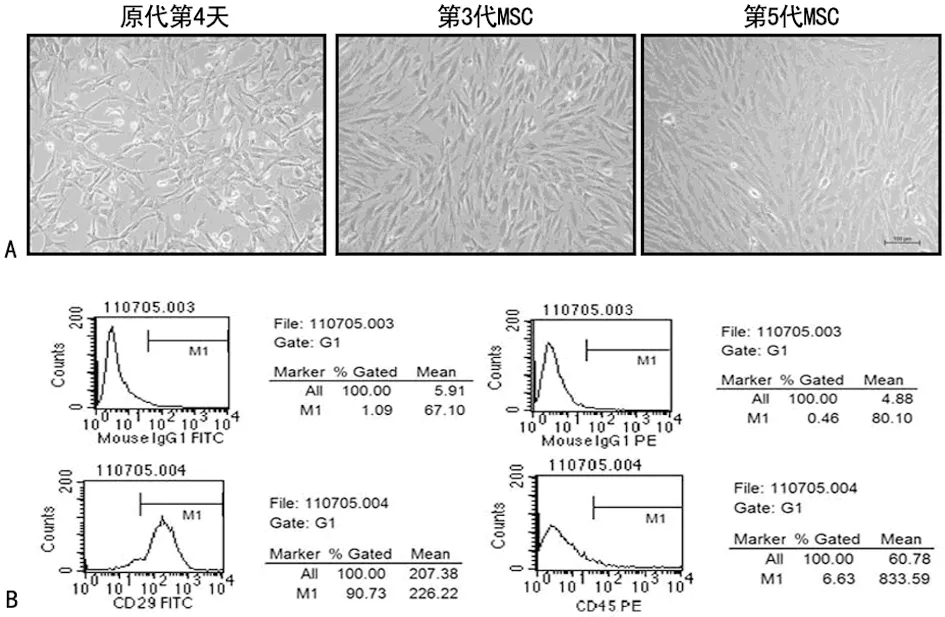
A:MSC传代过程中的形态学变化;B:流式细胞术鉴定第3代MSC表面标记CD29和CD45表达。
图1 MSC形态和表型特征
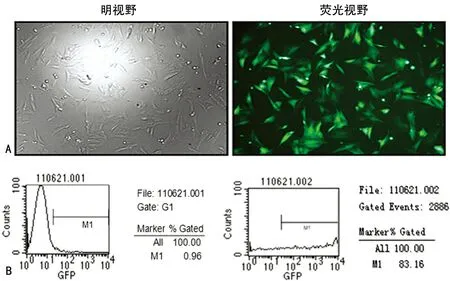
A:转染48 h后明暗视野对比;B:流式细胞术检测转染率。

图2 CGRP重组慢病毒在MSC中的转染效率
a:P>0.05,与MSC组和MSC-EGFP组比较。
2.4 慢病毒载体转染对MSC增殖的影响 通过MTT法检测MSC组、MSC-EGFP组和MSC-CGRP组中VSMC的OD值,连续观察6 d,结果显示,在同一时间点,各组间相比差异无统计学意义(P>0.05)。见表1。
2.5 慢病毒载体转染对MSC衰老的影响 通过β-半乳糖苷酶染色检测各组细胞的衰老率,按公式计算各组衰老率,MSC组[(32.83±4.91)%]、MSC-EGFP组[(34.67±6.31)%]及MSC-CGRP组[(31.67±4.97)%]组间比较差异无统计学意义(P>0.05)。
2.6 慢病毒载体转染对MSC分化的影响 通过流式细胞术检测CD31的表达来判断各组MSC向内皮分化的能力,结果显示,转染CGRP对MSC向内皮分化没有影响。见图4。

图3 ICC法检测CGRP修饰MSC后CGRP的蛋白表达
3 讨 论
近来研究显示,MSC移植治疗心血管疾病是目前基础和临床研究的热点[4-5]。MSC不仅具有不断自我更新、多向分化潜能,还具有免疫耐受性,并且易于外源基因的转染和表达而其多功能性不受影响等特点[6]。目前已有研究表明,体外培养的MSC可向心肌和血管内皮等细胞分化,使其广泛用于基础研究中的新生血管化和促进血管生成[7-8];同时,在损伤心脏模型中移植MSC,发现能促进心功能的恢复和血管生成,使其可能成为心血管修复的理想细胞群[9]。本研究小组先前的研究结果也显示,MSC体内移植在一定程度上能促进损伤动脉内皮的修复,从而抑制新生内膜的形成、减轻术后血管内狭窄的程度,但其对VSMC的影响相对较小[1-2]。
CGRP是神经肽家族的一种的血管活性肽,广泛分布于神经及心血管系统,主要由感觉神经合成与分泌,具有多种生理功能,参与各种生理、病理过程,包括抑制炎症、细胞增殖等,是目前体内最强的内源性扩血管肽之一[10]。在心血管系统,CGRP具有多种生物活性,如强大的扩血管作用、抑制VSMC增殖、保护内皮细胞,以及参与血管新生等作用[11-12]。但CGRP在外周血的半衰期很短,直接注入体内是很难持续发挥作用的,故需要通过合适的载体和靶细胞将其带入体内来发挥作用。对此,本研究旨在研讨慢病毒载体介导CGRP基因体外转染MSC后,CGRP的表达及对MSC生物学特性的影响。
本实验首先通过荧光显微镜和流式细胞技术证实,慢病毒载体介导CGRP能成功转染MSC,且当MOI为30时转染率达80%以上。那么被慢病毒载体成功转染的MSC是否表达CGRP呢?为了回答上述问题,本实验从mRNA水平和蛋白水平两个方面进行验证。mRNA水平上,实时定量PCR检测结果显示,MSC自身即有少量CGRP的表达,且病毒转染对其无明显影响,而慢病毒载体介导CGRP基因转染后的MSC,其CGRP表达量通过2-△△CT计算后[13],是MSC-EGFP组和MSC组的9.85倍(P<0.01)。在蛋白水平上,通过多重ICC法结果发现,与MSC组和MSC-EGFP组相比,MSC-CGRP组中存在CGRP蛋白的表达,其表达部位位于细胞质;进而ELISA检测结果证实,CGRP修饰的MSC能分泌CGRP,其水平为25.30 pg CGRP/5×105个细胞/mL,与MSC组和MSC-EGFP组相比,差异有统计学意义(P<0.01)。由此说明CGRP修饰的MSC中高表达CGRP且能分泌CGRP蛋白。但病毒转染是否对MSC的生物学特性有影响呢?
对此,本实验使用MTT和β半乳糖苷酶染色法测定各组MSC的存活率,以MSC组为对照,结果发现MSC-EGFP组和MSC-CGRP组两组细胞增殖和衰老水平均无明显差异,说明转染CGRP基因后的MSC仍具有其基本的生物活性,细胞存活率及生长未受到抑制。虽然既往有文献报道,外源性CGRP对MSC增殖有促进作用,且能促进MSC的DNA合成和有丝分裂,但本实验通过MTT法连续观察6 d并未发现转染CGRP基因组的MSCs增殖能力有所增加,这可能与CGRP基因通过慢病毒已整合到MSC中,并成为其中一部分的有关[14]。对CGRP基因修饰的MSC予血管内皮生长因子、成纤维细胞生长因子β诱导分化后发现,CD31的表达较对照明显升高,CD31为内皮细胞的特异性标志,这说明转染后的MSC仍具有向内皮分化的能力。
综上所述,慢病毒载体介导CGRP基因能成功转染MSC,转染的MSC稳定高表达CGRP且能分泌CGRP蛋白;转染对MSC增殖、分化等生物学特性无明显影响。由此可知,MSC是一种理想的基因载体细胞,为CGRP基因转染MSC后续的体内、体外实验奠定了基础。
[1]石蓓,郭艳,王正龙,等.缺氧预处理外周间充质干细胞对兔血管成形术后再狭窄的影响[J].中国病理生理杂志,2009,25(9):1686-1691.
[2]石蓓,赵然尊,许官学,等.重组人粒细胞集落刺激因子对兔颈动脉粥样硬化球囊损伤后再内皮化和内膜增生的影响[J].中华心血管病杂志,2009,37(5):441-444.
[3]王钊,金丹,陀永华,等.降钙素基因相关肽促进大鼠BMSCs迁移及VEGF的表达[J].中国修复重建外科杂志,2011,25(11):1371-1376.
[4]Wang T,Tang WC,Sun SJ,et al.Mesenchymal stem cells improve outcomes of cardiopulmonary resuscitation in myocardial infarcted rats[J].J Mol Cell Cardiol,2009,46(3):378-384.
[5]Lu G,Haider HK,Jiang SJ,et al.Sca-1(+) stem cell survival and engraftment in the infarcted heart dual role for Preconditioning-Induced connexin-43[J].Circulation,2009,119(19):2507-2587.
[6]Phillips MI,Tang YL.Genetic modification of stem cells for transplantation[J].Adv Drug Deliv Rev,2008,60(2):160-172.
[7]Zhao YL,Zhang S,Zhou JY,et al.The development of a tissue-engineered artery using decellularized scaffold and autologous ovine mesenchymal stem cells[J].Biomaterials,2010,31(2):296-307.
[8]Zhang ZY,Teoh SH,Chong MS,et al.Neo-vascularization and bone formation mediated by fetal mesenchymal stem cell tissue-engineered bone grafts in critical-size femoral defects[J].Biomaterials,2010,31(4):608-620.
[9]Psaltis PJ,Zannettino AC,Worthley SG,et al.Concise review:mesenchymal stromal cells:potential for cardiovascular repair[J].Stem Cells,2008,26(9):2201-2210.[10]Vause CV,Durham PL.Calcitonin gene-related peptide differentially regulates gene and protein expression in trigeminal glia cells:Findings from array analysis[J].Neurosci Lett,2010,473(3):163-167.
[11]Deng WW,St Hilaire RC,Chattergoon NN,et al.Inhibition of vascular smooth muscle cell proliferation in vitro by genetically engineered marrow stromal cells secreting calcitonin gene-related peptide[J].Life Sci,2006,78(16):1830-1838.[12]Bullen ML,Miller AA,Andrews KL,et al.Nitroxyl (HNO) as a vasoprotective signaling molecule[J].Antioxid Redox Signal,2011,14(9):1675-1686.
[13]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(T)(-Delta Delta C) method[J].Methods,2001,25(4):402-408.
[14]徐格,许建中,周强,等.CGRP对人骨髓间充质干细胞增殖影响的研究[J].华南国防医学杂志,2008,(2):21-24.
Lentiviral vector mediated CGRP gene in vitro transfection and its effects on biological properties of MSC*
ChenPanke,ShiBei△,XuGuanxue,LiuZhijiang,LongXianping,ZhangWei,MaShuai
(DepartmentofCardiology,AffiliatedHospitalofZunyiMedicalCollege,Zunyi,Guizhou563000,China)
Objective To explore in vitro mesenchymal stem cell (MSC) transfection of lentiviral vector mediated calcitonin gene-related peptide(CGRP) gene and its effects on biological properties of MSC.Methods MSC were isolated,cultured and identified.MSC were infected by lentivirus encoding recombinant enhanced green fluorescent protein (EGFP) gene and CGRP (Lv-EGFP-CGRP).The transfection efficiency was determined by the inverted fluorescence microscope and flow cytometry.The expression levels of CGRP were detected in CGRP-modified MSC by using real-time PCR,immunocytochemistry and enzyme-linked immunosorbent assay (ELISA).The proliferation,aging and differentiation ability of MSC were evaluated by MTT,β-galactosidase staining and inducing differentiation respectively.Results After 48 h of MSC transfection by Lv-EGFP-CGRP,EGFP/CGRP could be expressed stably.When multiplicity of infection (MOI) was 30,the transfection efficiency reached more than 80%.Compared with the MSC group and the MSC-EGFP group,the mRNA and protein expression levels of CGRP in CGRP-modified MSC(MSC-CGRP group) were markedly increased(allP<0.01).The results of MTT,β-galactosidase staining and inducing differentiation assay demonstrated that the transfected CGRP basically had no effect on the proliferation,aging and endotheliocyte differerntiation of MSC.Conclusion MSC is a kind of ideal genetic vector cell,which can serve as the target cell of CGRP gene transduction for the application of gene therapy and lays the foundation for follow-up in vitro and vivo experiments.
calcitonin gene-related peptide;transfection;mesenchymal stem cells;biological property
国家自然科学基金资助项目(81060014)。 作者简介:陈攀科(1982-),硕士,主治医师,主要从事血管及冠心病介入研究。△
,E-mail:Shibei2147@163.com。
著·
10.3969/j.issn.1671-8348.2015.14.001
R543.4
A
1671-8348(2015)14-1873-03
2014-12-10
2015-02-16)

