诺和灵30R治疗妊娠期糖尿病的疗效分析*
刘伟吴荣珍
诺和灵30R治疗妊娠期糖尿病的疗效分析*
刘伟①吴荣珍①
目的:探讨诺和灵30R治疗妊娠期糖尿病的疗效。方法:根据治疗方案将2012年5月-2015年4月江西省妇幼保健院收治的132例妊娠期糖尿病患者分为观察组72例与对照组60例,观察组采用诺和灵30R治疗,对照组采用诺和灵R联合诺和灵N治疗。结果:治疗前,两组的空腹血糖、餐后2 h血糖、糖化血清蛋白、糖化血红蛋白比较差异均无统计学意义(P>0.05)。治疗后,两组的空腹血糖、餐后2 h血糖、糖化血清蛋白、糖化血红蛋白均显著下降,治疗前后比较差异均有统计学意义(P<0.05),但两组间比较差异均无统计学意义(P>0.05)。两组的血糖达标率、低血糖发生率比较差异均无统计学意义(P>0.05)。观察组未按时注射胰岛素发生率显著低于对照组,两组比较差异有统计学意义(P<0.05)。结论:诺和灵30R治疗妊娠期糖尿病的疗效确切,且依从性良好,是治疗妊娠期糖尿病的理想选择。
诺和灵30R;诺和灵R;诺和灵N;妊娠期糖尿病
糖尿病是一组由于胰岛素分泌不足和/或胰岛素作用低下所致的代谢性疾病。根据糖尿病分类分型方案,它可以分为1型糖尿病、2型糖尿病、妊娠期糖尿病、其他特殊类型糖尿病等4种类型[1]。值得注意的是,妊娠期糖尿病是高危类型的一种,对母儿均可以产生严重的危害,探索治疗妊娠期糖尿病的理想胰岛素制剂成为当前研究的重要课题[2-3]。本研究旨在探讨诺和灵30R治疗妊娠期糖尿病的疗效,现报告如下。
1 资料与方法
1.1 一般资料 选取2012年5月-2015年4月江西省妇幼保健院收治的132例患者作为研究对象,根据治疗方案将患者分为观察组与对照组,两组的年龄、孕次、产次等一般资料比较差异无统计学意义(P>0.05),见表1。
表1 两组的一般资料比较(±s)

表1 两组的一般资料比较(±s)
?
1.2 纳入与排除标准 (1)纳入标准:①符合妊娠期糖尿病的诊断标准:在妊娠期给予孕妇口服75 g葡萄糖耐量试验,空腹、1 h、2 h的血糖诊断界值分别为5.1、10.0、8.5 mmol/L,孕妇任何一个时间点的血糖值超过上述界值即诊断为妊娠期糖尿病[4]。②符合相应胰岛素制剂的治疗指征。(2)排除标准:①妊娠前已经确诊为糖尿病的患者;②合并其他妊娠疾病的患者;③合并急性感染、创伤等应激反应的患者;④既往接受各种胰岛素制剂治疗的患者;⑤对相应胰岛素制剂过敏的患者。
1.3 仪器与试剂 美国贝克曼库尔特公司生产的Olympus AU 5400全自动生化分析仪,美国伯乐公司生产的D-10糖化血红蛋白分析仪,北京九强生物技术公司生产的葡萄糖氧化酶法试剂盒,宁波美康生物科技有限公司生产的糖化清蛋白酶法试剂盒。
1.4 方法 所有患者均接受住院治疗,包括合理膳食,给予糖尿病健康教育,采用POCT血糖仪进行血糖监测等。在住院治疗基础上,观察组采用诺和灵30R(诺和诺德中国制药有限公司生产,国药准字J20030082,规格400 IU/10 mL/支)治疗,每天早餐前、晚餐前30 min给予皮下注射,起始胰岛素剂量为0.4 IU/(kg·d),注意早餐前、晚餐前诺和灵30R的剂量有所区别,后者约为前者的1/2~2/3。对照组采用诺和灵R(诺和诺德中国制药有限公司生产,国药准字J20130021,规格300 IU/3 mL/支)联合诺和灵N(诺和诺德中国制药有限公司生产,国药准字J20030081,规格300 IU/3 mL/支)治疗,诺和灵R在三餐前注射,诺和灵N在晚上临睡前注射,起始胰岛素剂量同样为0.4 IU/(kg·d),根据患者血糖水平进行4次注射的胰岛素剂量分配。在治疗过程中,根据患者空腹血糖以及餐后血糖水平进行胰岛素剂量调整,治疗2个月后进行疗效评价。
1.5 观察指标 (1)空腹血糖:空腹抽取患者静脉血3~4 mL,氟化钠/草酸钾抗凝,3000 rpm离心5 min,取血清进行血糖检测。(2)餐后2 h血糖:给予患者葡萄糖溶液(75 g葡萄糖溶于300 mL水),嘱患者在5 min内服用完毕,从患者服用第一口葡萄糖溶液开始计时,在第120分钟准确抽取患者静脉血3~4 mL,氟化钠/草酸钾抗凝,3000 rpm离心5 min,取血清进行血糖检测。(3)糖化清蛋白:空腹抽取患者静脉血3~4 mL,无需使用抗凝剂,3000 rpm离心5 min,取血清进行糖化清蛋白测定。(4)糖化血红蛋白:空腹抽取患者静脉血2 mL,乙二胺四乙酸二钾抗凝,取全血进行糖化血红蛋白检测。(5)血糖达标率:治疗后,患者空腹血糖3.3~5.3 mmol/L、餐后2 h血糖≤6.7 mmol/L为血糖达标;患者空腹血糖>5.3 mmol/L、餐后2 h血糖>6.7 mmol/L为血糖不达标[5]。血糖达标率=血糖达标患者数/本组患者总数×100%。(6)低血糖发生率:治疗过程中,患者任意时间点血糖浓度<3.3 mmol/L为低血糖。低血糖发生率=发生低血糖的患者数/本组患者总数×100%。(7)未按时注射胰岛素发生率:该值=未按时注射胰岛素发生次数/本组患者注射胰岛素总次数×100%。
1.6 统计学处理 使用SPSS 19.0统计软件进行分析,计量资料采用(±s)表示,组间计量资料比较采用u检验,组内计量资料比较采用配对t检验,计数资料采用 字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后的血糖控制效果比较 治疗前,两组的空腹血糖、餐后2 h血糖、糖化清蛋白、糖化血红蛋白比较差异均无统计学意义(P>0.05)。治疗后,两组的空腹血糖、餐后2 h血糖、糖化血清蛋白、糖化血红蛋白均较治疗前显著下降,两组治疗前后比较差异均有统计学意义(P<0.05),但两组间比较差异均无统计学意义(P>0.05),见表2。
表2 两组治疗前后的血糖控制效果比较(±s)

表2 两组治疗前后的血糖控制效果比较(±s)
*与治疗前比较,P<0.05
2.2 两组的血糖达标率以及低血糖发生率比较 两组的血糖达标率、低血糖发生率比较差异均无统计学意义(P>0.05),见表3。
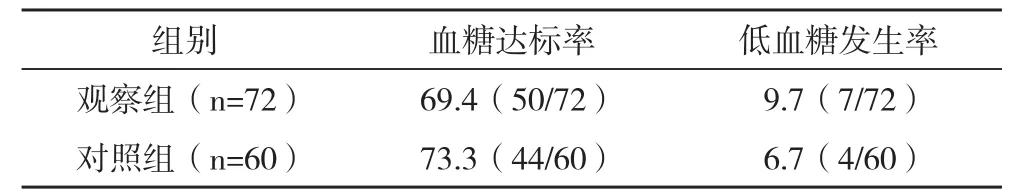
表3 两组的血糖达标率以及低血糖发生率比较 %
2.3 两组的未按时注射胰岛素发生率比较 观察组72例患者住院期间需要注射诺和灵30R共计1166次,其中有14次未按时注射,未按时注射胰岛素发生率为1.2%。对照组60例患者住院期间需要注射诺和灵R、诺和灵N共计1926次,其中有69次未按时注射,未按时注射胰岛素发生率为3.6%。观察组未按时注射胰岛素发生率显著低于对照组,差异有统计学意义(P<0.05)。
3 讨论
妊娠期糖尿病是指妊娠期首次发生或发现的糖代谢异常,其发生率为1.0%~5.0%[6]。但随着目前生活水平的提高,孕检的普及,临床及孕妇对血糖监测的重视,这些因素使得妊娠期糖尿病发病率呈逐年升高的趋势。如前所述,妊娠期糖尿病对母儿可产生严重的危害,如孕妇羊水过多,易于感染,易合并糖尿病酮症酸中毒,妊娠期高血压发生的可能性增加;胚胎发育异常甚至死亡,胎儿生长受限,巨大儿继发难产、产后出血,胎儿畸形;新生儿发生低血糖、呼吸窘迫综合征等,因此临床上应给予妊娠期糖尿病足够的重视[7]。
值得注意的是,妊娠期糖尿病的发病机制至今尚未完全清楚,但诸多研究均认为妊娠期糖尿病是多种因素共同作用的结果,其中胰岛素抵抗、胰岛β细胞分泌胰岛素功能降低、遗传易感性、慢性炎症等在妊娠糖尿病发生发展过程中发挥十分重要的作用[8-9]。目前临床上治疗妊娠期糖尿病多优先使用饮食及运动疗法,一般情况下,通过严格的饮食以及运动计划,多数妊娠期糖尿病患者可以获得满意的血糖控制效果[10]。尽管如此,仍然有部分妊娠期糖尿病患者的血糖处于高水平状态,此时需要给予患者各种胰岛素制剂治疗。诺和灵30R是由30.0%可溶性中性胰岛素、70.0%低精蛋白锌胰岛素组成的混悬液,其中前者为短效胰岛素,后者为中效胰岛素,因此诺和灵30R属于双效胰岛素制剂[11-13]。基于上述原因,诺和灵30R已广泛应用于各种类型糖尿病尤其是妊娠期糖尿病的治疗。Lacroix等[14]报道,诺和灵30R联合营养干预可以有效控制妊娠期糖尿病患者的血糖水平,从而进一步改善妊娠结局。Matias等[15]报道,诺和灵30R可以治疗妊娠期糖尿病患者的疗效理想且安全性、依从性良好。
本研究中笔者将132例妊娠期糖尿病患者分为两组,观察组采用诺和灵30R治疗,对照组采用诺和灵R联合诺和灵N治疗,结果显示两组的空腹血糖、餐后2 h血糖、糖化清蛋白、糖化血红蛋白治疗前比较差异均无统计学意义(P>0.05),治疗后比较差异亦无统计学意义(P>0.05)。在这4个指标中,空腹血糖、餐后2 h血糖反映患者的即时血糖水平,糖化血清蛋白反映患者过去2~3周的平均血糖水平,糖化血红蛋白则反映患者过去6~8周的平均血糖水平,由该结果可知,两组的血糖控制效果相近。进一步分析血糖达标率,结果显示两组的血糖达标率比较差异无统计学意义(P>0.05)。由诺和灵30R、诺和灵R、诺和灵N的药物组成可知,诺和灵30R相当于诺和灵R与诺和灵N混合物,这便是两组疗效相近的原因。在治疗安全性方面,两组的低血糖发生率比较差异无统计学意义(P>0.05);但是在治疗依从性方面,观察组未按时注射胰岛素发生率显著低于对照组,两组比较差异有统计学意义(P<0.05)。由于对照组使用了两种药物,其日注射次数势必显著多于观察组,与观察组相比对照组治疗更加繁琐,因此其依从性较差。综上所述,诺和灵30R治疗妊娠期糖尿病的疗效确切,且依从性良好,从而值得临床推广应用。
[1] Ved P,Shah S.Evaluation of vildagliptin and fixed dose combination of vildagliptin and metformin on glycemic control and insulin dose over 3 months in patients with type 2 diabetes mellitus[J].Indian J Endocrinol Metab,2013,17(1):178.
[2] Bao W,Tobias D K,Bowers K,et al.Physical activity and sedentary behaviors associated with risk of progression from gestational diabetes mellitus to type 2 diabetes mellitus: a prospective cohort study[J]. JAMA Intern Med,2014,174(7):1047-1055.
[3] Zuhur S S,Erol R S,Kuzu I,et al.The relationship between low maternal serum 25-hydroxyvitamin D levels and gestational diabetes mellitus according to the severity of 25-hydroxyvitamin D deficiency[J]. Clinics (Sao Paulo),2013,68(5):658-664.
[4]许镇红.糖化血红蛋白与果糖胺在妊娠糖尿病诊断中的临床应用[J].中外医学研究,2014,12(1):122-123.
[5]吴平,宋婧.妊娠糖尿病孕妇血液指标及妊娠结局分析[J].中国医学创新,2013,10(23):113-115.
[6] Mehrabian F,Hosseini S M.Comparison of gestational diabetes mellitus and pre-eclampsia in women with high hemoglobin in the first trimester of pregnancy: A longitudinal study[J].Pak J Med Sci,2013,29(4):986-990.
[7] Nallaperumal S,Bhavadharini B,Mahalakshmi M M,et al. Comparison of the world health organization and the International association of diabetes and pregnancy study groups criteria in diagnosing gestational diabetes mellitus in South Indians[J].Indian J Endocrinol Metab,2013,17(5):906-909.
[8] Nayak P K,Mitra S,Sahoo J,et al.Comparison of the world health organization and the international association of diabetes and pregnancy study groups criteria in diagnosing gestational diabetes mellitus in South Indians[J].Indian J Endocrinol Metab,2014,18(3):433-434.
[9] Fadl H,Magnuson A,Östlund I,et al. Gestational diabetes mellitus and later cardiovascular disease: a Swedish population based case–control study[J].BJOG,2014,121(12):1530-1536.
[10] Cheng X,Chapple S J,Patel B,et al.Gestational diabetes mellitus impairs nrf2-mediated adaptive antioxidant defenses and redox signaling in fetal endothelial cells in utero[J].Diabetes,2013,62(12):4088-4097.
[11]赵伟丹.诺和锐30与诺和灵30R治疗2型糖尿病的临床疗效观察[J].中外医学研究,2013,11(21):64-65.
[12]张爱国.诺和锐30与诺和灵30R治疗糖尿病疗效比较[J].中外医学研究,2012,10(9):34-35.
[13] Ruholamin S,Eshaghian S,Allame Z. Neonatal outcomes in women with gestational diabetes mellitus treated with metformin in compare with insulin: A randomized clinical trial[J].J Res Med Sci,2014,19(10):970-975.
[14] Lacroix M,Battista M C, Doyon M,et al.Lower adiponectin levels at first trimester of pregnancy are associated with increased insulin resistance and higher risk of developing gestational diabetes mellitus[J].Diabetes Care,2013,36(6):1577-1583.
[15]Matias S L,Dewey K G,Quesenberry C P,et al. Maternal prepregnancy obesity and insulin treatment during pregnancy are independently associated with delayed lactogenesis in women with recent gestational diabetes mellitus[J]. Am J Clin Nutr,2014,99(1):115.
Efficacy of Novolin 30R in the Treatment of Gestational Diabetes Mellitus
LIU Wei,WU Rong-zhen.// Medical Innovation of China,2015,12(33):032-035
Objective:To explore the efficacy of Novolin 30R in the treatment of gestational diabetes mellitus.Method:132 cases of gestational diabetes mellitus who were admitted into the Jiangxi Maternal and Child Health Hospital were selected from May 2012 to April 2015,they were divided into the observation group of 72 cases and control group of 60 cases according to their therapeutic regimen.The observation group was given Novolin 30R, while the control group was given Novolin R and Novolin N.Result:Before treatment,the differences of fasting glucose, 2-hour postprandial blood glucose, glycated albumin and glycosylated hemoglobin between two groups were no statistically significant(P<0.05). After treatment, the fasting glucose,2-hour postprandial blood glucose , glycated albumin and glycosylated hemoglobin of two groups decreased significantly, compared with those before treatment,the differences were statistically significant(P<0.05), but there were not significant differences of those in two groups(P>0.05).The differences of blood glucose standard-reaching rate and incidence of hypoglycemia between two groups were not statistically significant(P>0.05). The incidence of inject insulin unpunctually in observation group was significantly lower than that in control group, the difference was statistically significant(P<0.05).Conclusion:The Novolin 30R in the treatment of gestational diabetes mellitus shows good efficacy and compliance, which is an ideal choice for gestational diabetes mellitus.
Novolin 30R;Novolin R;Novolin N;Gestational diabetes mellitus
10.3969/j.issn.1674-4985.2015.33.011
2015-05-27) (本文编辑:周亚杰)
江西省卫计委资助项目(20081128)
①江西省妇幼保健院 江西 南昌 330006
刘伟
First-author’s address:Jiangxi Maternal and Child Health Hospital, Nanchang 330006,China

