细胞外信号调节蛋白激酶1在缺氧后脑损伤中的表达模式
杨丽君++++++崔红
[摘要] 目的 通过了解细胞外信号调节蛋白激酶1(ERK-1)在缺氧脑损伤大鼠脑中的表达,了解其参与缺氧脑损伤的过程。 方法 48只3 d龄新生SD大鼠,随机分成2组:对照组和缺氧组,每组各24只,缺氧组SD大鼠置于自制密闭容器中,充以含8%氧气的氧氮混合气体,时间为90 min,对照组SD大鼠不进行处理。分别于造模后6个时间点——1、3、7、14、21 d和28 d后留取两组SD大鼠脑组织,采用Western blot检测ERK-1总蛋白在脑组织中的表达情况。 结果 缺氧组大鼠脑组织ERK-1呈现动态表达;变化规律:在缺氧早期(缺氧后1~7 d),ERK-1总蛋白的表达均有降低的趋势,缺氧后第14天开始其表达具有升高的趋势,缺氧后第21天和第28天ERK-1表达量又有所下降,差异无统计学意义(P > 0.05)。 结论 缺氧造成新生大鼠脑损伤时,ERK-1总蛋白的表达谱没有明显变化的趋势,提示在早产儿缺氧性脑损伤时ERK-1并不通过剂量的变化对缺氧后脑组织损伤进行调节。
[关键词] 早产儿;缺氧性脑损伤;细胞外调节蛋白激酶1;大鼠
[中图分类号] R72 [文献标识码] A [文章编号] 1673-7210(2015)02(a)-0008-04
早产儿的存活率和生命质量的改善是本世纪新生儿医学重点攻克的目标之一。据WHO报道,全球每年有1500万早产儿出生,且早产儿的发生率在逐年上升,我国人口众多,每年出生的早产儿缺氧缺血性脑损伤的发病数目更为惊人,在早产儿中常常会发生学习困难,表现为阅读、拼写、计算或写作困难。虽然近年来早产儿的预后有了很大的改善,但早产儿脑损伤所带来的后遗症等仍然是影响早产儿最终生命质量的严重问题。迄今为止,早产儿脑损伤的发病机制尚未完全明确。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是细胞内一类丝氨酸/苏氨酸蛋白激酶,普遍存在于包括哺乳动物在内的多种生物细胞内,细胞外信号调节蛋白激酶1(extracellular signal regulated protein kinase 1,ERK-1)是所有丝裂原活化蛋白激酶家族最早被认识的成员,有文献报道,它能够调节细胞增殖和分化的重要细胞信号通路[1],近期有文献报道,硫氢化钠诱导的增殖也与ERK-1的磷酸化有关[2]。同时,ERK-1与凋亡也有比较密切的关系,有研究报道,其在脑缺血再灌注损伤发生过程发挥着重要作用[3-4]。近年来也有文献报道,其在缺氧/复氧损伤发生过程中也发挥非常重要的作用[5]。Liu等[6]研究发现缺氧也能够激活肾侧群细胞的ERK的活性,但是在非侧群细胞则不出现这种现象。近来有研究发现,在缺血性因素刺激下,ERK-1参与了血脑屏障的Na+/H+交换以及Na+-K+-Cl-共运输的过程[7]。也有研究认为缺氧能够在体外上调ERK-1的磷酸化[8],但是ERK-1在缺氧性脑损伤发生之后的动态表达谱尚不明确,本研究拟在缺氧发生后的多个时间点进行ERK-1的表达检测,从而明确ERK-1在缺氧发生后的表达情况,从而更加有助于探讨缺氧性脑损伤的发生、发展以及神经修复过程。
1 材料与方法
1.1 材料
实验中用到的3 d龄SD大鼠(SPF级,雌雄不计,体重8~10 g)购自北京维通利华实验动物技术有限公司[SCXK(京)2007-0001],充入的氮氧混合气体(8%O2+92%N2)由首都医科大学附属北京友谊医院(以下简称“我院”)提供,本实验室自制封闭容器。
1.2 缺氧模型的建立
实验所用到的3 d龄SPF级SD大鼠,日常在我院SPF级动物房饲养,条件如下,照明时间;黑暗时间=12 h∶12 h,温度:23~25℃,湿度保持在40%。将乳鼠随机分为两组:对照组和缺氧组,每组各24只,对照组不做处理,缺氧组放入本实验室自制容器,在37℃水浴中充以氮氧混合气(O2占8%),持续时间为90 min,之后回笼,继续行母乳喂养。
1.3 大鼠脑组织标本获取
分别于缺氧模型建立后第1、3、7、14、21天和第28天6个时间点处死两组大鼠,其中每个时间点对照组和缺氧组大鼠各4只,每组大鼠的左侧脑组织立即放入10%的中性福尔马林溶液固定,之后进行切片、备用,右侧大脑立即放入液氮保存,用于进行Western blot检测。
1.4 HE染色
将脑组织用10%的中性福尔马林液中固定8 h,依次放入20%、30%蔗糖溶液分别过夜(24~48 h)沉底,组织沉底之后即可进行冰冻切片,切片厚度为12 μm,进行HE染色,参见既往发表文章[9],拍照保存。
1.5 Western blot检测ERK-1表达量
预冷RIPA蛋白抽提试剂,加入蛋白酶抑制剂Protease inhibitor cocktail(Roche)。按组织重量9倍比例加入裂解液,冰上用组织匀浆器进行匀浆3次。冰上进行孵育20 min后,4℃ 15 000 r/min离心20 min,取上清,分装深低温冰箱保存,按照BCA蛋白定量试剂盒(cwbiotech)测定蛋白浓度。之后进行蛋白PAGE凝胶电泳,10%分离胶,5%浓缩胶(丙烯酰胺,双丙烯酰胺,TEMED,Amresco)。电泳条件:浓缩胶恒压90 V,约20 min;分离胶恒压130 V,通过预染蛋白Marker(Biomed)来确定电泳停止时间。湿转法,转膜条件:300 mA恒流;0.45 μm孔径PVDF膜(Millipore),转膜时间1 h。转膜完成后丽春红染色试剂对膜进行染色,观察转膜效果。之后将膜完全浸没TBST溶液中(含5%脱脂牛奶),室温下摇床孵育1 h。将膜与ERK-1一抗(Santa cruz)或者β-actin一抗(Santa cruz,封闭液稀释)一起孵育,ERK-1的一抗稀释浓度1∶500,β-actin的一抗稀释浓度1∶1000,4℃冰箱过夜。次日TBST洗膜3次。二抗孵育:羊抗兔IgG HRP(1∶20 000),孵育40 min(在室温),洗膜。滴加ECL,反应3 min;曝光,显影,定影。照相,用LabWorks软件对图像进行灰度分析,计算出每个样本的ERK-1灰度值与相应的β-actin的灰度值,取其比值进行计算,并进行统计学分析。
1.6 统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 大鼠乳鼠缺氧后表现
缺氧后早期大鼠出现兴奋症状的表现:躁动不安、翻滚,呼吸加深加快,45 min~1 h后逐渐出现抑制症状:反应迟缓淡漠、间断发作的痉挛、抽搐等。最后进入比较稳定的反应淡漠期,此反应一直持续至缺氧完成,恢复氧供后乳鼠反应逐渐恢复正常。
2.2 HE染色结果
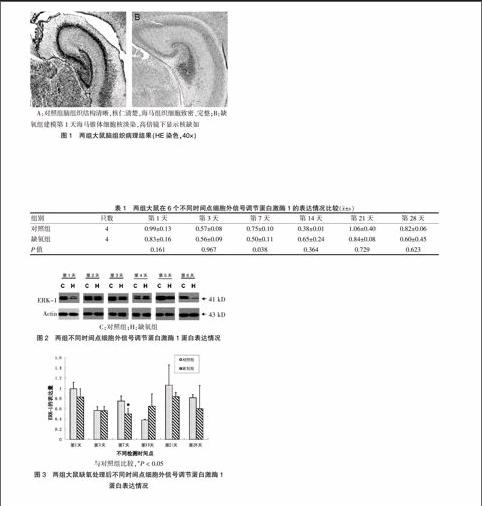
对照组大鼠脑组织结构清晰,海马锥体细胞致密、完整,缺氧组大鼠海马锥体细胞核淡染、甚至细胞核缺如,见图1。
2.3 两组大鼠不同时间点细胞外信号调节蛋白激酶1表达情况比较
缺氧组ERK-1表达呈现动态性变化,与对照组相比,缺氧后ERK-1表达量基本处于低于正常对照的水平,但是与对照组的变化趋势趋于一致,第14天时ERK-1的表达较对照组有所升高,到第21、28天时ERK-1的表达与对照组比较又有所降低。虽然有变化趋势,但是经过统计学t检验分析,差异均无统计学意义(P > 0.05),具体见表1,图2、3。
3讨论
缺氧性脑损伤的病理发生是一个多因素的复杂过程,在此过程中,众多分子参与其中,ERK-1蛋白在脑内广泛存在,是脑功能活动中重要的信号转导分子[10],ERK-1接受刺激信号后活化为磷酸化的ERK-1,从胞浆转位至胞核,通过磷酸化转录因子等途径发挥细胞调节作用。脑缺血再灌注损伤中有ERK-1广泛参与,但其所发挥的是保护性作用还是损伤性作用,目前仍存在很大争议[11-13]。有文献报道,自由基清除药——依达拉奉可以通过激活ERK-1来减轻缺氧/复氧诱导的神经元损伤中毒[14]。Ban等[15]的研究发现抑制ERK-1能够恶化肠缺血/再灌注损伤。缺氧发生之后ERK-1的表达模式如何尚不明确,本研究通过探讨缺氧发生后ERK-1的动态表达模式来进一步明确缺氧发生过程中ERK-1的可能作用,研究发现,缺氧后脑组织ERK-1表达水平呈现动态变化,缺氧后第1天开始ERK-1表达降低,一直到缺氧后第7天达到表达的最低值,之后出现表达情况的上升,缺氧后第14天时表达高于正常情况,表达情况一直持续到缺氧后第21天达到最高峰,但是低于正常情况,缺氧后第28天时表达又有所降低。根据折线图可以看出,ERK-1在大鼠乳鼠发育过程中呈现一种动态模式的表达情况,存在一个表达高峰和一个表达低谷,提示ERK-1在细胞的正常发育过程中也发挥着重要作用,缺氧组的ERK-1的表达总体比正常情况低下,虽然经过分析差异无统计学意义(P > 0.05),但是存在降低的趋势,提示在大鼠乳鼠脑组织缺氧损伤过程中ERK-1也存在剂量的变化。需要进一步研究ERK-1基因与其他缺氧相关的基因,如缺氧诱导因子(hypoxia induced factor-1α,HIF-1α)等基因表达的相互关系,从而更加明确其参与缺氧脑损伤过程的作用机制。
[参考文献]
[1] Ramos JW. The regulation of extracellular signal-regulated kinase(ERK) in mammalian cells [J]. Biochem Cell Biol,2008,40(12):2707-2719.
[2] Liu D,Wang Z,Zhan J,et al. Hydrogen sulfide promotes proliferation and neuronal differentiation of neural stem cells and protects hypoxia-induced decrease in hippocampal neurogenesis [J]. Pharmacol Biochem Behav,2014,116:55-63.
[3] Niimura M,Takagi N,Takagi K,et al. Effects of hepatocyte growth factor on phosphorylation of extracellular signal regulated kinase and hippocampal cell death in rats with transient forebrain ischemia [J]. Eur J Pharmacol,2006,535(1):114-124.
[4] Zhu Y,Yang GY,Ahlemeyer B,et al. Transforming growth factor-B1 increases bad phosphorylat ion and protects neurons against damage [J]. Neuroscience,2002,22(10):3898-3909.
[5] Liu L,Liu H,Yang F,et al. Tissue kallikrein protects cortical neurons against hypoxia/reoxygenation injury via the ERK-1/2 pathway [J]. Biochem Biophys Res Commun,2011,407(2):283-287.
[6] Liu WH,Liu HB,Gao DK,et al. ABCG2 protects kidney side population cells from hypoxia/reoxygenation injury through activation of the MEK/ERK pathway [J]. Cell Tran-splant,2013,22(10):1859-1868.
[7] Yuen N,Lam TI,Wallace BK,et al. Ischemic factor-induced increases in cerebral microvascular endothelial cell Na/H exchange activity and abundance:evidence for involvem-ent of ERK1/2 MAP kinase [J]. Am J Physiol Cell Physiol,2014,306(10):C931-C942.
[8] Haddad JJ,Hanbali LB. Hypoxia upregulates MAPK(p38)/MAPK(ERK)phosphorylation in vitro:neuroimmunological differential time-dependent expression of MAPKs [J]. Protein Pept Lett,2014,21(5):444-451.
[9] 杨丽君,崔红,杨爱君,等.大鼠全脑脑片培养及缺氧缺糖模型的建立[J].实验动物与比较医学杂志,2009,29(5):283-285.
[10] Thomas KL,Hunt SP. The regional distribution of extra-cellularly regulated kinase-1 and-2 messenger RNA in the adult rat central nervous system [J]. Neuroscience,1993,56(3):741-757.
[11] Arany I,Megyesi JK,Kaneto H,et al. Cisplatin-induced cell death is EGFR/src/ERK signaling dependent in mouse proximal tubule cells [J]. Am J Physiol,2004,287(3):F543-F549.
[12] Henriksson M,Stenman E,Vikman P,et al. MEK I/2 inhi-bition attenuates vascular ETA and ETB receptor alte-rations after cerebral ischemia [J]. Exp B rain Res,2007, 178(4):470-476.
[13] Lu K,Cho CL,Liang CL,et al. Inhibition of the MEK/ERK pathway reduces microglial activation and inte-rleukin-1-beta expression in spinal cord ischemia/ rep-erfusion injury in rats [J]. J Thorac Card iovasc Surq,2007,133(4):934-941.
[14] Wang G,Su J,Li L,et al. Edaravone alleviates hypoxia-acidosis/reoxygenation-induced neuronal injury by acti-vating ERK1/2 [J]. Neurosci Lett,2013,543:72-77.
[15] Ban K,Peng Z,Kozar RA. Inhibition of ERK1/2 worsens intestinal ischemia/reperfusion injury [J]. PLoS One,2013, 8(9):e76790.
(收稿日期:2014-10-15 本文编辑:任 念)

