新型小发卡RNA慢病毒表达载体的构建及抗乙型肝炎病毒应用评价
张婷玉,张秀娟,毛莹莹 ,胡伟 ,王学军,王升启
1.河南中医学院,河南 郑州 450008;2.军事医学科学院 放射与辐射医学研究所,北京 100850
RNA干扰(RNA interference,RNAi)是指在进化过程中高度保守的、由双链RNA诱发的、同源mRNA被高效特异性降解的一种基因沉默现象,广泛存在于植物、线虫、果蝇、脊椎动物和真菌等多种生物中[1]。引起RNAi现象的双链RNA长度约21 nt,目前主要有2种生成方式:直接化学合成的小干扰RNA(small interference RNA,siRNA)和基于载体编码的小发卡RNA(short hairpin RNA,shRNA)或 人 工 microRNA(artificial miRNA,amiRNA)[2]。RNAi因其高效、可沉默特异基因的特点而受到众多学者的关注[3-5]。迄今,RNAi不仅作为生物基础研究领域的重要工具得到广泛应用,而且作为一种药物治疗的潜在形式和手段受到国内外众多制药公司的青睐。
慢病毒载体是主要源于人免疫缺陷病毒1(HIV-1)的一种病毒载体,包含了包装、转染、稳定整合所需要的遗传信息[6]。慢病毒介导的RNAi可将目的基因整合至靶细胞基因组进行长期表达,其作用持续且稳定,随慢病毒的扩散可同时扩大载体感染细胞的范围,适于基因治疗。与普通载体相比,慢病毒载体具有携带基因片段容量大、转染效率高、靶向性好、可转染分裂细胞及非分裂细胞、目的基因可在宿主细胞中长时间稳定表达、不易诱发宿主的免疫反应、安全性好等诸多优点[7]。
本实验室前期发明了一种基于单长链和双短链的shRNA构建新方法[8],但由于该shRNA表达的pshRNA-OK载体是普通载体,不能实现shRNA的长期表达,极大地限制了其应用范围。为了实现此种shRNA的长期、稳定表达,我们构建了一种用于此新型shRNA构建、表达的慢病毒载体,并将其用于抗乙型肝炎病毒(hepatitis B virus,HBV)的效果评价。
1 材料与方法
1.1 材料
293T细胞和HepG2.CW细胞(稳定整合1.31倍HBV中国流行株C基因型基因组序列)由本实验室保存;大肠杆菌DH5α感受态细胞、普通PCR产物回收试剂盒、琼脂糖凝胶回收试剂盒、质粒提取试剂盒均为天根生化科技(北京)有限公司产品;胎牛血清(FBS)购自Gibco公司;MEM培养基、DMEM培养基、胰酶、PBS购自北京中科迈晨科技公司;慢病毒包装系统(包括pCMVΔR8.2载体)由Inder M.Verma博士惠赠;pVSV-G载体、pLNB-GB载体为本实验室构建保存(用eGFP-T2A-blasticidin骨架替换载体pLNBMP[9]中的mCherry-T2A-puromycin结构)。
HBsAg、HBeAg诊断试剂盒(酶联免疫法)购自上海科华公司;HBV核酸定量检测试剂盒为深圳市普瑞康生物技术有限公司产品;限制性内切酶和退火缓冲液2购自NEB公司;PCR扩增试剂盒和DNA快速连接试剂盒购自TaKaRa公司;转染试剂GenJet(Ver.Ⅱ)购自SignaGen公司;杀稻瘟菌素(blastici⁃din)为InvivoGen公司产品;引物合成和质粒测序均由中美泰和公司完成;化学试剂均为分析纯产品。
1.2 表达shRNA慢病毒载体的构建
采用点突变方法将pLNB-GB载体的2个SapⅠ位点突变后,将用于表达shRNA的结构(含H1启动子)从pshOK-basic载体中用BamHⅠ和XhoⅠ亚克隆到pLNB-GB载体,命名为pLNB-shOK-basic。用于shRNA构建的寡核苷酸序列见表1。
将合成的shRNA寡核苷酸干粉用ddH2O溶解至50 μmol/L,加入退火缓冲液2,于 95℃反应4 min、70℃反应10 min,缓慢冷却至室温,形成双链结构[10]。2个和3个串联shRNA结构采用BamHⅠ和XhoⅠ双酶切,从pshOK-basic载体[8]亚克隆到pLNB-shRNAOK载体。慢病毒质粒分别命名为neg、shRNA-3172、shRNA-139-3172、sh-RNA139-1819-3172。所有载体均经酶切和测序鉴定正确后用于实验。
1.3 慢病毒的包装
将处于对数生长期的293T细胞(DMEM培养基,含10%FBS)以5.0×106/皿的密度接种于10 cm2细胞培养皿上,于37℃、5%CO2孵箱中培养至80%融合,用GenJet转染试剂将慢病毒载体三质粒包装系统(shRNA慢病毒质粒、包装质粒pCMVΔR8.2和包膜质粒pVSV-G)以2∶2∶1的质量比共转染293T细胞,12 h后吸出转染混合液更换新鲜培养液,分别于转染后48、60、72 h收集病毒上清,混合后用0.45 μm滤膜过滤除去细胞碎片,分装后于-70℃保存,另取10 μL用于慢病毒滴度测定。
1.4 慢病毒滴度测定
将处于对数生长期的293T细胞(DMEM培养基,含 10%FBS)以 1.0×104/孔的密度接种于 96 孔板,于37℃、5%CO2孵箱中培养12 h,将慢病毒原液用连续稀释法稀释至6个梯度(10-1~10-6),终体积100 μL,弃去原培养液,分别加入6组细胞内,每组设3个复孔;感染48 h后换液为新鲜培养基,感染60 h后在荧光显微镜下观察绿色荧光,以计数方式估算病毒滴度。其中以出现特异、呈细胞形态的荧光计为感染成功;若孔内荧光过多无法计数,则计算低浓度慢病毒孔,直至方便计数为准(一般为1~20个),即用一个孔内计得的荧光个数×10-(n+1)(n:表示从高浓度到低浓度计数第n个孔)[11]。
1.5 慢病毒感染HepG2.CW细胞
将处于对数生长期的HBV稳定转染HepG2.CW细胞(MEM培养基,含10%FBS)以1×105/孔的密度接种于24孔板,于37℃、5%CO2孵箱中培养12 h,根据上一步慢病毒滴度测定结果,按照MOI=3(1个细胞平均感染3个病毒)将重组慢病毒感染HepG2.CW细胞,12 h后更换新鲜培养基,48 h后在荧光显微镜下观察各孔绿色荧光蛋白表达情况并继续培养,72 h后更换含10 μg/mL杀稻瘟菌素的新鲜培养基进行稳转细胞筛选,每2 d换液;筛选至孔内所有细胞都有绿色荧光表达时(约1周),将细胞用胰酶重新消化并计数,将不同的稳转细胞按相同密度(1×105/孔)重新铺于24孔板中,2 d换液为新鲜培养基,96 h后收集上清,检测HBsAg、HBeAg的表达和HBV DNA的含量。

表1 shRNA序列
1.6 细胞上清HBsAg、HBeAg的表达和HBV DNA含量检测
按照HBsAg、HBeAg诊断试剂盒(酶联免疫法)说明书和HBV核酸定量检测试剂盒说明书操作步骤进行。①HBsAg检测:取75 μL细胞培养液、阳性对照、阴性对照分别加入HBsAg检测96孔板中,37℃孵育1 h,每孔加入50 μL HBsAg的酶标结合物,37℃孵育30 min,用洗液洗板6次,加入发光液A、B各50 μL,37℃孵育15 min,检测D450nm值并计算相应浓度。②HBeAg检测:取50 μL细胞培养液、阳性对照、阴性对照分别加入HBeAg检测96孔板中,每孔加入50 μL HBeAg的酶标结合物,37℃孵育30 min,用洗液洗板6次,加入发光液A、B各50 μL,37℃孵育 15 min,检测 D450nm值并计算相应浓度。③HBV DNA检测:取100 μL样品处理液A,分别加100 μL细胞上清液、阳性对照、阴性对照、工作标准品1~4,振荡混匀后13 000 r/min离心10 min(离心时固定方向),吸弃上清,各管加25 μL样品处理液B,振荡混匀,低速离心后100℃干浴10 min,13 000 r/min离心10 min,取上清为PCR反应模板;按照A∶B=27 μL∶0.6 μL的比例配制PCR混合液,并按27 μL/管分装至PCR反应管中;将处理好的样本、阳性对照、阴性对照、工作标准品1~4的上清各3 μL分别加到装有PCR反应液的PCR反应管中,94℃ 2 min,然后以94℃ 20 s、55℃ 30 s(采集荧光信号)、72℃ 10 s行40个循环,25℃ 10 min。
1.7 统计学分析
数据以x±s表示,用GraphPad Prism 5进行统计学分析,假设检验采用t检验。
2 结果
2.1 慢病毒质粒的酶切鉴定
将shRNA慢病毒质粒用BamHⅠ和XhoⅠ双酶切,经1%琼脂糖凝胶电泳检测(图1),可见4个慢病毒质粒除了都有约10 000 bp的大条带外,neg和shRNA-3172组小条带约为300 bp,shRNA-139-3172组小条带约为700 bp,shRNA-139-1819-3172组小条带约为900 bp,与目的条带一致。
2.2 重组慢病毒感染293T细胞的滴度估算
将慢病毒原液梯度稀释后感染293T细胞,48 h后换液为新鲜培养基,60 h在荧光显微镜下观察绿色荧光,以计数方式估算病毒滴度。图2A为最高浓度孔(原液的10-1)的荧光图片,图2B示不同组别慢病毒的滴度。可以看出,载体中插入shRNA结构会使慢病毒滴度下降,且串联结构越复杂,慢病毒滴度越低。
2.3 重组慢病毒对HBsAg和HBeAg的抑制作用
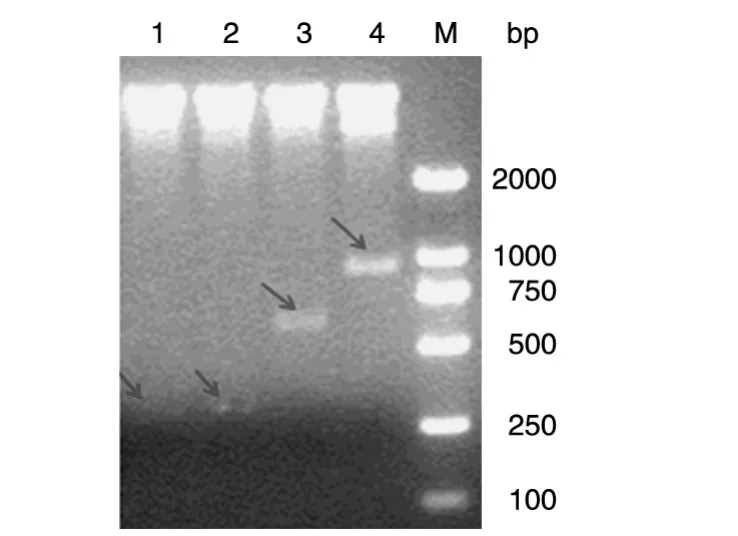
图1 shRNA慢病毒质粒的BamHⅠ和XhoⅠ双酶切鉴定1:neg;2:shRNA-3172;3:shRNA-139-3172;4:shRNA-139-1819-3172;M:DNA marker DL2000

图2 shRNA串联对慢病毒滴度的影响A:不同重组慢病毒感染293T细胞的荧光图片;B:不同组别慢病毒的滴度;1:neg;2:shRNA-3172;3:shRNA-139-3172;4:shRNA-139-1819-3172;*P<0.05;***P<0.001
将重组慢病毒感染HepG2.CW细胞,用杀稻瘟菌素筛选稳定克隆1周后以相同数量细胞(1×105/孔)分别铺板,并于铺板96 h取细胞上清检测HB⁃sAg、HBeAg的表达水平。结果如图3,重组慢病毒对HBsAg、HBeAg均有较好的抑制作用,shRNA-3172、shRNA-139-3172串联、shRNA-139-1819-3172串联组对HBsAg的抑制率分别为63.5%、74.4%、85.4%,对 HBeAg的抑制率分别为 35.9%、61.3%、70.6%。在单个shRNA和2个、3个串联结构中,对HBsAg、HBeAg的抑制作用大小依次为:3个串联>2个串联>单个。
2.4 重组慢病毒对HBV DNA表达的影响
将重组慢病毒感染HepG2.CW细胞,用杀稻瘟菌素筛选稳定克隆1周后以相同数量细胞(1×105/孔)分别铺板,并于铺板96 h取细胞上清检测HBV DNA的水平。结果如图4,重组慢病毒对HBV DNA的表达均有较好的抑制作用,shRNA-3172、shRNA-139-3172串联、shRNA-139-1819-3172串联组对HBV DNA表达的抑制率分别为65.7%、68%、79.3%。在单个shRNA和2个、3个串联结构中,对HBV DNA抑制作用的大小依次为:3个串联>2个串联>单个。

图3 重组慢病毒对HBsAg(A)和HBeAg(B)的抑制作用1:neg;2:shRNA-3172;3:shRNA-139-3172;4:shRNA-139-1819-3172;*P<0.05;***P<0.001

图4 重组慢病毒对HBV DNA表达的抑制作用1:neg;2:shRNA-3172;3:shRNA-139-3172;4:shRNA-139-1819-3172;**P<0.01;***P<0.001
3 讨论
RNAi是近年发现的在生物体内普遍存在的一种古老的生物学现象,它能够在转录水平、转录后水平和翻译水平上阻断基因的表达,阻断作用高效、靶向性好[12-13]。本实验室在RNAi领域有一定基础,曾利用人工miRNA介导的RNAi技术实现了HBV[14]和登革病毒[9]的特异性抑制,并发明了一种基于单长链和双短链的shRNA构建新方法[8],但该shRNA表达的pshRNA-OK载体是普通载体,须通过转染方式将shRNA导入细胞,因而限制了其应用范围。为弥补上述缺陷,目前通常采用病毒载体介导siRNA的表达。大量体外和体内研究证明,利用腺相关病毒和慢病毒载体可提升RNAi在治疗癌症、心脏病、神经组织退化性疾病和病毒感染性疾病方面的疗效[15-19],而且这2个病毒性载体可通过选择不同的蛋白质外壳或外膜产生组织靶向性,并可选择组织特异性的启动子,从而实现双重靶向。将慢病毒作为siRNA的携带载体,不但具备特异性地使基因表达沉默的能力,还可以充分发挥病毒载体自身所具备的优势,为研究基因功能提供了更强有力的工具[18]。另外,利用慢病毒载体包装的策略不但使脂质体有效转染的细胞种类增加,而且对基因表达的抑制效果不逊色于体外合成的siRNA,在长期稳定表达载体的细胞中可以发挥长期阻断基因表达的作用[19]。
我国是乙型肝炎的高发区,据世界卫生组织统计资料,全世界有超过3.5亿人为慢性HBV感染,其中约1.2亿人在中国,每年死于HBV相关疾病的患者高达80万。目前,HBV疫苗虽然可起到预防作用,但对已感染者、免疫耐受者和病毒逃逸株无效。近年来虽然研发了一些抗病毒药物,但是存在副作用较大(干扰素)、易产生耐药(核苷类药物)、抗原血清转换率低等缺点。因此,继续加强对HBV感染机制的理解和相应抗HBV药物的研发,仍然是当前非常重要和迫切的任务。随着生物技术的发展,RNAi技术在治疗乙肝感染中的潜力和优势逐渐凸显。2003年,Shlomai等通过一系列实验证实,RNAi技术不仅可以在转录和翻译阶段有效抑制HBV表达,也可以抑制HBV复制;另外它的抑制作用是序列特异性的,故不受制于活跃的病毒复制[20]。本研究构建的新型shRNA的慢病毒载体也能够抑制HepG2.CW细胞上清HBsAg、HBeAg和HBV DNA的水平;另外,可以通过串联不同靶向的若干个shRNA实现多靶点抑制,从而达到更好的抗病毒治疗效果。但是,随着串联结构的复杂程度的增加,包装慢病毒时的难度相应增加、滴度下降,感染细胞时效率降低等问题仍旧需要找到更好的方法克服,应该在病毒滴度和串联个数之间找到最佳平衡点。
本研究提供了一种新型shRNA慢病毒载体的构建方法,并在抗HBV复制方面做了初步评价,为该shRNA慢病毒载体的进一步应用提供了前期依据。相信随着RNAi应用领域的不断扩展及研究内容的不断加深,本研究构建的shRNA慢病毒载体将会得到较为广泛的应用。
[1] Moss E G.RNA interference:it's a small RNA world[J].Curr Biol,2001,11(19):R772-R775.
[2] Ullu E,Djikeng A,Shi H,et al.RNA interference:advances and questions[J].Philos Trans R Soc Lond B Biol Sci,2002,357(1417):65-70.
[3] Shi Y,Hu S,Song Q,et al.Gene silencing of 4-1BB by RNA interference inhibits acute rejection in rats with liver transplantation[J].Biomed Res Int,2013,2013:192738.
[4] Yang B,Janardhanan R,Vohra P,et al.Adventitial transduc⁃tion of lentivirus-shRNA-VEGF-A in arteriovenous fistula re⁃duces venous stenosis formation[J].Kidney Int,2014,85(2):289-306.
[5] Yue J,Sheng Y,Ren A,et al.A miR-21 hairpin structurebased gene knockdown vector[J].Biochem Biophys Res Com⁃mun,2010,394(3):667-672.
[6] Fassler R.Lentiviral transgene vectors[J].EMBO Rep,2004,5(1):28-29.
[7] Schambach A,Zychlinski D,Ehrnstroem B,et al.Biosafety features of lentiviral vectors[J].Hum Gene Ther,2013,24(2):132-142.
[8] Wang X J,Li Y,Huang H,et al.A simple and robust vec⁃tor-based shRNA expression system used for RNA interference[J].PLoS One,2013,8(2):e56110.
[9] Xie P W,Xie Y,Zhang X J,et al.Inhibition of Dengue vi⁃rus2 replication byartificialmicrornastargetingthecon⁃served regions[J].Nucleic Acid Ther,2013,23(4):244-252.
[10]Wang X,Wang S.One long oligonucleotide or two short oligo⁃nucleotides based shRNA construction and expression[J].Meth⁃ods Mol Biol,2015,1218:37-41.
[11]江千里,王健民,江汕,等.经典方法与LaSRT法测定绿色荧光蛋白标记重组病毒滴度的研究[J].第一军医大学学报,2003,23(10):1101-1103.
[12]Grosshans H,Slack F J.Micro-RNAs:small is plentiful[J].J Cell Biol,2002,156(1):17-21.
[13]Maine E M.RNAi As a tool for understanding germline devel⁃opment in Caenorhabditis elegans:uses and cautions[J].Dev Biol,2001,239(2):177-189.
[14]赵海峰,李丹丹,李英,等.人工microRNA抗乙型肝炎病毒效果初探[J].生物技术通讯,2011,22(6):769-772.
[15]Henry S D,van der Wegen P,Metselaar H J,et al.Simulta⁃neous targeting of HCV replication and viral binding with a single lentiviral vector containing multiple RNA interference expression cassettes[J].Mol Ther,2006,14(4):485-493.
[16]Matsushita N,Matsushita S,Hirakawa S,et al.Doxycyclinedependent inducible and reversible RNA interference mediat⁃ed by a single lentivirus vector[J].Biosci Biotechnol Biochem,2013,77(4):776-781.
[17]Woods N B,Ooka A,Karlsson S.Development of gene thera⁃py for hematopoietic stem cells using lentiviral vectors[J].Leu⁃kemia,2002,16:563-569.
[18]Rubinson D A,Dillon C P,Kwiatkowski A V,et al.A lenti⁃virus-based system to functionally silence genes in primary mammalian cells,stem cells and transgenic mice by RNA in⁃terference[J].Nat Genet,2003,33(3):401-406.
[19]Shen P C,Lu C S,Shiau A L,et al.Lentiviral small hairpin RNA knockdown of macrophage inflammatory protein-1gamma ameliorates experimentally induced osteoarthritis in mice[J].Hum Gene Ther,2013,24(10):871-882.
[20]Shlomai A,Shaul Y.Inhibition of hepatitis B virus expression and replication by RNA interference[J].Hepatology,2003,37(4):764-770.

