钩端螺旋体层粘连蛋白结合蛋白Lsa20的表达与功能分析
魏颖,袁盛凌,姚雪晶,陶好霞,王令春,刘纯杰,田威,王艳春
1.沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;2.军事医学科学院 生物工程研究所,北京 100071
黏附到宿主细胞表面是许多病原微生物感染的必要步骤。病原微生物通过黏附分子,与表达于宿主细胞表面的特定配体分子相互作用而完成对靶细胞的黏附,进而在该部位定居并大量繁殖,产生毒素或侵入细胞内部,损伤组织细胞,发挥致病效应[1-3]。在这一过程中,识别黏连基质分子的微生物表面成分(microbial surface components recognizing adhe⁃sive matrix molecules,MSCRAMM)扮演着十分关键的角色[4-6]。在众多MSCRAMM分子中,层粘连蛋白结合蛋白(laminin-binding protein,LBP)是其中的一大类,它们主要识别靶细胞表面细胞外基质中的糖蛋白——层粘连蛋白(laminin,LN)[3]。以肺炎链球菌为例,该菌株通过其表面的MSCRAMM分子PspC与宿主脑微血管上皮细胞表面的LN结合,然后利用胞吞转运作用模式通过内皮屏障,一但进入脑脊液,肺炎链球菌迅速繁殖并释放出大量毒力因子,如脂磷壁酸(LTA)和肺炎链球菌溶血素(Ply),进而激活机体内相关的信号通路并引发机体的炎症反应[7-8]。再如,对寄生虫构端螺旋体而言,其表面表达的Lsa20、Lsa30和Lsa33等LBP能够与宿主细胞胞外基质中的LN结合,促进其在宿主体内的定植,在其致病过程中发挥重要作用[9]。因此,LBP在病原微生物致病机制研究过程中受到广泛重视。
我们通过基因工程方法表达并纯化了可溶性的重组构端螺旋体Lsa20蛋白,并对其与LN相互作用的生物特性进行分析,建立了研究类似生物功能蛋白的相关技术方法和手段,为后续研究和鉴定其他新的LBP奠定了实验基础。
1 材料与方法
1.1 材料
COS-7细胞、大肠杆菌表达载体pET-28a为本室保存;大肠杆菌DH5α、BL21(DE3)感受态细胞购自天根生化科技有限公司;用于研究相互作用的蛋白配体鼠源LN购自Singa-Aldrich公司;无蛋白封闭液购自Thermo公司;抗小鼠His-tag单抗、可溶性单组分TMB底物显色液购自天根生化科技有限公司;兔抗小鼠LN多抗购自Millipore公司;HRP标记的二抗购自中杉金桥公司;Ni-NTA His·Bind Resin购自Novagen公司;BCA蛋白定量试剂盒购自北京原平皓生物技术有限公司。
1.2 Lsa20编码基因的合成
构端螺旋体的Las20蛋白编码基因序列(Gen⁃Bank ID:2772019)从NCBI网站获得,序列由金唯智公司合成,合成前利用该公司的密码子优化工具OPTIMWIZ针对大肠杆菌密码子偏爱性及其他可能提高表达水平的参数进行优化。合成的序列克隆到pUC57质粒后测序,鉴定正确的质粒用于后续实验。
1.3 Lsa20蛋白在大肠杆菌中的表达纯化
用BamHⅠ和XhoⅠ双酶切含Lsa20基因的质粒,切胶纯化回收获得目标基因片段,与经同样酶切的质粒pET28a(+)连接后转化大肠杆菌DH5α,随机挑选菌落进行菌落PCR鉴定及质粒酶切鉴定,将鉴定正确的重组质粒转化大肠杆菌BL21(DE3),对应单位克隆接种于5 mL含50 μg/mL卡那霉素的LB液体培养基中,37℃培养过夜,再取过夜培养菌液按1∶100的比例接种到含卡那霉素50 μg/mL的400 mL LB培养基中,37℃培养4 h后,加入终浓度为1 mmol/L的IPTG,16℃过夜诱导表达,培养结束后将培养物于4℃、8000 r/min离心10 min,弃上清,菌体用等体积的PBS洗涤1次,用20 mL PBS重悬菌体,超声波破碎,离心收集裂解物的上清,制备电泳样品,用15%的聚丙烯酰胺凝胶进行SDS-PAGE分析。
吸取2 mL Ni-NTA His·Bind Resin装于填充柱中,加入5倍柱体积的结合缓冲液进行柱平衡;用超声波破碎后的菌液上清重悬亲和树脂,重悬后的混合物置于100 mL烧杯中,烧杯中放入转子,将烧杯固定在冰浴盒中,置于磁力搅拌器上,缓慢搅拌30 min;将搅拌后的混合物重新装入柱中,液体滴尽后加入50倍柱体积的清洗缓冲液洗涤,洗涤完成后加入2倍柱体积的洗脱缓冲液洗脱蛋白,对洗脱的蛋白溶液进行SDS-PAGE分析;将洗脱液10 mL置于超滤管中,4℃、5500 r/min离心60 min,再加入PBS溶液使总体积至10 mL,4℃、6000 r/min离心60 min,重复3次,最后浓缩至2 mL体积;SDSPAGE分析浓缩后的蛋白溶液,用BCA蛋白定量试剂盒测定蛋白浓度后于-20℃保存备用。
1.4 ELISA分析Lsa20蛋白与LN的黏附作用
1.4.1 固定LN 用包被液将鼠源LN溶液稀释至10 μg/mL后加到96孔板中,每孔100 μL,于4℃过夜;弃去板中液体,用洗涤液PBST洗涤96孔板3次;每孔加入无蛋白封闭液200 μL,37℃封闭1 h;用洗涤液PBST洗涤96孔板3次,加入以保温液倍比稀释的 Lsa20(浓度依次为 1、0.5、0.25、0.125、0.0625、0.031 25、0.0156、0.0078 μmol/L),每孔 100 μL,每个稀释度各3孔,同时设定空白对照(不加孵育蛋白,只加保温液),37℃孵育1 h;用PBST洗板3次,加入抗 His单抗(1∶1000稀释),每孔 100 μL,置37℃孵育1 h;用PBST洗板3次,用保温液将HRP标记的山羊抗鼠IgG(1∶5000)稀释后加入反应孔中,每孔100 μL,置37℃孵育1 h;用PBST洗板3次,加入TMB底物显色液,每孔100 μL,置室温避光显色10 min;加入终止液,每孔100 μL,室温放置5 min;用酶联仪测定各孔的D450nm值,记录并分析数据。
1.4.2 固定Lsa20 Lsa20作为固定蛋白,LN作为孵育蛋白,其他步骤与1.4.1基本相同。另外,Lsa20包被浓度为10 μg/mL,每孔100 μL;LN加入浓度依次为40、20、10、5、2.5、1.25、0.625、0.3125 μg/mL;一抗为兔抗小鼠LN多抗,二抗为HRP标记的山羊抗兔二抗。
1.4.3 数据分析和曲线拟合 采用GraphPad 5.0软件进行,方法选择单一位点结合曲线(one-site bind⁃ing hyperbola)。根据ELISA测定的解离常数kd,按照下式计算:

其中x为Lsa20蛋白浓度,y为光吸收值,Bmax为由曲线推算的最大光吸收值。
1.5 流式细胞术分析
传代培养COS-7细胞,用含10%胎牛血清的RPMI-1640培养基培养至90%融合,EDTA消化后用PBS洗涤重悬细胞,按细胞数量1×106/管分装到一定数量的EP管中,500 r/min离心10 min,弃上清;向EP管中加入终浓度为50 μg/mL的蛋白样品,重悬细胞,同时直接加入等量PBS作为空白对照,4℃孵育1 h,离心弃上清;向EP管中加入500 μL PBS重悬细胞,离心弃上清,重复洗涤3次;向洗涤后的细胞中加入抗His单抗,4℃孵育1 h,离心弃上清;向洗涤后的细胞中加入含FITC标签的山羊抗小鼠二抗,4℃避光孵育1 h,离心弃上清;向每个样品中加入500 μL PBS重悬细胞,用流式细胞仪检测。
1.6 间接免疫荧光分析
取2瓶培养好的COS-7细胞,经EDTA消化后,用10 mL PBS将所有细胞重悬,加入提前放置盖玻片的24孔板内,过夜,使细胞长至70%~80%,500 r/min离心10 min,弃上清;每孔加入一定量纯化的Lsa20蛋白,并用RPMI-1640培养基定容至1 mL,蛋白浓度为100 μg/mL,同时以未加Lsa20蛋白、仅加培养基(含血清)的孔作为阴性对照,完成加样后将24孔板在冰上孵育60 min,吸取孔中培养基,细胞用PBS溶液洗3次,每次5 min;加入含4%多聚甲醛的PBS溶液,室温固定15 min,结束后用PBS溶液洗3次;加入含3%胎牛血清的PBS溶液500 μL,室温孵育30 min进行封闭;加入抗His单抗,用细胞培养基1∶200稀释,室温孵育60 min;用PBS溶液洗3次,每次5 min;加入FITC标记的山羊抗小鼠IgG,用细胞培养基1∶1000稀释,室温孵育30 min;用PBS洗3次,每次5 min;用DAPI对细胞核染色10 min,用PBS洗2次,每次5 min;在载玻片上滴少量的抗萃灭封片剂,小心地将盖玻片取出,将样品面朝下,缓慢地将盖玻片盖于载玻片上,待抗萃灭封片剂干燥后在荧光显微镜下观察。
2 结果
2.1 Lsa20在大肠杆菌中的表达纯化
按前述方法构建表达Lsa20的重组大肠杆菌BL21(DE3)/pET28a-Lsa20和对照菌株BL21(DE3)/pET28a,同时以不含质粒的大肠杆菌BL21(DE3)作为空白对照,对前2株菌进行IPTG诱导及纯化浓缩,分别进行SDS-PAGE分析,结果如图1A。与对照菌株相比,重组菌在相对分子质量约23×103处有明显的特异蛋白表达条带,与预期的Lsa20蛋白大小相符。
利用Ni-NTA His·Bind Resin进行纯化,收集目的蛋白,经Milipore超滤离心管浓缩后进行SDSPAGE分析(图1B),凝胶成像分析显示蛋白纯度高于90%,用BCA蛋白定量试剂盒定量,浓度为2.0 mg/mL,可用于后续相互作用实验。
2.2 间接ELISA分析
用间接ELISA分析在固定条件下目标蛋白之间的相互作用。结果显示,Lsa20与LN之间有较强的相互作用。当LN为固定相时,孵育倍比稀释的Lsa20蛋白后,吸光度值与浓度形成相应的浓度依赖性,当蛋白浓度达1 μmol/L左右时,二者结合趋于饱和(图2A)。用GraphPad 5.0软件分析相应的数据,可得出解离常数 kd约为(27.23±2.53) nmol/L。同时,以Lsa20为固定相,孵育浓度倍比稀释的LN后吸光度值与浓度形成相应的浓度依赖性,并于蛋白孵育10 μg/mL LN时趋于饱和(图2B)。
2.3 流式细胞术分析

图1 重组Lsa20蛋白的表达(A)和纯化(B)M:蛋白marker;1:BL21(DE3);2:BL21(DE3)/pET-28a;3:BL21(DE3)/pET-Lsa20;4:超声波裂解上清;5:穿过峰样品;6:纯化的目标蛋白

图2 ELISA分析Lsa20与LN的相互作用A:LN为固定相;B:Lsa20为固定相
进一步利用流式细胞术分析细胞表面LN与Lsa20之间的相互作用,结果如图3。与用PBS孵育的空白对照相比,Lsa20孵育后荧光信号明显偏移,这表明Lsa20能够识别靶细胞表面的LN,且二者之间具有较强的相互作用。
2.4 间接免疫荧光分析
将重组Lsa20与COS-7细胞共孵育,用His-tag单抗进行间接免疫荧光分析。结果显示,与只加细胞培养液的对照相比,Lsa20能够黏附到COS-7细胞表面,具有LN结合蛋白的特征(图4)。

图3 流式细胞术分析Lsa20蛋白的黏附作用紫色:PBS(空白对照);绿色:重组Lsa20(样品峰)
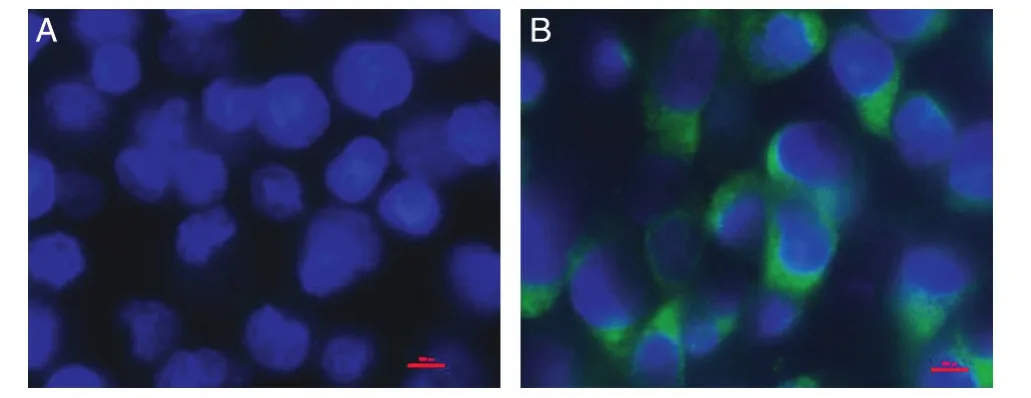
图4 间接免疫荧光法分析Lsa20的黏附作用A:加入细胞培养液对照;B:加入Lsa20
3 讨论
在MSCRAMM的研究中,ELISA、流式细胞术和间接免疫荧光是最常用的方法[10-12]。这是因为,一方面这几种方法操作简单,成本相对较低,易于进行;另一方面,这些方法的结果相对可靠,使用广泛,认可度较高。另有研究表明,COS-7细胞的细胞外基质以LN分子为主,可用于研究LN结合蛋白的细胞模型[13]。在本研究中,我们同样是利用这几种方法,以钩端螺旋体Lsa20蛋白为研究对象,以COS-7细胞为细胞模型,建立了研究LBP生物学性质的实验技术,为后续研究和鉴定新的该类型蛋白奠定了良好的实验基础。
在研究中我们发现,利用ELISA进行目标蛋白与LN相互作用亲和力测定实验时,封闭液对实验结果的影响很大,特别是选用常规的脱脂奶粉进行实验时背景值相对较高(未附相关数据)。因此,经过实验筛选,最终选择采用商品化的无蛋白封闭液进行(该封闭液中发挥作用的是非蛋白类生物分子,一般不会与重组蛋白发生相互作用),最终取得了较为理想的实验结果。
[1] Kline K A,Fälker S,Dahlberg S,et al.Bacterial adhesins in host-microbe interactions[J].Cell Host Microbe,2009,5(6):580-592.
[2] Hori K,Matsumoto S.Bacterial adhesion:from mechanism to control[J].Biochem Eng J,2010,48(3):424-434.
[3] Chagnot C,Listrat A,Astruc T,et al.Bacterial adhesion to animal tissues:protein determinants for recognition of extracel⁃lular matrix components[J].Cell Microbiol,2012,14(11):1687-1696.
[4]Patti J M,Allen B L,McGavin M J,et al.MSCRAMM-medi⁃ated adherence ofmicroorganismsto hosttissues[J].Annu Rev Microbiol,1994,48:585-617.
[5] Hammerschmidt S.Surface-exposed adherence molecules of Streptococcus pneumoniae[J].Methods Mol Biol,2009,470(1):29-45.
[6] Singh B,Fleury C,Jalalvand F,et al.Human pathogens uti⁃lize host extracellular matrix proteinslaminin and collagen for adhesion and invasion of the host[J].FEMS Microbiol Rev,2012,36(6):1122-1180.
[7] Agarwal V,Hammerschmidt S.Cdc42 and the phosphatidylino⁃sitol 3-kinase-Akt pathway are essential for PspC-mediated internalization of pneumococci by respiratory epithelial cells[J].J Biol Chem,2009,284(29):19427-19436.
[8] Meningitis C M.Cellular and molecular basis[M].UK:CAB International,2013:118-132.
[9] Vieira M L,Fernandes L G,Domingos R F,et al.Leptospir⁃al extracellular matrix adhesins as mediators of pathogen-host interactions[J].FEMS Microbiol Lett,2014,352(2):129-139.
[10]Linke C,Caradoc-Davies T T,Young P G,et al.The lam⁃inin-binding protein Lbp from Streptococcus pyogenes is a zinc receptor[J].J Bacteriol,2009,191(18):5814-5823.
[11]Vazquez V,Liang X,Horndahl J K,et al.Fibrinogen is a li⁃gand for the Staphylococcus aureus microbial surface compo⁃nents recognizing adhesive matrix molecules(MSCRAMM)bone sialoprotein-binding protein(Bbp)[J].J Biol Chem,2011,286(34):29797-29805.
[12]Verma A,Brissette C A,Bowman A,et al.Borrelia burgdor⁃feriBmpA isa laminin-binding protein[J].InfectImmun,2009,77(11):4940-4946.
[13]张皓.钩端螺旋体对各种宿主细胞及ECM分子的黏附和作用[D].杭州:浙江大学,2010.

