Rictor在贲门癌组织中的表达及临床意义
张鹏飞,刘永萱,张亚利,马志坤,梁 硕,冯笑山
Rictor在贲门癌组织中的表达及临床意义
张鹏飞,刘永萱,张亚利,马志坤,梁 硕,冯笑山
目的 检测Rictor在贲门癌及相应癌旁正常组织中的表达差异,分析其与贲门癌临床病理之间及预后的关系,判断其作为贲门癌早期诊断及预后指标的可能性。方法 采用荧光定量PCR方法、免疫组织化学S-P法检测Rictor在30例贲门癌组织及相应癌旁正常组织中的表达情况。结果 贲门癌癌旁组织中Rictor基因拷贝数为9.10×108~11.12×109,贲门癌组织中为7.78×105~8.58×106;Rictor在贲门癌组织及相应癌旁正常组织中的阳性表达率分别为 56.7%(17/30)、76.7%(23/30),统计学处理有显著性差异(P<0.05)。Rictor在贲门癌组织中表达降低与患者的年龄、性别、TNM分期及淋巴结转移均无关(P>0.05),与肿瘤分化程度相关(P<0.05)。结论 Rictor在贲门癌旁组织中的表达明显高于贲门癌组织中的表达,初步推断该基因的表达与癌症进程相关,有可能成为贲门癌早期诊断、治疗以及预测贲门癌患者预后的具有重要应用价值的指标。
贲门癌;Rictor;荧光定量PCR;免疫组织化学
贲门癌(Gastric cardia adenocarcinoma, GCA)是指发生于贲门黏膜上皮以及贲门腺体的恶性肿瘤,是迄今为止严重危害人类生命和健康的疾病之一,具有高发病率和死亡率的特点。其病灶原发于或中心位于食管胃黏膜交界线向下2 cm范围,主要类型为腺癌。Rictor (rapamycin-insensitive companion of mTOR)为mTOR复合物2(mTORC2) 中一个新确定的蛋白成员,是雷帕霉素不敏感复合物mTORC2的特征性支架蛋白,与 mTOR、mSin1 和 Protor 四者一起组成mTORC2,Rictor缺失会使mTOR无法发挥其激酶活性。Rictor作为mTORC2复合物中的一员,在肿瘤增殖、迁移、侵袭和上皮间质转化(epithelial-mesenchymal transition,EMT) 等过程中发挥着重要作用。本研究欲通过荧光定量PCR和免疫组化的方法检测贲门癌组织及相应癌旁组织中Rictor的表达情况,探讨Rictor与贲门癌发生发展和临床病理特征的关系,旨在为探索新的病原监测和癌症风险评估方法提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验标本 收集2012年2月至2013年10月由河南科技大学第一附属医院确诊并行贲门癌根治术的原发性贲门癌组织及其相应癌旁正常组织(距癌组织5 cm以上)标本各30例,所有术前病例未经放疗和化疗。男22例,女8例;年龄42-79岁:≤60岁 14例, >60 岁16例;高分化9例,中分化14例,低分化7例;侵及黏膜下层及以下0例,肌层3例,外膜及以上27例;淋巴结转移阳性24例,阴性6例。
1.1.2 主要试剂 PrimeScript II逆转录酶试剂盒,通用型DNA纯化回收试剂盒,质粒小提试剂盒均购自天根公司,鼠抗人Rictor单克隆抗体,购自美国Santa Cruze公司,即用型SP超敏免疫组化试剂盒,DAB显色试剂盒均购自福州迈新生物技术有限公司。
1.2 荧光定量PCR法
1.2.1 样本总RNA的制备 将贲门癌及相应贲门癌癌旁组织用研钵在液氮下碾碎,加入500 μL DMEM培养基重悬,于4 ℃ 8 000 r/min离心4 min,取上清300 μL至1.5 mL离心管中;加入500 μL TRIzol试剂,轻柔上下颠倒混匀2~3 min;加入170 μL三氯甲烷,剧烈上下颠倒震荡3 min后,4 ℃ 12 000 r/min离心10 min;取500 μL上清液至一支新的1.5 mL离心管中,加入等体积异丙醇后震荡混匀1 min,室温放置10 min后4 ℃ 12 000 r/min离心10 min;弃去管内上清液,加入600 μL 75%酒精,上下颠倒混匀,4 ℃ 12 000 r/min离心4 min;弃去上清,将离心管置于超净台内室温风干15 min后,加入35 μL经DEPC处理的高压灭菌蒸馏水溶解沉淀,于-70 ℃保存备用。
1.2.2 cDNA第一链合成 参照PrimeScript II逆转录酶试剂盒使用说明书对所抽提的样品总RNA进行反转录,操作步骤如下:使用Oligo dT Primer(50 μM)进行cDNA第一链的合成。在PCR管中依次加入5 μL模板RNA,1 μLdNTP Mixture(10 mM each),1 μL Oligo dT Primer,加RNase Free dH2O补足至10 μL,轻柔混匀;65 ℃水浴5 min后,迅速置于冰上冷却;在上述混合溶液中依次加入4 μL 5×PrimeScript II Buffer,1 μL PrimeScript II RTase(200 U/μL),0.5 μL RNase Inhibitor(40 U/μL),加入RNase Free dH2O补足至20 μL,轻柔混匀;逆转录反应程序为:42 ℃ 60 min,之后95 ℃ 5 min,用以灭活PrimeScript RTase;用超微量紫外-可见光分光光度计测定所获得的cDNA的纯度和浓度,保存于-20 ℃备用。
1.2.3 Rictor基因引物的合成 根据GenBank数据库已发表的Rictor基因序列,利用Primer Express 2.0软件设计并合成用于检测Rictor基因的引物,序列见表1。引物序列经BLAST检索验证,均具有很强的特异性。以之前实验所获得的cDNA为模板,对Rictor基因进行PCR扩增。PCR反应总体系为50 μL:100 ng模板cDNA,5 μL 10×PCR buffer,4 μL10 mmol/L dNTP混合物,rTaq DNA聚合酶2.5 U,上、下游引物各10 pmol,加RNase Free dH2O补足至50 μL。PCR反应程序为预变性温度及时间95℃,10 min,变性温度及时间 95℃,15 s,退火温度及时间60℃,1min,延伸温度及时间72℃,20 s,循环数40,最后延伸温度及时间72℃,10 min。
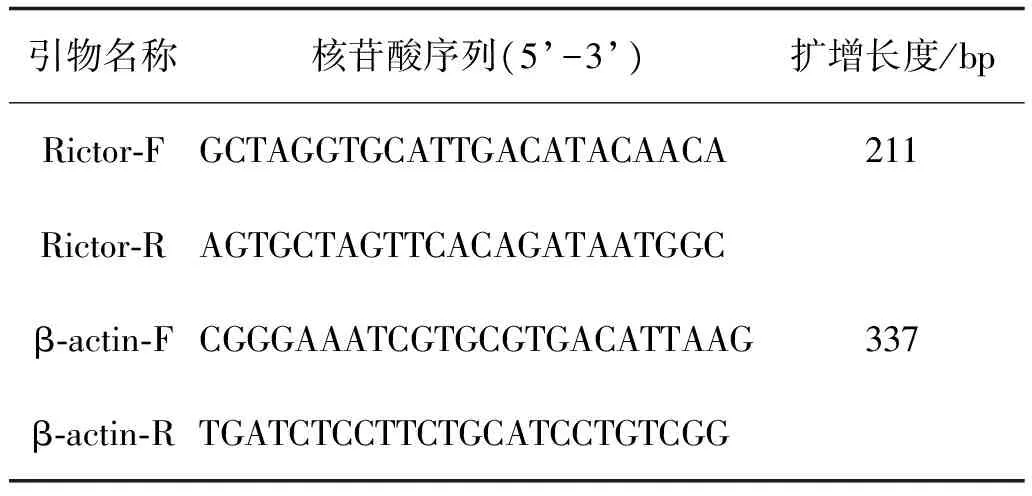
表1 定量PCR检测Rictor基因引物
1.2.4 实时定量PCR检测Rictor基因拷贝数 对样品进行实时定量PCR测定的反应体系和反应条件同上,分别对从30例新鲜贲门癌组织和30例贲门癌癌旁组织中获得的cDNA样品进行检测,同时设不加模板的阴性对照(NTC)和食管癌细胞系TE-1 KYSE细胞获得的cDNA模板为阳性对照。根据测得的Ct值与标准曲线得到样品中Rictor基因拷贝数,其与相应组织样品重量(μg)的比值即为单位重量组织中Rictor基因的拷贝数。
1.3 免疫组化法 标本在10%福尔马林液中固定后用石蜡包埋,再连续厚度4 μm切片,石蜡切片然后脱蜡,在高温pH 9.0 EDTA抗原修复处理液中完全修复6 min,取出自然降至常温,内源性过氧化物酶以3%的H2O2灭活,再用一抗二抗作用后,在DAB显色且在光镜下控制呈色,后用苏木素复染脱色,最后中性树胶封片。
结果判定标准 结果判定采用双盲法,并有两位病理科医师独立观察每张切片后一起作出判定,用低倍镜和高倍镜观察切片,判断阳性反应标准根据以下两个方面:①按切片中显色癌细胞数比例计分,阳性细胞数<25%为0,25%~50%为1,51%~75%为2,>75%为3。②按切片中癌细胞显色强度计分:染色强度计分无染色为0,淡黄色为1,黄色为2,深黄色为3。A+B>3分记为阳性,≤3分记为阴性。
1.4 统计学处理 关于荧光定量PCR实验结果运用SAS 8.2统计学软件对数据进行统计学处理,用方差齐性检验和正态分布检验对数据进行验证,使用Wilcoxon秩和检验对数据进行统计学分析。关于免疫组化结果运用分类资料的比较χ2检验和Fisher′s确切概率法,用SPSS 17.0进行统计分析,以P<0.05差异有统计学意义。
2 结果
2.1 PCR产物鉴定 Rictor基因标准品的PCR扩增产物经2%琼脂糖凝胶电泳检测,获得大小为211 bp的条带,与预期结果相符,且无非特异性条带产生(图1)。样本Rictor基因拷贝数的测定:取各样品cDNA 50~100 ng,以此为模板用定量PCR检测Rictor基因,根据Ct值和标准曲线计算Rictor基因的拷贝数。每组数据均呈偏态分布,其中贲门癌组织Rictor基因拷贝数为7.78×105至8.58×106之间,贲门癌癌旁组织为9.10×108至11.12×109之间,统计学分析结果为P<0.01,表明贲门癌组织Rictor基因拷贝数与贲门癌癌旁正常组织中Rictor基因拷贝数有显著差异,Rictor基因拷贝数在贲门癌癌旁正常组织中显著增高。
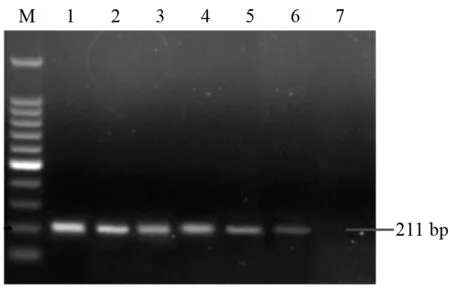
图1 Rictor标准品质粒PCR检测结果
注:M:DNA 标准 DL 100;1-6:梯度稀释的标准品质粒;7:阴性对照。
2.2 Rictor蛋白在贲门癌组织中的表达 Rictor在贲门癌组织及相应癌旁正常组织中的阳性表达率分别为 56.7%(17/30)、76.7%(23/30),统计学处理有显著性差异(P<0.01)。贲门癌组织中Rictor蛋白的表达显著低于其在相应癌旁正常组织中的表达(P<0.01),见表2。免疫组化染色结果显示,在贲门癌癌旁正常组织细胞质中Rictor蛋白染色为棕褐色;而在贲门癌组织石蜡切片中,Rictor蛋白多数呈棕黄色,棕褐色染色部分较少。2组样品中Rictor蛋白表达具有统计学差异,且在贲门癌癌旁正常组织中Rictor的表达明显增强,P<0.100(图2)。

表2 Rictor在贲门癌组织及相应癌旁正常组织中的表达 例(%)
注:P<0.01。
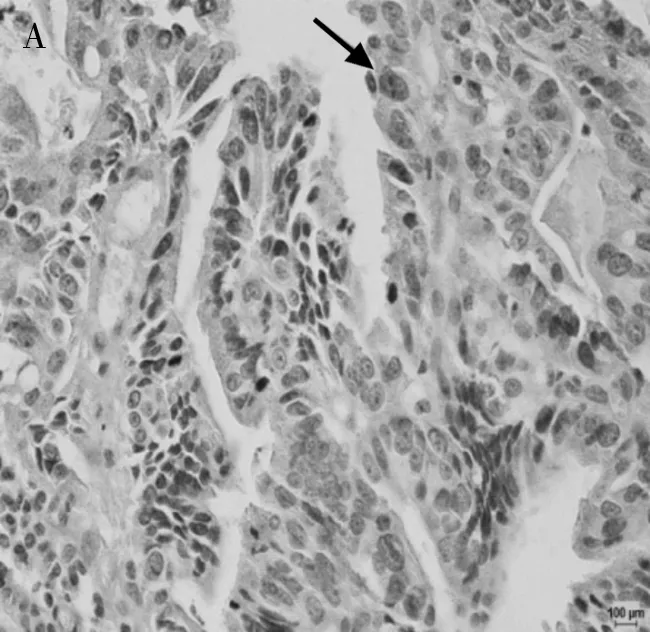
A 贲门癌Rictor胞浆表达如箭头所示(SP,×400)
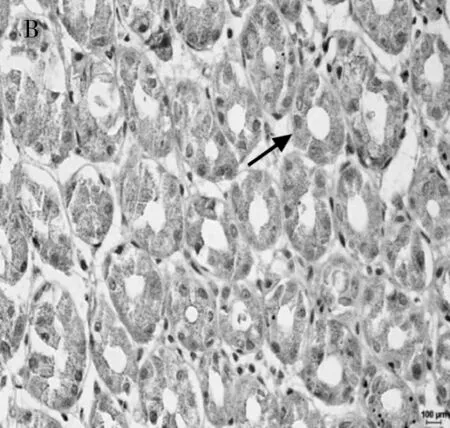
B 贲门癌癌旁Rictor胞浆表达如箭头所示(SP,×400)
2.3 Rictor表达与临床病理参数之间的相关性 见表3。
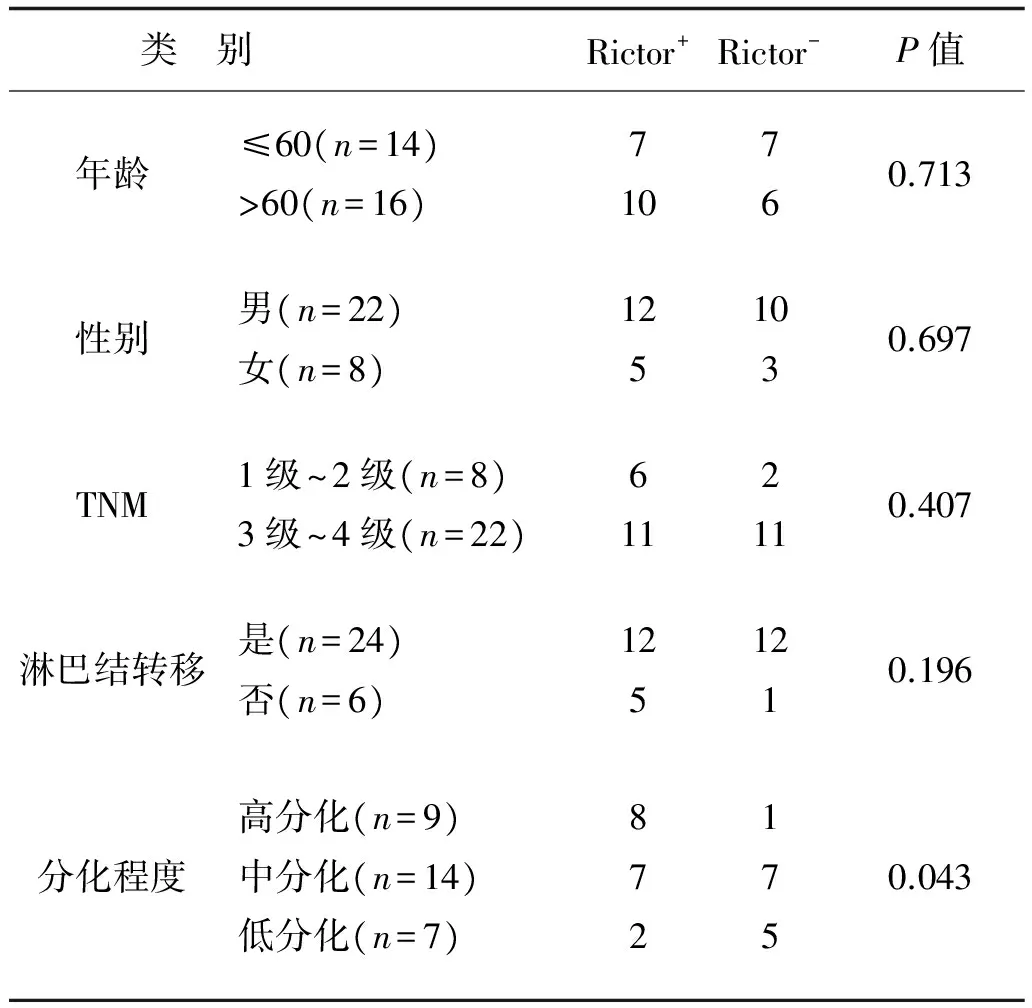
表3 Rictor表达与临床资料之间的相关性
注:Rictor表达与年龄、性别、TNM分级、淋巴结轻移无关,与分化程度有关。
3 讨论
贲门癌发生在胃贲门部,是常见的胃肠道恶性肿瘤之一,远处转移是贲门癌重要的生物学特性,亦是其难以根治的主要原因[1]。我国为GCA高发区,且发病率呈逐年上升趋势[2]。从组织病理学上分析,GCA属于腺癌,这与食管鳞癌存在显著不同。从流行病学特征上看,GCA与胃远侧部位肿瘤具有不一致性,因此又不能简单地归类于胃癌[3-6]。基于上述原因,研究者们近年来将贲门癌作为一种独立的疾病来研究,对其分子学基础的探索也越来越重视。
Akt/PKB信号通路是细胞内信号传导的重要环节,同时也是癌症研究的关键靶标;PI3K/AKT/mTOR信号传导通路被认为是蛋白质合成的主要信号调节通路,参与调节细胞增殖、分化、迁移等[7],也与肿瘤的发生、发展、治疗与转归有关[8]。如乳腺癌、胃肠道间质肿瘤、肝细胞癌和非小细胞肺癌中均发现PI3K/AKT/mTOR通路的异常调控[9-10]。研究人员于1991年在酵母的突变株中发现并鉴定了雷帕霉素靶蛋白(Target of rapamycin, TOR),近年来研究者们发现,mTOR相关的信号通路复杂且涉及面广泛,其中多个元素的调控异常都与肿瘤的发生密切相关[11]。研究证明,mTOR存在于两种完全不同的多蛋白复合体——雷帕霉素敏感复合体(mammalian target of rapamycin complex 1,mTORC1)和雷帕霉素不敏感复合体(mammalian target of rapamycin complex 2,mTORC2)。磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-Kinase, PI3K)的活化需要mTORC1和mTORC2的参与,前者磷酸化Akt(Thr308)位点,后者磷酸化Akt(Ser473)位点[12]。mTORC2由mTOR、mLST8、mSin1和Rictor(Rapamycin intensitive companion of mTOR)等构成[13],是调节细胞骨架重构和细胞增殖的关键蛋白激酶复合体。mTORC2对Akt(Ser473)位点进行磷酸化,调控细胞生存、代谢、增殖、细胞骨架的合成等过程[14]。Rictor由1 078个氨基酸残基组成,作为构成mTORC2的关键分子,通过依赖和非依赖mTOR的方式调控肿瘤细胞的细胞周期、侵袭和转移同时也是mTORC2发挥蛋白激酶活性的关键蛋白[15-20]。雷帕霉素是上世纪研制出的特异性大环内酯类免疫抑制剂,如今一系列雷帕霉素类似物:CC1779、RAD001、AP23573等药物对肾癌、乳腺癌、前列腺癌、非小细胞性肺癌有治疗作用,其中雷帕霉素对由于抑癌基因(phosphatase and tensin homolog deleted on chromosome ten, PTEN)失活而导致PTEN/PI3K/AKT/mTOR信号通路激活的肿瘤效果显著[21]。有报道显示,Rictor在恶性胶质瘤、乳腺癌和乳头状肾细胞癌组织中具有高表达[22-24],将降低Rictor基因表达后的人前列腺癌细胞注入裸鼠,发现其成瘤能力被抑制,且Rictor缺失的小鼠对前列腺癌的抵抗力更强[25]。本研究通过荧光定量PCR和免疫组化的方法检测Rictor在贲门癌中的mRNA及蛋白水平表达情况,检测结果显示,Rictor在贲门癌组织和贲门癌癌旁组织中均有不同程度的表达,贲门癌癌旁组织的Rictor拷贝数显著高于其在贲门癌组织中的拷贝数,Rictor在贲门癌组织中的表达率低于其在相应贲门癌旁正常组织中的表达率,本研究中免疫组化结果与荧光定量PCR方法检测结果一致,Rictor在贲门癌组织中表达均明显低于相应癌旁正常组织中的表达,这也与报道显示Rictor在子宫内膜癌、前列腺癌和肾癌中表达量较低相一致[26]。另外,本研究对Rictor基因在贲门癌组织样本中的表达情况结合各临床资料统计发现,Rictor的低表达与贲门癌的分化程度有关,有待于进一步研究。加之目前学术界对Rictor调控肿瘤细胞发生和发展的机理尚未探明,所以研究Rictor调控肿瘤细胞的相关作用机制对今后开发临床治疗贲门癌的新靶点具有重要意义。
[1] 韩伟,王正彩,周敏,等.TAMs在贲门癌和非贲门癌组织中的表达及其临床意义[J].现代生物医学进展,2013,13(31):6073-6076.
[2] 庄则豪,王立东,高珊珊,等.河南食管癌高发区食管和贲门癌组织中粘蛋白1的表达[J].郑州大学学报: 医学版,2002,37(6):774-777.
[3] She-Gan Gao, Li-Dong Wang, Zong-Min Fan, et al.Histochemical studies on intestinal metaplasia adjacent to gastric cardia adenocarcinoma in subjects at high-incidence area in Henan, North China[J].World J Gastroenterol,2005,11(30):4634-4637.
[4] 郭炜,周荣秒,李琰,等.XPC基因多态性与食管鳞状细胞癌、贲门腺癌的发病风险[J].肿瘤防治研究,2007,34(3):209-213.
[5] Wang LD,Zheng S, Zheng ZY, et al. Primary adenocarcinoma of lower esophagus,esophagogastric junction and gastric cardia:in special reference to China[J].World J Gastroenterol,2003,9(6):1156-1164.
[6] 王益民,郭炜,张秀凤,等.丝氨酸羟甲基转移酶基因C1420T多态性与食管鳞癌、贲门腺癌易感性的关系[J].癌症,2006,25(3):281-286.
[7] Lee Su-Lin,Chou Chih-Chien,Chuang Hsiao-Ching et al. Functional role of mTORC2 versus integrin-linked kinase in mediating ser473-Akt phosphorylation in PTEN-negative prostate and breast cancer cell lines[J]. Plos One,2013,8(6):67149.
[8] 武强,赵全年,宋卫东.PI3K/Akt/mTOR信号传导通路在肿瘤的研究进展[J].疾病监测与控制,2013,7(6):346-347.
[9] Misra UK,Pizzo SV.Evidence for a pro-proliferative feedback loop in prostate cancer: the role of Epac1 and COX-2-dependent pathways[J]. Plos One,2013,8(4):63150.
[10]Vadlakonda Lakshmipathi,Pasupuleti Mukesh,Pallu Reddanna. Role of PI3K-AKT-mTOR and wnt signaling pathways in transition of G1-S phase of cell cycle in cancer cells[J].Front Oncol,2013,3:85.
[11]Huang Yu,Xi Qingsong,Chen Yu,et al.A dual mTORC1 and mTORC2 inhibitor shows antitumor activity in esophageal squamous cell carcinoma cells and sensitizes them to cisplatin[J].Anticancer Drugs,2013,24(9):889-898.
[12]王宇亮.PI3K/AKT/mTOR通路调控CA916798:CA916798诱导肺癌顺铂耐药的机制研究[D].西安:第三军医大学,2013.
[13]Sun Shi-Yong.mTOR kinase inhibitors as potential cancer therapeutic drugs[J].Cancer Lett,2013,340(1):1-8.
[14]徐颂.mTORC1通过β-catenin信号通路调控RANKL/OPG和破骨细胞形成[D].广州:南方医科大学,2013.
[15]McDonald PC,Oloumi A,Mills J,et al.Rictor and integrin-linked kinase interact and regulate Akt phosphorylation and cancer cell survival[J]. Cancer Res,2008,68(6):1618-1624.
[16]Gulhati P,Bowen KA,Liu J,et al.mTORC1 and mTORC2 regulate EMT, motility, and metastasis of colorectal cancer via RhoA and Rac1 signaling pathways[J].Cancer Res,2011,71(9):3246-3256.
[17]Goncharova EA,Goncharov DA,Li Hua,et al.mTORC2 is required for proliferation and survival of TSC2-null cells[J].Mol Cell Bio,2011,31(12):2484-2498.
[18]Zhang Fei,Zhang Xiaofang,Li Menghui, et al. mTOR complex component Rictor interacts with PKCzeta and regulates cancer cell metastasis[J].Cancer Res,2010,70(22):9360-9370.
[19]Gao Daming,Wan Lixin,Inuzuka Hiroyuki,et al.Rictor forms a complex with Cullin-1 to promote SGK1 ubiquitination and destruction[J].Mol Cell,2010,39(5):797-808.
[20]Das Gowry,Shiras Anjali,Shanmuganandam Karthik, et al. Rictor regulates MMP-9 activity and invasion through Raf-1-MEK-ERK signaling pathway in glioma cells[J].Mol Cancinog,2011,50(6):412-423.
[21]Brosens Jan J,Lam EW.Progesterone and FOXO1 signaling: harnessing cellular senescence for the treatment of ovarian cancer[J].Cell Cycle,2013,12(11):1660-1661.
[22]Haflidadóttir BS,Larne O,Martin M,et al.Upregulation of miR-96 enhances cellular proliferation of prostate cancer cells through FOXO1[J].Plos One,2013,8(8):72400.
[23]Sen S,Kawahara B,Fukuto J,et al.Induction of a feed forward pro-apoptotic mechanistic loop by nitric oxide in a human breast cancer model[J]. Plos One,2013,8(8):70593.
[24]陈旭升. Rictor在肾癌中的表达及其在侵袭转移中的功能研究[D].天津:天津医科大学,2012.
[25]Guertin DA,Stevens DM,Saitoh M, et al. mTOR complex 2 is required for the development of prostate cancer induced by Pten loss in mice[J].Cancer Cell,2009,15(2):148-159.
[26]Lee Do Y,Choi BK,Lee DG, et al. 4-1BB signaling activates the t cell factor 1 effector/β-catenin pathway with delayed kinetics via ERK signaling and delayed PI3K/AKT activation to promote the proliferation of CD8+T Cells[J]. Plos One,2013,8(7):69677.
Expressions and Clinical Significances of Rictor in Gastric Cardiac Cancer
ZHANG Peng-fei, LIU Yong-xuan, ZHANG Ya-li, et al
(First Affiliated Hospital, Henan University of Science & Technology, Luoyang 471003, China)
ObjectiveTo detect the expressions of Rictor in gastric cardiac adenocarcinoma(GCA) and corresponding adjacent normal tissues, analyze the relationship between it and clinical pathological features and prognosis of gastric cardia cancer, judge its possibility as early diagnosis and prognostic index of gastric cardia cancer.MethodsThe expressions of Rictor in 30 cases of cardiac carcinoma tissues and 30 cases of the corresponding adjacent normal tissues were measured by the fluorescent quantitative PCR method and immunohistochemistry S-P method.ResultsRictor gene copy number of adjacent tissues was 9.10×108~11.12×109. GCA was 7.78×105~8.58×106. The expression of Rictor protein in the corresponding adjacent normal tissues was 76.7%(23/30), and the GCA tissue was 56.7%(17/30). There existed significant difference between them(P<0.05). There were no significant correlations of the decreased expression of Rictor with the age,sex,TNM and lymph node metastasis(P>0.05),but tumor differentiation(P<0.05).ConclusionThe expression levels of Rictor in adjacent tissues is much higher than those in the GCA tissues (P<0.01). Preliminary inference of the expression of Rictor is related with the progression of cancer, therefore, it may be used in the early diagnosis,therapy and prognosis in GCA.
carcinoma of gastric cardia;Rictor;quantitative PCR;immunohistochemistry
2015-01-29
河南科技大学第一附属医院,河南洛阳 471003
张鹏飞(1988-),男,河南平顶山人,硕士研究生,从事消化道肿瘤的基础与临床研究。
冯笑山,男,博士,教授,E-mail:samfeng137@hotmail.com
R735.2
A
1672-688X(2015)01-0009-05

