剑麻提取液对台湾青枣采后生理及贮藏效果的影响
张鲁斌 常金梅 詹儒林 吴晓燕
摘 要 探讨剑麻提取液在台湾青枣果实贮藏保鲜上的作用。以剑麻提取液为材料,浸泡处理台湾青枣采后果实,然后在常温条件下贮藏,研究剑麻提取液处理对台湾青枣果实采后生理及品质的影响。结果表明:剑麻提取液处理可有效降低果实失重率和腐烂率,延缓果实硬度、可溶性固形物含量、维生素C、可滴定酸的下降,保持了果实的品质;同时,剑麻提取液处理还提高了采后贮藏台湾青枣果实POD、CAT活性,减轻了台湾青枣细胞膜脂过氧化程度,从而有效延缓果实的衰老;剑麻提取液在台湾青枣贮藏保鲜上有良好的保鲜效果。
关键词 台湾青枣;剑麻提取液;采后生理;贮藏效果
中图分类号 S667.7 文献标识码 A
Effects of Agave americana Leaf Extracts Treatments on
Postharvest Physiology and Storage of
Ziziphus mauritiana Lamk(Taiwan Green Jujube)
ZHANG Lubin1, CHANG Jinmei1 *, ZHAN Rulin1, WU Xiaoyan2
1 South Subtropical Crops Research Institute, CATAS/Physiology and Technology of Tropical Horticultural
Products / Hainan Province Key Laboratory for Post-harvest, Zhanjiang, Guangdong 524091, China
2 Plant Protection Station of Jincheng, Jincheng, Shanxi 048000, China
Abstract The objective of the study is to investigate the effect of Agave americana leaf extracts on the storage of Ziziphus mauritiana Lamk(Taiwan green jujube). The fruits were soaked with Agave americana leaf extracts,and stored at(25±1)℃. The changes of postharvest physiology and fruit quality during storage were investigated. The results showed that A. americana leaf extracts treatments could significantly reduce rotting rate and weight losse, and increase SOD and CAT activity of the frui to reduce the degree of cell membrane lipid peroxidation. A. americana leaf extracts could delay fruit senescence and had a good fresh-keeping effect on Taiwan green jujube.
Key words Ziziphus mauritiana Lamk(Taiwan green jujube); Agave americana leaf extracts; Postharvest physiology; Storage effece
doi 10.3969/j.issn.1000-2561.2015.01.018
台湾青枣(Ziziphus mauritiana Lamk)又名毛叶枣、滇刺枣、印度枣等,属鼠李科枣属常绿果树[1]。其果实营养丰富,风味独特,富含大量维生素C、维生素B、胡萝卜素、钙、磷及少量核黄素等[2-3],是一种极具发展前景的果树。在中国云南、海南、广东、福建、广西、浙江等省(区)均有种植,且面积逐年扩大,产量不断上升[4]。但是,台湾青枣果实极易软化、失水皱缩、果面易黄化和褐变,果实易发病腐烂,严重影响果实的商品价值和使用品质,给果实的贮藏、运输和销售带来了很大的困难[5-6],严重制约了该产业的进一步发展。
剑麻作为一种纤维作物,含有丰富的甾体皂苷和果聚糖等物质,且有报道该类物质在医学领域有很重要的作用[7],其中果聚糖可以降低胆固醇,甾体皂苷对癌症、低血糖症、免疫系统和心血管疾病具有预防和控制的作用[8]。另有研究表明:剑麻类植物对于一些细菌、酵母菌以及霉菌有一定的抑制作用[9],且对于鸡、羊等一些动物的肠胃寄生虫有良好的杀灭作用[10-11]。另外剑麻提取液在芒果采后病害的防治中有显著效果,可以有效控制采后病害的发生[12]。
本研究之前曾发现剑麻叶片汁液对台湾青枣有较好的采后保鲜效果,而剑麻叶片汁液是剑麻生产的副产物,大多用来回田作为有机肥利用,在台湾青枣采后保鲜中目前尚无相关报道。本研究利用剑麻提取液对台湾青枣进行采后保鲜效果研究,以期为台湾青枣的采后保鲜技术提供新的思路,同时找出使剑麻副产品变废为宝、得到有效利用的途径。
1 材料与方法
1.1 材料
供试的台湾青枣品种为‘脆蜜,于2013年2月26日从南亚热带作物研究所台湾青枣基地采摘,成熟度为绿熟。挑选无病虫害、无机械损伤、果形端正、九成成熟的脆蜜台湾青枣。所用剑麻品种为番麻,由剑麻研究室提供,均为5年生剑麻待割麻叶。
1.2 方法
1.2.1 剑麻提取液的制备 称取1 000 g新鲜剑麻叶片,液氮研磨后,用2 L蒸馏水抽提3次,5 000 r/min离心5 min后,取上清,分别冷冻干燥浓缩至500 mL。取备用剑麻提取液对台湾青枣进行浸泡,每处理浸泡5 min,对照用自来水浸泡,晾干后,分装于塑料筐中,并用0.02 mm 聚乙烯薄膜袋套住进行保湿,置于(25±1)℃恒温条件下进行贮藏,每隔24 h进行观察取样,并记录实验结果。
1.2.2 指标测定方法 失重率=(果实原始质量-测定时质量)/果实原始质量×100%。
腐烂率统计:参照郑小林等[13]的方法。
果实硬度的测定:用手持式便携硬度计进行硬度测定,取其下压过程中最大应力值为果实硬度。每个青枣在其赤道部位选3个点进行测量,重复3次。
果肉中酶提取和活性测定:过氧化氢酶(CAT)的提取和活性测定参照Wang等[14]的方法。过氧化物酶(POD)的提取和活性测定参照Tian等[15]的方法。果肉中丙二醛(MDA)测定:参照Liu等[16]的方法。以上指标测定时重复3次。
可溶性固形物含量:采用手持折光仪(WYF-4)测定。
可滴定酸含量:采用酸碱滴定法测定[17]。
Vc含量:用2,6-二氯靛酚滴定法测定[17]。
1.3 数据统计分析及作图
应用excel软件对数据进行差异显著性分析。
2 结果与分析
2.1 剑麻提取液对台湾青枣果实腐烂率、果实硬度和失重率的影响
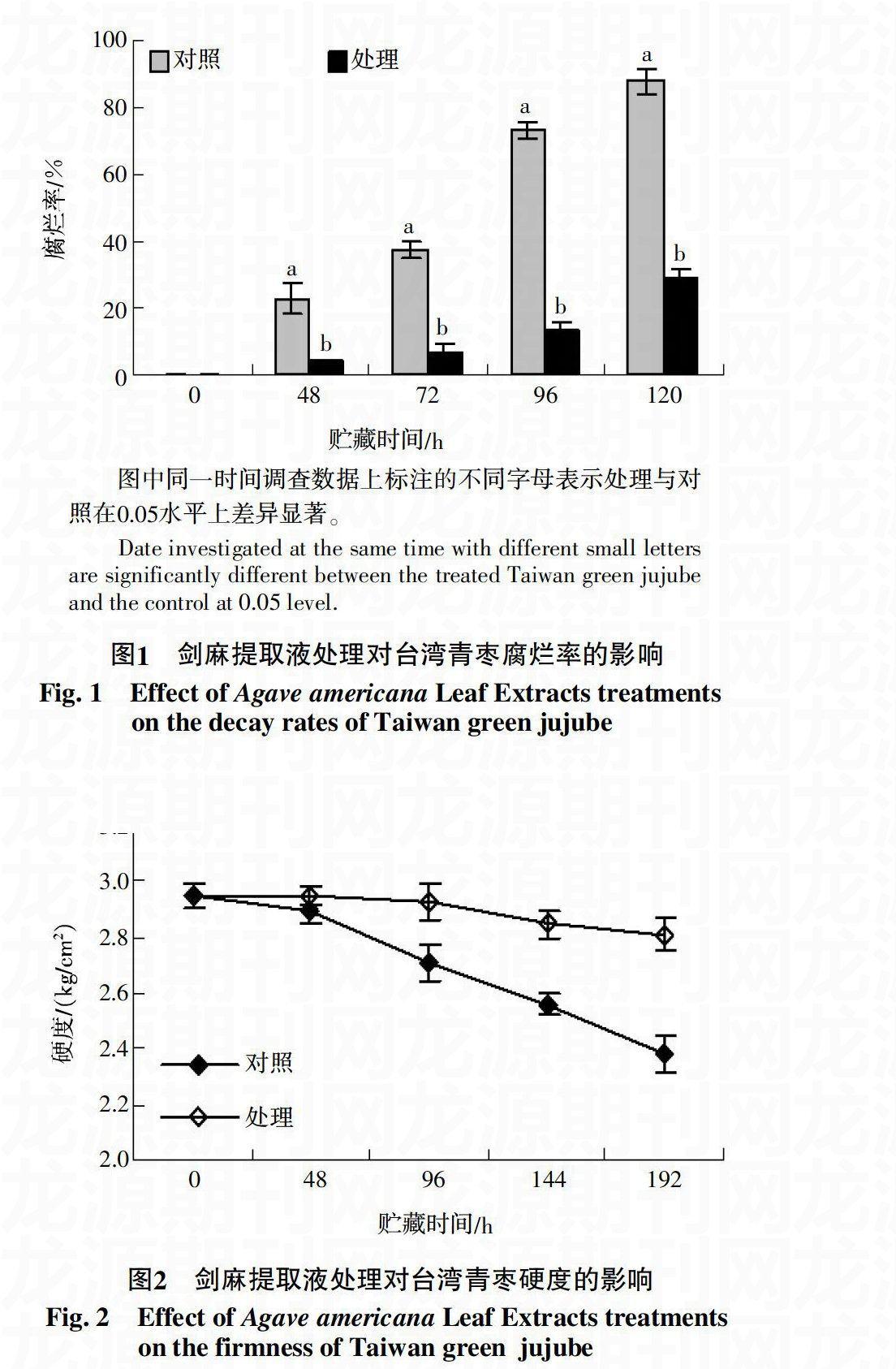
果实的腐烂率是判断贮藏效果最直观的感官性状,剑麻提取液处理对台湾青枣贮藏过程中腐烂率的影响见图1。从图1可以看出,在贮藏的48 h,对照果实的腐烂率就出现明显升高,达到22.67%,到第192小时,其腐烂率已到达80%以上,而剑麻提取液处理的果实,在贮藏的第48小时,其腐烂率仅为4%,一直到第192小时,其腐烂率仍然小于30%,显著低于对照。因此,剑麻提取液可以有效延缓台湾青枣果实贮藏过程中的腐烂进程,从而延长货架期。
果实的硬度是指果肉抗压力强弱程度,果肉抗压力越强,果实的硬度就愈大。果实硬度的大小可以反应贮藏过程中果实品质的优劣。剑麻提取液处理对台湾青枣果实硬度的变化趋势如图2,虽然在第48小时时,对照果实硬度保持良好,但之后果实硬度快速下降,而经剑麻提取液处理的果实硬度则呈现缓慢下降的趋势,在第192小时时,果实硬度仍然保持在2.81 kg/cm2以上,而对照仅有2.38 kg/cm2,显著低于处理果实。因此剑麻提取液处理可以有效延缓果实贮藏过程中果实硬度的下降。
水分是影响果实新鲜度、脆度和口感的重要成分,与果实的风味品质密切相关。但果实采后水分容易蒸发,果实大量失水,降低了果实品质。果实失重率可以反映果实的商品价值。失重率越大,表示果实的水分和营养成分流失越大,即保鲜的效果越差。剑麻提取液处理对台湾青枣失重率的影响如图3所示,台湾青枣贮藏的96 h内,处理和对照的失重率均呈缓慢上升趋势,在第96小时,对照的失重率达到2.2%,而处理仅为1.3%。96 h之后对照失重率快速增加,在第192小时时达到7.5%,而剑麻提取液处理的台湾青枣失重率一直保持缓慢增加,在第192小时时仅为3.06%,比对照低50%以上,说明剑麻提取液处理可以有效降低台湾青枣贮藏过程中的失重率。
2.2 剑麻提取液对台湾青枣果肉中CAT、POD和MDA含量的影响
CAT的变化趋势如图4,在整个贮藏期间,对照和处理的CAT活性变化趋势一致,均随着时间的延长呈现下降趋势,但对照果实CAT活性下降速度显著快于处理。在第192小时时,对照的CAT活性为9.04 U/g FW,而处理为15.2 U/g FW,比对照高40.51%,差异显著。
台湾青枣POD活性变化如图5所示,处理和对照的POD活性均呈先上升后下降的趋势。对照果实POD活性从0~144 h,POD活性出现缓慢上升,在144 h达到峰值49.36 U/g FW;处理果实从0~96 h,POD活性缓慢升高 ,从96~144 h开始快速升高至峰值,POD活性为54.39 U/g FW,显著高于对照果实POD活性的峰值。
MDA是膜脂过氧化的中间产物,其含量的高低可反映细胞膜脂过氧化的程度,膜脂过氧化可产生过多的自由基对膜造成破坏和伤害(图6)。在贮藏过程中,剑麻提取液处理后台湾青枣MDA含量增加极为缓慢,在192 h时,含量为5.96 mmol/g FW,比对照果实含量低37.72%,说明剑麻提取液可以有效降低台湾青枣中MDA的积累,减轻细胞损伤程度。
2.3 剑麻提取液对台湾青枣品质的影响
由图7可知,在贮藏过程中,台湾青枣的可溶性固形物含量没有明显的变化,均保持在10.34%~12.23%之间,均呈现先上升,后下降趋势。可能由于刚采摘的台湾青枣还未完全成熟,在成熟过程中,淀粉等大分子物质分解成了可溶性的小分子物质等,且速度大于代谢速度,使得可溶性固形物的含量有所上升。随着贮藏时间的延长,其大分子物质降解速度开始小于代谢速度,导致可溶性固形物又开始下降[18]。但剑麻提取液处理的果实在贮藏第192小时时仍保持较高的可溶性固形物含量,其含量达到11.79%,而对照组仅为10.35%。显著高于对照,因此,剑麻提取液处理台湾青枣可以有效延缓其可溶性固形物的降解,提高贮藏品质。
可滴定酸含量对水果的风味有很重要的影响,是衡量果实贮藏质量,鉴别果实品质的重要指标。由图8可知,在贮藏期间,台湾青枣果实的可滴定酸呈逐渐下降趋势,可能由于果实有机酸的一部分用作呼吸底物被消耗,另一部分在体内被转化为糖分。但剑麻提取液处理的台湾青枣下降速度较为缓慢。在第96小时 时,对照果实可滴定酸含量已下降37.30%,剑麻提取液处理果实仅下降8.25%,显著低于对照,一直到贮藏第192小时,处理果实的可滴定酸含量仍高于10%。
Vc是衡量果实品质高低的一项重要指标。果实采后贮藏过程中Vc含量随着贮藏期的延长而不断下降,主要是因为Vc在中性和碱性条件下很容易被氧化。Vc含量降低到一定程度时,自由基会积累,会对细胞组织产生损害而加快衰老速度。由图9可知,在台湾青枣贮藏过程中,Vc含量出现了先升高后降低的变化趋势,且在第48小时出现峰值,之后开始下降,对照组Vc含量下降较剑麻提取液处理组快,在贮藏第192小时,处理组Vc含量比对照组高29.71%。结果表明,剑麻提取液处理可以有效延缓台湾青枣果实Vc含量下降。
3 讨论与结论
MDA是膜脂过氧化的重要产物,通常把MDA含量作为植物衰老的指标之一[19]。它能强烈地与细胞内各种成分发生反应,引起酶和膜的严重损伤,降低膜电阻和膜的流动性,最终导致膜的结构及生理完整性的破坏[20]。实验表明,台湾青枣在25 ℃贮藏,MDA迅速积累;剑麻提取液处理抑制了果实中MDA的快速上升,这与常金梅等[12]在芒果上的报道一致。
果实成熟过程中伴随氧化作用不断加强,导致活性氧自由基的累积,往往产生氧化伤害;然而,植物中含有抗氧化酶等抗氧化系统[21],且前人研究认为CAT、POD等活性氧清除酶与植物体内活性氧的清除及果蔬衰老密切相关[22-23]。其中CAT通过直接清除逆境胁迫产生的过剩H2O2,减轻氧化胁迫;POD在水果和蔬菜中普遍存在,具有多种生物化学功能[24]。同时,越来越多的研究证明,抗氧化酶的协同作用比单一酶在植物抗氧化过程中更具重要性[25-26]。保持植物体内较高的活性氧清除酶活性和非酶抗氧化物质的含量,是活性氧代谢通畅,减少活性氧的积累,可有效地减轻MDA积累和叶绿素的降解,延缓衰老[27]。本实验结果表明:剑麻提取液处理可以有效延缓CAT酶活性的下降,同时增加POD酶的活性,有助于减少MDA的积累,延缓果实衰老进程,使台湾青枣在较长的时间内保持良好的食用品质。
参考文献
[1] 陈 莲, 林钟铨, 林河通, 等. 安喜布处理对台湾青枣果实果皮活性氧代谢和细胞膜透性的影响[J]. 热带作物学报, 2013, 34(4): 704-709.
[2] 邓碧焕著. 台湾青枣优质丰产栽培[M]. 南宁: 广西科学技术出版社, 2001: 1-16, 56-58.
[3] 陈杰忠, 果树栽培学各论[M]. 北京: 中国农业出版社, 2003: 495-496.
[4] 赵 凯, 曹雪丹, 朱水星. 不同浓度蜂蜡涂膜剂对台湾青枣保鲜效果的影响[J]. 保鲜与加工, 2011, 11(4): 16-19.
[5] 张义勇. 台湾青枣、火龙果北方日光温室栽培技术[M]. 北京: 中国农业出版社, 2005, 74-76.
[6] Jawandha S K, Mahajan B V C, Gill P S. Effect of preharvest treatments on the cellulose activity and quality of ber fruit under cold storage conditions[J]. Nothulae scientia biologicae, 2009, 1(1): 88-91.
[7] 何衍彪, 詹儒林, 赵艳龙, 等. 20种植物提取物对芒果炭疽菌的抑制作用[J]. 热带作物学报, 2005, 26(3): 86-90.
[8] 柳 凤, 詹儒林, 何衍彪, 等. 抑菌物质肉桂醛防治杧果炭疽病机理研究[J]. 果树学报, 2011, 28(4): 651-656.
[9] Angeles V S, Julia V, Santos G, et al. Species of Agave with antimicrobial activity against selected pathogenic bacteria and fungi[J]. World J Microbiol Biotechnol, 2008, 24: 1 249-1 252.
[10] Roberta X S, Carolina S C, Mariana B B, et al. Action of sisal(Agave sisalana, Perrine)extract in the in vitro development of sheep and goat gastrointestinal nematodes[J]. Experimental Parasitology, 2012, 13: 162-168.
[11] Marizvikuru M, Patrick J M, Joseph F. Anti-inflammatory and analgesic activities of the aqueous leaf extract of Agave sisalana in rats[J]. Scientific Research and Essays, 2012, 7(14): 1 477-1 484.
[12] 常金梅, 詹儒林, 柳 凤, 等. 剑麻叶汁对采后杧果炭疽病的防治效果及其抗逆指标研究[J]. 果树学报, 2013, 30(5): 865-870.
[13] 郑小林, 田世平, 李博强, 等. 草酸对冷藏期间桃果实氧化系统和PPO活性的影响[J]. 园艺学报, 2005, 32(5): 788-792.
[14] Wang Y S, Tian S P, Xu Y. Effects of high oxygen concentration on pro-and anti-oxidant enzymes in peach fruit during postharvest periods[J]. Food Chemistry, 2005, 91(2): 99-104.
[15] Tian S P, Li B Q, Xu Y. Effects of O2 and CO2 concentration on physiology and quality of litchi fruit in storage[J]. Food Chemistry, 2005, 91(8): 659-663.
[16] Liu H T, Liu Y Y, Pan Q H, et al. Novel interrelationship between salicylic acid, abscisic acid, and PIP2-specific phospholipase C in heat acclimation-induced thermotolerance in pea leaves[J]. Journal of Experimental Botany, 2006, 57(4): 3 337-3 347.
[17] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007.
[18] 郭东起, 侯旭杰. 冬枣的生物涂膜保鲜研究[J]. 食品研究与开发, 2013, 34(5): 98-103.
[19] 华 春, 王仁雷. 杂交稻及其三系叶片衰老过程中SOD、 CAT活性和MDA含量的变化[J]. 西北植物学报, 2003, 23(3): 406-409.
[20] Plati-aloia K A, Thomapson W W. Freeze-fracture evidence of gel-phase lipid in membrances of senescing cowpea cotyledons[J]. 北方园艺, 2008, (4): 252-254.
[21] Tian S P, Lib Q, Xu Y. Effects of O2 and CO2 concentration on physiology and quality of litchi fruit in storage[J]. Food Chemistry, 2005, 91(8): 659-663.
[22] Bhattacharjee S. Reactive oxygen species and oxidative burst: roles in stress, senescence and signal transduction in plants[J]. Current Science, 2005, 89(7): 1 113-1 121.
[23] Sudhamoy M, Adinpunya M, Nirupama M. Biochemical characterization of oxidative burst during interaction between Solanum lycopersicum and Fusarium obysporum f. sp. Lycopersici[J]. Physiological and Molecular Plant Pathology, 2008, 72(1-3): 56-61.
[24] Gaspar T, Parel C, Thorpe TA(Eds.). Peroxidases[M]. Geneva: University of Geneva Press, 1981.
[25] Lacan D, Baccou J C. High level of antioxidant enzymes correlate with delayed senescence in nonnetted fruits[J]. Planta, 1998, 204(3): 377-382.
[26] Wu Y X. Tiedemann A V. Impact of fungicides on active oxygen species and antioxidant enzymes in spring barley exposed to ozone[J]. Environmental Pollution, 2002, 116(2): 37-47.
[27] Dhindsa R S. Drought stress, enzymes of glutathione metabolism, oxidation injury and synethesis in Tortula ruralis[J]. Plant Physiol, 1991, 95(2): 648-650.