3个甘蔗与斑茅远缘杂交后代BC1的染色体遗传分析
黄永吉 符成 林炜乐 刘少谋 高嘉慧 邓祖湖 黄忠兴 林彦铨 陈如凯
摘 要 对3个甘蔗与斑茅远缘杂交后代BC1进行真实性鉴定及染色体核型分析,以探讨甘蔗与斑茅BC1的染色体传递方式。利用2对鉴定斑茅真实杂交后代的特异引物对3个甘蔗与斑茅BC1进行鉴定,采用根尖分生区细胞去壁低渗涂片法制片,显微拍照计数染色体数目,并进行染色体核型分析。3个BC1材料均为斑茅的真实杂交后代,崖城01-69体细胞染色体核型公式为2n=121=120 m+1 sm,其染色体按2n+n方式传递;崖城01-116的体细胞染色体核型公式为2n=122=118 m+4 sm,其染色体传递方式为2n+n;崖城01-134的体细胞染色体核型公式为2n=121=120 m+1 sm,其染色体传递为2n+n。推断甘蔗与斑茅BC1的染色体以2n+n的方式传递。
关键词 甘蔗;斑茅;核型分析;染色体传递方式
中图分类号 S334.3 文献标识码 A
Genetic Analysis of Chromosome in 3 BC1 Clones from
the Distant Crossing Between Saccharum spp.
and Erianthus arundinaceus
HUANG Yongji1, FU Cheng2 *, LIN Weile1, LIU Shaomou2, GAO Jiahui1
DENG Zuhu1 **, HUANG Zhongxing2, LIN Yanquan1, CHEN Rukai1
1 Key Lab of Sugarcane Biology and Genetic Breeding, Ministry of Agriculture, Fuzhou, Fujian 350002, China
2 Guangzhou Research Institute for Sugarcane Industry, Guangzhou, Guangdong 510316, China
Abstract To explore the chromosome transmission, the karyotypes of 3 BC1 clones from the distant crossing between Saccharum spp. and Erianthus arundinaceus were analyzed. 3 BC1 clones were identified using 2 pairs of specific primers of true E. arundinaceus progenies. Chromosomes were prepared according to cell wall degradation hypotonic smear method, the chromosomes number of 3 BC1 clones was calculated and the karyotypes of 3 BC1 clones were analyzed. 3 BC1 clones were true progenies of E. arundinaceus. The somatic chromosome karyotypic type of YC01-69 was 2n=121=120 m+1 sm, following 2n+n transmission; The somatic chromosome karyotypic type of YC01-116 was 2n=122=118 m+4 sm, following 2n+n transmission; The somatic chromosome karyotypic type of YC01-134 was 2n=121=120 m+1 sm, following 2n+n transmission. The 2n+n transmission of BC1 clones from Saccharum spp. and E. arundinaceus can be resumed.
Key words Sugarcane; Erianthus arundinaceus; Karyotype analysis; Chromosome transmission
doi 10.3969/j.issn.1000-2561.2015.01.010
甘蔗是中国乃至世界最重要的糖料作物和具有较好发展前景的糖能兼用的可再生生物能源作物[1],全球蔗糖产量约占食糖总产量的75%[2]。现代甘蔗栽培品种(Saccharum spp. L.)主要来源于几个热带种也被称为高贵种(Saccharum officinarum)和不多的野生种割手密(Saccharum spontaneum)的杂交后代,导致其遗传基础相对狭窄[3-4],制约了甘蔗产量的进一步提高。
蔗茅属、芒属、硬穗茅属和河八王属等甘蔗近缘属野生种是拓宽甘蔗遗传基础的重要种质资源[5],世界各国甘蔗育种者陆续在这些种质资源的收集、保存和利用等方面开展了大量的工作。其中,斑茅(Erianthus arundinaceus)属于蔗茅属植物[6],因其具有高生物量、生势旺盛、分蘖力强、宿根性好和耐涝、耐瘠、抗旱、抗病虫能力强等优势[7-12],备受甘蔗育种者亲睐。期望通过属间远缘杂交进行种质创新,将甘蔗近缘属野生种的优良基因渗透到甘蔗中,丰富其遗传背景,创制出抗逆、高产、高糖的超亲良种[13-14]。长期以来,由于甘蔗与斑茅F1高度不育和杂交后代遗传机理不明,导致斑茅的杂交利用进展缓慢。经过甘蔗育种者的不懈努力,斑茅种质研究与利用取得重要进展,已突破BC1,成功获得甘蔗与斑茅更高世代的真实杂交后代[7,9,12,15-17],其中有些材料的性状表现优良,具有良好的利用价值。然而,由于甘蔗是高度复杂的异源多倍体或非整倍体植物[18],其染色体较小且数目众多(100~130条)[19],染色体制片十分困难。此外,染色体中期相比率低,导致甘蔗细胞遗传学研究进展滞后于其他作物。
开展对甘蔗与斑茅杂交后代的细胞遗传学研究,对斑茅等近缘属野生种种质资源利用研究具有重要的指导意义。本文对3个甘蔗与斑茅BC1崖城01-69、崖城01-116和崖城01-134进行染色体核型分析,旨在对甘蔗与斑茅BC1的染色体遗传特点进行研究,将有助于提高斑茅在甘蔗遗传改良育种上的利用效率,并提供一定的细胞遗传学理论依据。
1 材料与方法
1.1 材料
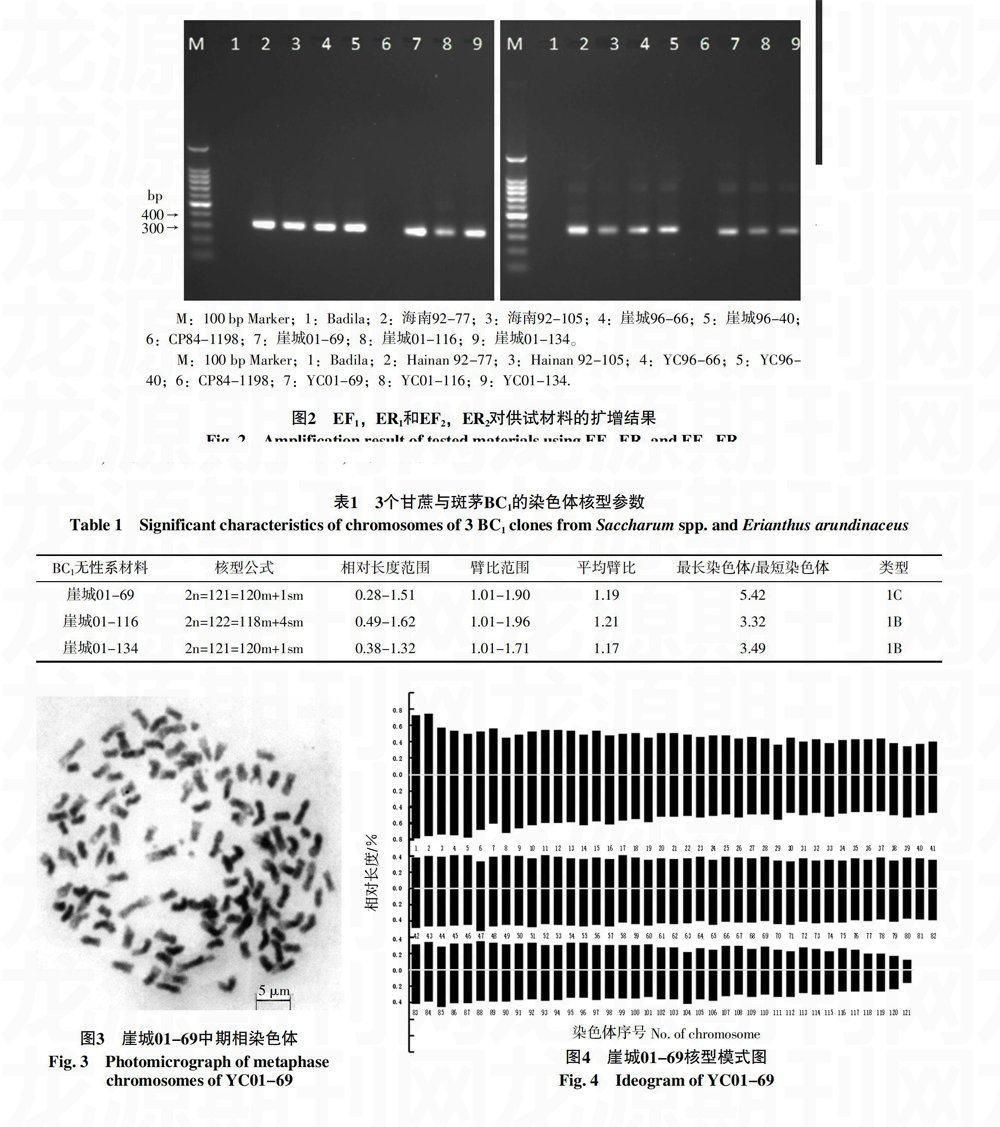
本研究材料为Badila、海南斑茅92-77、海南斑茅92-105、崖城96-40、崖城96-66、CP84-1198、崖城01-69、崖城01-116、崖城01-134(图1),斑茅及其后代无性系来自广州甘蔗糖业研究所海南甘蔗育种场,保育在福建农林大学甘蔗综合研究所资源圃。
1.2 方法
1.2.1 基因组DNA提取和杂交后代真实性分子鉴定
参考SM Aljanabi等[20]的CTAB法提取供试材料叶片的总基因组DNA。根据本实验室开发的2对鉴定斑茅真实杂交后代的特异引物(EF1和ER1;EF2和ER2)[21]对供试材料进行杂交后代真实性分子鉴定,用美国ABI 梯度PCR仪(VeritiTM 96)进行扩增。反应总体积为25 μL,包括2.5 ng基因组DNA,1×Ex Taq PCR Buffer,dNTPs Mixture各2.5 mmol/L,正向和反向引物各0.4 μmol/L,1.25 U TaKaRa Ex Taq。反应程序为95 ℃预变性5 min;93 ℃变性50 s,52 ℃退火20 s,72 ℃延伸40 s,30个循环;72 ℃终延伸5 min。
1.2.2 染色体制片 参考黄东益[22]和邓祖湖等[23]的方法,28 ℃保湿培养根尖至1.5 cm,切取1 cm左右的根尖于对二氯苯饱和水溶液处理2 h,再用无水乙醇和冰醋酸(3 ∶ 1)溶液固定24 h,固定后的根尖0.075 mol/L KCl中低渗1 h,3.5%纤维素酶和1.75%果胶酶混合液在37 ℃酶解8~12 h。酶解后根尖置于蒸馏水中低渗30~60 min,无水乙醇和冰醋酸(3 ∶ 1)溶液固定30 min。将根尖分生区切下,均匀涂抹于载玻片上,空气干燥后用pH6.8的Giemsa染液染色。用Carl Zeiss Scope.A1显微镜观察,MRC5相机拍照。
1.2.3 染色体核型分析 每个材料选取30个染色体分散较好的中期细胞进行染色体数目的统计,选取典型的中期细胞进行测量,制成染色体参数表,绘制核型模式图,选择具有代表性的分裂相排成核型。核型分析参照李懋学等[24]的标准,染色体的相对长度、臂比类型按Levan等[25]命名系统确定,核型类型参考Stebbins[26]的标准分类,染色体类型采用Kuo等[27]的方法进行划分。用Image-Pro Plus 6.0(Media Cybernetics, Inc.)测量染色体长度,用Microsoft Excel 2013软件分析作图,核型分析方法参考李懋学等[24]的方法,但考虑到甘蔗为异源多倍体,染色体不进行配对,本文染色体核型分析按其长度从长到短排列,单条染色体核型分析不配对。
2 结果与分析
2.1 甘蔗与斑茅杂交后代BC1杂交后代真实性鉴定
利用2对鉴定斑茅真实杂交后代特异引物(EF1和ER1;EF2和ER2)对Badila、海南斑茅92-77、海南斑茅92-105、崖城96-40、崖城96-66、CP84-1198、崖城01-69、崖城01-116、崖城01-134进行鉴定。结果显示,海南斑茅92-77、海南斑茅92-105、崖城96-40、崖城96-66、崖城01-69、崖城01-116、崖城01-134都扩增出斑茅特异条带,而Badila和CP84-1198没有扩增出特异条带(图2),说明崖城01-69、崖城01-116、崖城01-134为甘蔗与斑茅的真实杂交后代。
2.2 3个甘蔗与斑茅BC1核型分析结果
2.2.1 崖城01-69核型分析结果 崖城01-69的核型参数见表1,其体细胞染色体数为2n=121,相对长度介于0.28~1.51,最长染色体/最短染色体为5.42,臂比范围介于1.01~1.90,平均臂比为1.19,染色体属1C型。121条染色体中有120条为中部着丝粒染色体,1条为近中部着丝粒染色体,核型公式为2n=121=120 m+1 sm,染色体形态和核型模式见图3、4。
2.2.2 崖城01-116核型分析结果 崖城01-116的核型参数见表1,其体细胞染色体数为2n=122,相对长度介于0.49~1.62,最长染色体/最短染色体为3.32,臂比范围介于1.01~1.96,平均臂比为1.21,染色体属1B型。122条染色体中有118条为中部着丝粒染色体,4条为近中部着丝粒染色体,核型公式为2n=122=118 m+4 sm。染色体形态和核型模式图见图5、6。
2.2.3 崖城01-134核型分析结果 崖城01-134的核型参数见表1,其体细胞染色体数为2n=121,相对长度介于0.38~1.32,最长染色体/最短染色体为3.49,臂比范围介于1.01~1.71,平均臂比为1.17,染色体属1B型。121条染色体中有120条为中部着丝粒染色体,1条为近中部着丝粒染色体,核型公式为2n=121=120 m+1 sm,染色体形态和核型模式图见图7、8。
3 讨论与结论
甘蔗是中国最重要的糖料作物,中国作为一个重要的食糖生产国和消费国,食糖产业的重要战略性不言而喻。然而,全球甘蔗商业栽培品种的改良是通过利用十分有限的种质资源完成的。因此,利用野生种种质资源扩大甘蔗遗传基础,并进行杂交育种提高甘蔗产量显得尤为重要。斑茅等近缘属野生种是甘蔗遗传育种重要的种质资源,其具有极其丰富和宝贵的潜在基因资源,通过甘蔗与斑茅属间杂交培育具有适应性广、抗逆强、高产、稳产、优质的新良种,对甘蔗育种具有重要意义。
纵观甘蔗品种改良育种史,每次甘蔗遗传改良育种瓶颈得以突破都有新的种质资源渗入[28]。Jeswiet的“高贵化”育种和Ven Katraman的“三元杂种”创造了半个世纪甘蔗糖业的辉煌成就。其中,Jeswiet首创高贵种与野生种割手密的高贵化杂交育种,经过2次2n+n的染色体遗传方式,这种遗传方式加速了高贵化进程,不仅累积了高贵种的优良血统,同时又削弱了野生种的不良血统[29]。甘蔗育种者认为割手密的BC2、BC3即可培育出具备高贵种的高产高糖特性与野生种的强活力、强抗性的良种,高贵化次数过多,反而可能会使抗性和活力降低。因此,开展甘蔗野生种种质资源的遗传背景和遗传方式研究是实现甘蔗遗传育种新突破的关键。
甘蔗染色体传递方式十分复杂,有n+n、2n+n、n+2n和2n+2n等传递方式,并且n常常不是一倍体的原来数目,常有增减,Bremer将这种配子数目常有增减的现象称为“不平衡遗传”[30]。甘蔗性细胞减数分裂出现异常时,配子增减几条染色体甚至是染色体加倍,仍然能够结合成受精卵,并正常地发育生长成完整植株和完成整个生育期的特性,笔者将这种具备雌雄配子非正常结合成受精卵的相容现象称之为“容错现象”。甘蔗染色体减数分裂很不规则,其可能会出现染色体提早进入中期,推迟进入后期,在末期和四分体即形成核仁,小孢子染色体数无规则,形成非整倍体后代等[31]。甘蔗染色体配对虽大多以二价体为主,但也存在单价体和多价体,多价体配对反映出同源联会不完全[19]。
甘蔗与斑茅有性杂交的F1染色体遗传方式为n+n,高贵种的染色体未加倍,BC1染色体遗传方式是2n+n,含斑茅血缘的F1的染色体被完整保留下来,而较为“高贵”的父本CP84-1198的染色体减半,这种染色体遗传方式使高贵化进程减慢,可能需要在更高世代中才能获得含有斑茅血缘的良种。由于甘蔗属热带种和斑茅远缘杂交获得的F1高度不育,难以达到转移有利基因的目的,一些甘蔗育种者将割手密作为桥梁亲本,先利用割手密与斑茅杂交,获得的F1聚合了双亲优点以及较好的花粉育性,可进一步利用这些具备双亲优异基因的F1再与其他甘蔗栽培品种杂交,创制出新的突破性优良种质[32-33],或许这是克服F1高度不育而带来的诸多不利的途径之一。
本研究从3个甘蔗与斑茅BC1的斑茅后代真实性鉴定和核型分析结果可以看出:经2对斑茅真实杂交后代特异引物鉴定,崖城01-69、崖城01-116和崖城01-134都出现了斑茅的特异条带,说明这3个材料均为甘蔗与斑茅的真实杂交后代。3个甘蔗与斑茅BC1无性系崖城01-69、崖城01-116和崖城01-134的染色体均由中部着丝点和近中部着丝点组成,分别属1C型、1B型和1B型,这与郑成木[34]、刘文荣等[35]、黄东益等[36]、邓祖湖等[23,37]的研究结果基本一致,他们均认为甘蔗染色体多以中部着丝点染色体为主。Stebbins[26]认为,高等植物核型进化的基本趋势是由对称向不对称发展的,较原始的植物的核型具对称的中部着丝点染色体较多,而较进化的植物的核型具中部着丝点染色体较少。因此,3个甘蔗与斑茅BC1染色体较原始。崖城01-69为121条染色体,崖城01-116为122条染色体,崖城01-134为121条染色体,母本崖城96-40为69条染色体,母本崖城96-66为69条染色体,父本CP84-1198为120条染色体,因此,如果经过正常的减数分裂,母本崖城96-40的配子有34或者35条染色体,母本崖城96-66的配子有34或者35条染色体,父本CP84-1198的配子有60条染色体。若按n+n传递,崖城01-69、崖城01-116和崖城01-134的染色体应为2n=94或95;若按n+2n传递,崖城01-69、崖城01-116和崖城01-134的染色体应为2n=154或155;按2n+n,崖城01-69、崖城01-116和崖城01-134的染色体应为2n=129,较为符合。因此,推断BC1以2n+n的方式进行传递,与Piperidis等的结果一致[16]。
参考文献
[1]张跃彬,吴才文,刘家勇,等. 现代甘蔗产业技术国内外发展状况及建议[J]. 中国糖料, 2008(4): 54-65.
[2]World Sugar Statistics F O. Licht's world sugar year book. 72nd edn[M]. Informa, 2011.
[3]Lu Y h,D'hont A,Walker Dit,et al. Relationships among ancestral species of sugarcane revealed with RFLP using single copy maize nuclear probes[J]. Euphytica, 1994, 78(1-2): 7-18.
[4]Irvine J E. Saccharum species as horticultural classes[J]. Theoretical and Applied Genetics,1999,98(2): 186-194.
[5]Singh R K,Singh R B,Singh S P,et al. Identification of sugarcane microsatellites associated to sugar content in sugarcane and transferability to other cereal genomes[J]. Euphytica,2011,182(3):335-354.
[6]Amalraj V Alfonse,Balasundaram N. On the taxonomy of the members of‘Saccharum complex[J]. Genetic Resources and Crop Evolution,2006,53(1):35-41.
[7]D'hont A,Rao P S,Feldmann P,et al. Identification and characterisation of sugarcane intergeneric hybrids,Saccharum officinarum × Erianthus arundinaceus,with molecular markers and DNA in situ hybridisation[J]. Theoretical and Applied Genetics,1995,91(2):320-326.
[8]Rott P,Mohamed I S,Klett P,et al. Resistance to leaf scald disease is associated with limited colonization of sugarcane and wild relatives by Xanthomonas albilineans[J]. Phytopathology,1997,87(12):1202-1213.
[9]Piperidis G,Christopher M J,Carroll B J,et al. Molecular contribution to selection of intergeneric hybrids between sugarcane and the wild species Erianthus arundinaceus[J]. Genome,2000,43(6):1 033-1 037.
[10]Ram Bakshi,Sreenivasan T V,Sahi B K,et al. Introgression of low temperature tolerance and red rot resistance from Erianthus in sugarcane[J]. Euphytica,2001,122(1):145-153.
[11]Sugimoto Akira,Ponragdee Werapon,Sansayawichai Taksina,et al. Collecting and evaluating of wild relatives of sugarcane as breeding materials of new type sugarcane cultivars of cattle feed in Northeast Thailand[C]. Japan International Research Center for Agricultural Sciences:JIRCAS Working Report,2002, (30):55-60.
[12]Cai Q,Aitken K S,Fan Y H,et al. A preliminary assessment of the genetic relationship between Erianthus rockii and the“Saccharum complex”using microsatellite(SSR) and AFLP markers[J]. Plant Science,2005,169(5):976-984.
[13]Tai P Y P,Miller J D. A Core Collection for Saccharum spontaneum L. from the World Collection of Sugarcane[J]. Crop science,2001,41(3):879-885.
[14]Tai Pyp,Miller Jd. Germplasm diversity among four sugarcane species for sugar composition[J]. Crop science,2002,42(3):958-964.
[15]邓海华,廖兆周,李奇伟,等. 斑茅F2杂种选育与同工酶标记辅助选择[J]. 甘蔗糖业,2002(1):1-5.
[16]Piperidis N,Chen J W,Deng H H,et al. GISH characterization of Erianthus arundinaceus chromosomes in three generations of sugarcane intergeneric hybrids[J]. Genome,2010,53(5):331-336.
[17]Fukuhara S,Terajima Y,Irei S,et al. Identification and characterization of intergeneric hybrid of commercial sugarcane (Saccharum spp. hybrid) and Erianthus arundinaceus(Retz.) Jeswiet[J]. Euphytica,2013,189(3):321-327.
[18]D'hont Angelique,Grivet Laurent,Feldmann Philippe,et al.Characterisation of the double genome structure of modern sugarcane cultivars(Saccharum spp.) by molecular cytogenetics[J]. Molecular and General Genetics,1996,250(4):405-413.
[19]Jannoo N,Grivet L,David J,et al. Differential chromosome pairing affinities at meiosis in polyploid sugarcane revealed by molecular markers[J]. Heredity,2004,93(5):460-467.
[20]Aljanabi Sm,Forget L,Dookun A. An improved and rapid protocol for the isolation of polysaccharide and polyphenol-free sugarcane DNA[J]. Plant Molecular Biology Reporter,1999,17(3):281.
[21]郑雪芳. 甘蔗近缘属植物斑茅的利用与真实杂种鉴定研究[D]. 福建福州:福建农林大学,2004.
[22]黄东益. 栽培甘蔗染色体组构成的细胞学分析与原位杂交检测的研究[D]. 海南儋州:华南热带农业大学,1999.
[23]邓祖湖,赖丽萍,林炜乐,等. 甘蔗斑茅杂交后代BC1的染色体核型及染色体遗传分析[J]. 福建农林大学学报:自然科学版,2007(36):561-566.
[24]李懋学,陈瑞阳. 关于植物核型分析的标准化问题[J]. 武汉植物学研究,1985(3):297-302.
[25]Levan Albert,Fredga Karl,Sandberg Avery A. Nomenclature for centromeric position on chromosomes[J]. Hereditas,1964,52(2):201-220.
[26]Stebbins George Ledyard. Chromosomal evolution in higher plants[M]. London:Edward Arnold,1971:87-89.
[27]Kuo Shing-Rong,Wang Tze-Ting,Huang Tseng-Chieng.Karyotype analysis of some formosan gymnosperms[J]. Taiwania,1972,17(1):66-80.
[28]Jackson Phillip A.Breeding for improved sugar content in sugarcane[J]. Field Crops Research,2005,92(2):277-290.
[29]Bremer G. Problems in breeding and cytology of sugar cane[J]. Euphytica,1961,10(1):59-78.
[30]Bremer G. A cytological investigation of some cultivated kinds and of their parents[J]. Genetica,1924,6:497-525.
[31]张 华,林彦铨. 甘蔗细胞与分子遗传学研究进展[J]. 甘蔗,2001,8(3):1-6.
[32]高轶静,方锋学,刘昔辉,等. 甘蔗与斑茅割手密复合体杂交后代的分子标记鉴定[J]. 植物遗传资源学报,2012(13):912-916.
[33]Govindaraj P,Balamurugan A,Natarajan U S. Identification of intergeneric hybrids between Erianthus arundinaceus and Saccharum spontaneum through STMS markers[J]. International Sugar Journal,2012,114(1 361):350-356.
[34]郑成木. 甘蔗核型及其染色体数目变化的研究[J]. 热带作物学报,1993(14):47-51.
[35]刘文荣,邓祖湖,张木清,等. 甘蔗斑茅的杂交利用及其杂种后代鉴定系列研究Ⅲ. 甘蔗斑茅远缘杂交后代细胞遗传分析[J]. 作物学报,2004(30):1 093-1 096.
[36]黄东益,郑成木,庄南生,等. 甘蔗染色体组构成系统演化的研究[J]. 热带作物学报,2000(21):43-51.
[37]邓祖湖,李玉蝉,刘文荣,等. 甘蔗和斑茅远缘杂交后代的染色体遗传分析[J]. 热带作物学报,2007(28):62-67.