花生属种间杂种及其早期多倍体世代生理特性变化研究

摘 要 为了研究花生属异源多倍体进化过程中的生理特性遗传变化规律,以花生区组栽野种间杂种F1、早期多倍体世代(S0~S3)及其亲本为材料,分析植株叶片中的脯氨酸、丙二醛、可溶性糖和叶绿素含量以及过氧化物酶活性等抗病抗逆相关生理生化指标的变化特征。结果表明,杂种F1代各项生理指标都高于亲本,表现出明显的杂种优势;染色体加倍后的S0~S1代植株叶片中的POD活性、脯氨酸含量和叶绿素含量均高于F1代,S1~S3代各项生理指标伴随着自交代数的增加而逐渐降低,但仍高于母本栽培种,说明染色体加倍后的多倍体植株可能具有更强的抗病、抗旱等抗逆和环境适应能力。
关键词 花生;种间杂交;异源多倍化;生理特性
中图分类号 S565.2 文献标识码 A
Abstract To study the mechanisms of genetic variation on physiological property of Arachis allopolyploidization, the variation characteristics of physiological and biochemical indexes related to disease/stress resistance(POD activity, Proline, MDA, soluble sugar and chlorophyll content)was studied using the progenitors, F1 hybrid and early polyploidy generations(S0 to S3)of the hybridization between tetraploid cultivated peanut and diploid wild peanut A. doigoi as materials. The results indicated that:(1)All the five physiological property indexes of F1 hybrid were higher than their progenitors, which showed obviously heterosis;(2)After chromosome doubling, POD activity, Proline and chlorophyll content of S0~S1 were higher than F1 hybrid;(3)All the five physiological property indexes of S1~S3 declined along with the self-cross course but higher than their progenitors, which indicated that allopolyploidy had better environment suitability and resistance capability to disease resistance and drought tolerance. This study provided useful important information for revealing the mechanism of peanut allopolyploidy evolution. Additional, it had vital significance to guide the peanut interspecific hybridization breeding.
Key words Peanut; Interspecific hybridization; Allopolyploidization; Physiological property
doi 10.3969/j.issn.1000-2561.2015.03.008
多倍化是高等植物基因组的显著特征之一,多倍体植物中以异源多倍体居多,种间杂交和染色体加倍是形成异源多倍体的主要途径,通过此途径形成的异源多倍体兼具杂种和多倍体双重优势且克服了远缘杂种不育的障碍,因而被作物遗传育种学家广泛应用于作物品种改良中[1]。异源多倍化不是两个基因组的简单融合,而是涉及到大范围的分子调整和变化[2-6],从而引起一系列的形态、生理及代谢过程的变化,如黄瓜单位面积的叶绿素a、b及其总含量、MDH的表达量均随着倍性增加而增加[7];四倍体何首乌的SOD、POD和APX活性均明显高于二倍体[8];三倍体、四倍体西瓜番茄红素的含量明显高于二倍体[9];四倍体玉米籽粒内类胡萝卜素含量比二倍体增加43%[10]。因此,探明植物多倍体进化过程中的不同倍性材料生理生化水平上的差异不仅对种间杂交育种具有重要指导意义,同时也可为阐明植物多倍体进化机制提供有用的信息[3,11]。
花生属由3个四倍体种和近80个二倍体种组成,其中的四倍体栽培种花生(2n=40,AABB)是世界上最重要的油料和经济作物之一。花生属种间杂交是异源多倍化过程,国内外关于四倍体栽培种花生二倍体祖先的研究比较多,目前认为A.duranensis和A. ipaensis最有可能是栽培种A基因组和B基因组的提供者[12-15],但就种间杂交异源多倍体进化过程中的相关机制研究甚少,Garcia等[16]和贺梁琼等[17-19]对该物种种间杂交的回交各世代和早期多倍体世代基因组的遗传继承及丢失、基因表达变化进行过报道,目前尚未有该物种异源多倍体进化过程中生理特性变化研究的相关报道。本研究以花生属四倍体栽培种花生仲恺花4号与二倍体野生种花生A. doigoi杂交产生的种间杂种F1、早期多倍体世代S0~S3及其亲本为材料,研究与抗病抗逆相关的生理生化指标在该组合多倍体进化过程中的变化特点,为花生属种间杂交育种实践和深入研究花生属多倍体进化机理提供依据。
1 材料与方法
1.1 材料
花生属四倍体栽培种花生仲恺花4号和二倍体野生种花生A. doigoi(PI 276235)种间杂交获得不育的三倍体杂种F1,F1植株经0.2%秋水仙碱诱导加倍处理获得部分恢复育性的人工异源六倍体S0植株,S0连续自交3代获得S1、S2和S3等早期异源多倍体世代群体,各世代的植株采取搭建小拱棚过冬和春季扦插幼嫩枝条的方法保存于广西农业科学院院内基地,每个世代随机选取7株第4片展开叶[20]进行各项生理生化指标的测定。
1.2 方法
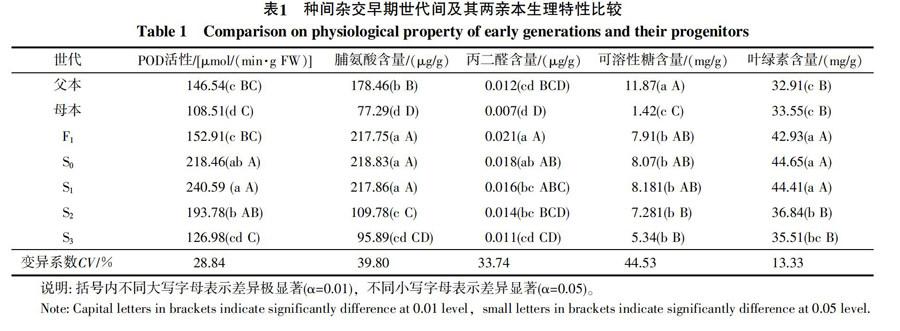
植株叶片中的可溶性糖、脯氨酸含量和过氧化物酶(POD)活性按照李合生[21]主编的《植物生理生化实验原理与技术》中的方法进行测定,分别采用蒽酮比色法、磺基水杨酸法和愈创木酚法;采用硫代巴比妥方法测定丙二醛含量[22];叶绿素含量的测定采用KONICAL公司的Chlorophyll meter SPAD-502便携式叶绿素测定仪自动测量。变异系数CV (Coefficient of Variance)是标准差与均值的比值,通过公式CV=σ/μ计算获得。
1.3 数据处理
试验均重复3次,采用Microsoft Excel(Office 2007)软件处理数据和绘图,采用 SPSS17.0软件中Duncan方法进行差异显著性分析。
2 结果与分析
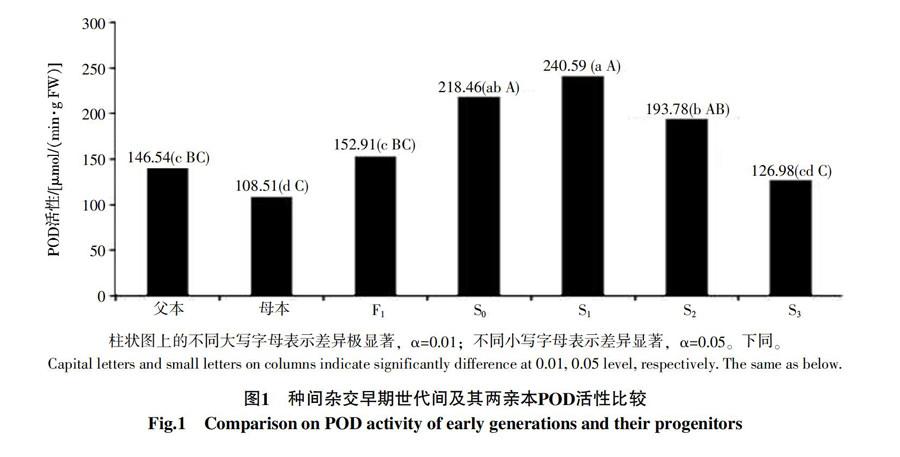
2.1 种间杂种F1、早期多倍体世代S0~S3及两亲本间POD活性比较
对种间杂种F1、早期异源多倍体世代S0~S3及两亲本植株叶片中的POD活性进行比较(图1),二倍体野生种花生父本植株叶片中的POD活性为146.54 μmol/(min·g FW),四倍体栽培种花生母本植株叶片中的POD活性为108.51 μmol/(min·g FW),父本植株中的POD活性要高出母本植株38.03 μmol/(min·g FW);杂交F1代植株叶片中的POD活性为152.91 μmol/(min·g FW),分别高出母本、父本植株44.4 μmol/(min·g FW)和6.37 μmol/(min·g FW);染色体加倍后,S0代植株叶片中的POD活性为218.46 μmol/(min·g FW),S1代植株叶片中的POD活性为240.59 μmol/(min·g FW),分别高于F1代植株65.55 μmol/(min·g FW)和87.68 μmol/(min·g FW),但随着自交代数的继续增加,POD活性不断下降,到S3代时,其叶片中的POD活性仅为126.98 μmol/(min·g FW);此外,POD活性变异系数达到28.84%(表1),表明父本、母本和早期多倍体世代间的POD活性存在比较大的差异。差异显著性分析结果也表明,二倍体野生种花生父本的POD活性与母本、S0、S1、S2代的POD活性差异显著;母本的POD活性只与S3代的POD活性差异不显著,与其他世代差异均显著。
2.2 种间杂种F1、早期多倍体世代S0~S3及两亲本间脯氨酸含量比较
从图2可以看出,二倍体野生种花生父本植株叶片中的脯氨酸含量为178.46 μg/g,四倍体栽培种花生母本植株叶片中的脯氨酸含量为77.29 μg/g,父本的脯氨酸含量多出母本101.17 μg/g;F1代植株叶片中的脯氨酸含量为217.75 μg/g,分别比母本、父本植株多140.46 μg/g和39.29 μg/g;S0代的脯氨酸含量为218.83 μg/g,S1代的脯氨酸含量为217.86 μg/g,均比F1代植株高出少许;但随着自交代数的继续增加,植株叶片中的脯氨酸含量不断降低,到S3代时,其叶片中的脯氨酸含量仅为95.89 μg/g;植株叶片中的脯氨酸含量变异系数达到39.80%(表1),表明种间杂种F1、早期多倍体世代S0~S3及两亲本植株间的脯氨酸含量存在显著差异。差异显著性分析结果也表明,二倍体野生种花生父本脯氨酸含量与四倍体栽培种花生母本、杂种F1及早期多倍体世代S0~S3代植株叶片中的脯氨酸含量都存在显著性差异;四倍体栽培种花生母本的脯氨酸含量与S3代差异不显著,但与其他世代植株中的脯氨酸含量差异显著;F1代与S0、S1代之间差异不显著,但与S2、S3代间存在显著性差异。
2.3 种间杂种F1、早期多倍体世代S0~S3及两亲本间丙二醛含量比较
对种间杂种F1、早期异源多倍体世代S0~S3及两亲本植株叶片中的丙二醛含量进行比较(图3),二倍体野生种花生父本植株叶片中的丙二醛含量为0.012 μg/g,四倍体栽培种花生母本的丙二醛含量为0.007 μg/g,父本植株的丙二醛含量高于母本0.005 μg/g;F1代植株叶片的丙二醛含量为0.021 μg/g,分别比母本和父本多0.014 μg/g和0.009 μg/g;S0代和S1植株的丙二醛含量分别为0.018 μg/g和0.016 μg/g,都少于F1代植株,丙二醛含量并没有随着染色体加倍而增加,且随着自交的进行,丙二醛含量不断降低,到S3代时,其叶片的丙二醛含量仅为0.011 μg/g;各世代及亲本植株叶片的丙二醛含量变异系数达到33.74%(表1),差异显著性分析结果表明,F1代和S0代的丙二醛含量差异不明显,但两个亲本的丙二醛含量都与F1代和S0代存在显著性差异。
2.4 种间杂种F1、早期多倍体世代S0~S3及两亲本间可溶性糖含量比较
从图4可见,二倍体野生种花生父本植株叶片中的可溶性糖含量为11.87 mg/g,四倍体栽培种花生母本植株叶片中的可溶性糖含量为1.42 mg/g,父本的可溶性糖含量比母本多出10.45 mg/g,远高于母本;F1代植株叶片中的可溶性糖含量为7.91 mg/g,比母本栽培种高,但低于父本野生种;S0代植株叶片中的可溶性糖含量为8.07 mg/g,S1代植株的可溶性糖含量为8.181 mg/g,均高于F1代;但随着自交的继续进行,植株叶片中的可溶性糖含量逐渐降低,到S3代时,其植株叶片中的可溶性糖含量降为5.34 mg/g,但仍高于栽培种母本;植株叶片中的可溶性糖含量变异系数高达44.53%(表1),在所测的生理生化指标中变异系数最大,表明种间杂种F1、早期多倍体世代S0~S3及两亲本植株间的可溶性糖含量存在显著差异。显著性差异分析结果也表明,母本、父本的可溶性糖含量与杂种F1、早期多倍体世代S0~S3代都存在显著差异,但杂种F1、早期多倍体世代S0~S3之间差异不显著。
2.5 种间杂种F1、早期多倍体世代S0~S3及两亲本间叶绿素含量比较
图5的数据显示, 父本野生种植株叶片中的叶绿素含量为32.91 mg/g,母本栽培种植株叶片中的叶绿素含量为33.55 mg/g,父本植株叶片中的叶绿素含量低于母本0.64 mg/g;F1代植株叶片中的叶绿素含量为42.93 mg/g,分别比母本和父本多出9.38 mg/g和10.02 mg/g;S0和S1代植株叶片中的叶绿素含量分别为44.65 mg/g和44.41 mg/g,高于F1植株;但随着自交的继续进行,植株叶片中的叶绿素含量也呈现逐渐降低的趋势,到S3代时,叶绿素含量降至35.51 mg/g;植株叶片中的叶绿素含量变异系数仅为13.33%(表1),表明双亲及各世代间差异不是很明显。差异显著性分析结果表明,父本与母本之间差异不显著,父、母本与杂种F1、早期多倍体世代S0~S1代之间差异显著,但与S2、S3代之间差异不显著;杂种F1、早期多倍体世代S0~S1代之间差异不显著,但与S2、S3代差异显著;S2和S3代之间的叶绿素含量差异不显著。
3 讨论与结论
过氧化物酶(POD)是广泛存在于植物体内,能与超氧化物歧化酶(SOD)和过氧化氧酶(CAT)等保护酶系统协同将植物体内的过氧化氢转化为其他物质,使膜不易膜脂过氧化,起到保护膜脂的作用[23]。脯氨酸不仅是生物大分子的保护剂和羟基的清除剂,还是植物从逆境条件恢复正常生长过程中迅速、有效的氮源、碳源和还原剂,其含量在一定程度上反映了植物的抗逆性[24]。可溶性糖不仅参与渗透调节,还可能参与维持植物蛋白质稳定,调节植物组织的生长、发育和抗逆性等多个生理生化进程[25]。因此,植物体内POD活性、脯氨酸含量和可溶性糖含量的高低从某种程度上反应了植物本身的抗逆性和适应环境的能力。而丙二醛(MDA)被认为是逆境胁迫下膜脂过氧化的最终产物,其含量高低反映了细胞膜脂过氧化的水平,可以反应植物遭受逆境伤害的程度[26-27]。
本研究结果表明,父本植株叶片中的POD活性、脯氨酸含量和可溶性糖含量均高出母本植株,这与野生种花生比栽培种花生具有更强的抗旱、抗病虫害和抗连作等特性一致,也在生理特性上证明野生种花生具有更强的抗逆性提供了有效证据。但父本植株叶片中的丙二醛含量也比母本植株叶片中的高,这可能是因为野生种花生在其进化初期,由于生存环境恶劣造成了体内丙二醛的积累并被遗传保存至今,其含量反映的只是它曾经遭受逆境伤害的程度。F1代植株叶片中的POD活性、脯氨酸含量、丙二醛含量和叶绿素含量均高于双亲,这可能与两个亲本杂交后通过全基因组范围的等位基因和非等位基因之间相互作用获得的杂合性和杂种优势有关,使得杂交所产生的杂种F1代在生活力、适应性和竞争能力等方面均超过两个亲本[28]。S0和S1代植株叶片仅有丙二醛含量低于F1代植株,其余的生理指标均高于F1代植株,表明该组合的后代染色体加倍后其多倍体植株具有更强的抗病、抗旱等抗逆能力和环境适应能力,这与普通小麦染色体加倍后适应性方面得到极大改良的研究结果一致[29]。细胞核内染色体组加倍不仅会带来细胞变大等形态上的变化,多倍体内部代谢和生化过程也会随之加强[7-9]。
在花生异源多倍体进化早期,各个生理生化指标在各世代及亲本间表现出明显的不稳定性,其中可溶性糖、脯氨酸、丙二醛含量和POD活性变异系数都较大,分别达到了44.53%、39.80%、33.74%和28.84%,这可能是由于在花生异源多倍体进化过程中,其基因组及基因表达模式发生了广泛而迅速的变化[17-19],从而引起生理特性也发生了剧烈的变化;此外,随着自交的进行,S1到S3代植株叶片所测的各项生理生化指标均伴随着自交代数的增加而逐渐降低,最终都接近母本栽培种,可能与杂种优势逐渐衰退和偏母性遗传有关。这些研究结果进一步证明了细胞核内染色体组加倍常带来细胞变大、抗逆性增强等形态和生理上的变化,种间杂交引起的杂交和多倍化不仅仅是两个基因组融合在一个细胞核中,而是包括了一系列分子上和生理上的调整[10]。这对指导花生属种间杂交育种利用野生花生优异基因及阐明花生异源多倍体进化机制具有重要的意义。
参考文献
[1] 庄 勇, 王述彬. 异源多倍体及其在作物品种遗传改良中的应用[J]. 安徽农业科学, 2009, 37(26): 12 498-12 500.
[2] 宋 灿, 刘少军, 肖 军, 等. 多倍体生物研究进展[J]. 中国科学C辑(生命科学), 2012, 42(3): 173-184.
[3] 赵旭博, 李爱丽, 毛 龙. 植物多倍化过程中小分子RNA调控基因表达机制研究进展[J]. 作物学报, 2013, 39(8): 1 331-1 338.
[4] Jiao Y, Wickett N J, Ayyampalayam S, et al. Ancestral polyploidy in seed plants and angiosperms[J]. Nature, 2011, 473: 97-100.
[5] Feldman M, Levy A A. Genome evolution due to allopolyploidization in wheat[J]. Genetics, 2012, 192: 763-774.
[6] Adams K L, Wendel J F. Polyploidy and genome evolution in plants[J]. Curr Opin Plant Biol, 2005, 8: 135-141.
[7] 雷 春, 陈劲枫, 张晓青, 等. 不同倍性黄瓜的形态和一些生理生化指标比较[J]. 植物生理学通讯, 2005, 41(4): 471-474.
[8] 张夏楠, 高山林. 何首乌同源四倍体的诱导和生理指标的测定[J]. 植物资源与环境学报, 2006, 15(4): 33-37.
[9] 袁平丽, 刘文革, 路绪强, 等. 不同倍性西瓜果实发育过程中番茄红素含量动态[J]. 果树学报, 2012, 29(5): 890-894.
[10] 钱春桃, 陈劲枫, 庄飞云. 弱光条件下甜瓜属种间杂交新种的某些光合特性[J]. 植物生理学通讯, 2002, 38(4): 336-338.
[11] 陈友根, 陈劲枫, 李为观, 等. 甜瓜属不同倍性异源多倍体光合特性及超微结构研究[J]. 南京农业大学学报, 2010, 33(1): 32-36.
[12] Kochert G, Halward T, Branchi W D. RFLP variability in peanut(Arachis hypogaea L.)cultivars and wild species[J]. Theoretical and Applied Genetics, 1991, 81(5): 565-570.
[13] Gimenes M A, Lopes C R, Valls F M. Genetic relationship among Arachis species based on AFLP[J]. Genetic and Molecular Biology, 2002, 25(3): 349-353.
[14] Gimenes M A, Lopes C R, Galgaro M L. RFLP analysis of genetic variation in species of section Arachis, genus Arachis (Leguminosae)[J]. Euphytica, 2002, 123: 421-429.
[15] 任小平, 廖伯寿, 黄家权, 等. 利用SRAP标记分析花生属花生区组种质亲缘关系[J]. 中国油料作物学报, 2009, 31(4): 449-454.
[16] Garcia G M, Tallury S, Kochert G S. Molecular analysis of Arachis interspecific hybrids[J]. Theor Appl Genet, 2006, 112: 1 342-1 348.
[17] 贺梁琼, 熊发前, 钟瑞春, 等. 利用SCoT标记分析花生栽培种×A. chacoensis组合异源多倍化的早期基因组变化[J]. 中国农业科学, 2013, 46(8): 1 555-1 563.
[18] 贺梁琼, 熊发前, 韩柱强, 等. 花生种间杂种异源多倍化早期世代性状和微卫星变化研究[J]. 中国油料作物学报, 2013, 35(5): 499-507.
[19] 贺梁琼, 熊发前, 唐秀梅, 等. 花生属人工异源多倍体进化早期基因表达变化的cDNA-SCoT分析[J]. 作物学报, 2014, 40(10): 1 767-1 775.
[20] 唐秀梅, 钟瑞春, 揭红科, 等. 间作遮荫对花生光合作用及叶绿素荧光特性的影响[J]. 西南农业学报, 2011, 24(5): 1 703-1 707.
[21] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 195-196.
[22] 陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2002: 124-125.
[23] 林碧英, 张 瑜, 林义章. 不同光质对豇豆幼苗光合特性和若干生理生化指标的影响[J]. 热带作物学报, 2002, 38(4): 417-422.
[24] 武永军, 曹 让, 王爱连, 等. 不同pH缓冲液处理下蚕豆幼苗叶片SOD、 POD和CAT活性的变化[J]. 西北农业学报, 2009, 18(6): 170-173.
[25] 赵江涛, 李晓峰, 李 航, 等. 可溶性糖在高等植物代谢调节中的生理作用[J]. 安徽农业科学, 2006, 34(24): 6 423-6 425, 6 427.
[26] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Annual Review Plant Biology, 2004, 55: 373-399.
[27] 丁玉梅, 马龙海, 周晓罡, 等. 干旱胁迫下马铃薯叶片脯氨酸、丙二醛含量变化及与耐旱性的相关性分析[J]. 西南农业学报, 2013, 26(1): 106-110.
[28] 桂 琴, 徐延浩, 王建波. 多倍体植物中基因表达模式的变化[J]. 武汉植物学研究, 2007, 25(2): 198-202.
[29] Mestiri I, Chague V, Tanguy A M, et al. Newly synthesized wheat allohexaploids display progenitor-dependent meiotic stability and aneuploidy but structural genomic additivity[J]. New Phytology, 2010, 186: 86-101.

