铁皮石斛原球茎DoGAUT1和DoPGSIP6基因的克隆及其在不同昼夜温差下的表达分析
张春 柳赖 钟雄

摘 要 植物中的糖基转移酶类能识别不同类型受体,最终生成多糖、复合糖、糖苷化合物等次生代谢产物。为了解其表达及调控机理,本研究利用同源克隆法从铁皮石斛(Dendrobium officinale)原球茎中克隆了2个糖基转移酶基因DoGAUT1和DoPGSIP6,分别为2 518、2 010 bp,分别编码了705、549个氨基酸。生物信息学研究表明,它们同属于糖基转移酶家族8中GT-A类的糖基转移酶,DoGAUT1和DoPGSIP6基因推定的氨基酸序列分别与二穗短柄草,大豆进化关系最近。DoGAUT1为亲水性跨膜蛋白,不含信号肽,亚细胞定位于高尔基体。DoPGSIP6为疏水性跨膜蛋白,含信号肽,亚细胞定位于质膜。荧光定量PCR分析表明:DoGAUT1在一定昼夜温差范围内,可响应温度调控,表现出上升趋势,而DoPGSIP6在昼夜温差为15 ℃时影响大。
关键词 铁皮石斛;DoGAUT1基因;DoPGSIP6基因;克隆;昼夜温差;qPCR
中图分类号 S682.31 文献标识码 A
Abstract Glycosyltransferases(GTs)are able to recognize different kinds of receptors that finally produce secondary metabolites such as polysaccharides, complex carbohydrates and glycosyl compounds in plants. To further understand the biological function and the molecular mechanism, using protocorms as experimental materials, the glycosyltransferases genes of DoGAUT1 and DoPGSIP6 were cloned by homological cloning techniques in Dendrobium officinale. The full length sequences of cDNAs were 2 518 and 2 010 bp, encoding 705 amino acids and 549 amino acids, respectively. Bioinformatics analysis showed that they belonged to glycosyltransferases 8 with the GT-A fold. Amino acid sequence aligenment showed that DoGAUT1 and DoPGSIP6 displayed the closest evolutionary relationships to those of Brachypodium distachyon and Glycine max. DoGAUT1 protein was hydrophilic, without signal peptides and located in the Golgi. DoPGSIP6 protein was a high possibility of hydrophobic membrane protein with the existence of cleavage site for signal peptide in the plasma membrane. The qPCR analysis confirmed that DoGAUT1 gene was on the up trend in a certain day-and-night temperature difference, and DoPGSIP6 gene had the maximum effect with the day-and-night temperature difference of 15 ℃.
Key words Dendrobium officinale; DoGAUT1 gene; DoPGSIP6 gene; Cloning; Day-and-night temperature difference;qPCR
doi 10.3969/j.issn.1000-2561.2015.02.003
铁皮石斛(Dendrobium officinale),属兰科石斛属多年生草本植物,野生资源少,主要分布于东亚、东南亚等国家和地区[1],福建主要集中分布于三明、德化、龙岩等地。铁皮石斛含丰富的黏性物质,其主要成分是水溶性多糖,具有降血糖、抗肿瘤、提高免疫力等功效[2-3]。因此,从分子水平上适度提高多糖的含量是当前铁皮石斛育种的一个重要方向。目前国内外对铁皮石斛多糖的研究主要集中在结构功能研究、成分分析、遗传标记等方面[4-6],而从分子水平上对多糖合成过程中相关酶基因的研究较少,对GAUT1和PGSIP6基因的研究集中在拟南芥的Galacturonosyltransferase 小基因家族上[7-9]。GAUT1(α-1,4-Galacturonosyltransferas)和PGSIP6(Glycogenin-like protein 6)分别是多糖(果胶)及葡糖醛酸木聚糖等糖类组分生物合成的关键酶[10-11]。近日,美国2所大学的研究人员在植物细胞壁形成问题上有了新的突破,研究人员确认了2种蛋白质,GAUT1和GAUT7共同形成了植物细胞壁中的果胶[12]。PGSIP超家族成员最早认为参与淀粉合成,最近发现该家族中的部分成员参与木聚糖链的修饰[11,13-14]。GAUT1和PGSIP6属于GT8(糖基转移酶)家族基因,糖基转移酶参与发育、次生代谢物合成、信号转导、防御等生物学过程[15-17]。在拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)中,则分别有同属于41个GT家族的455和565个基因(http://www.cazy.org/)(carbohydrate-active enZYmes,CAZy)。但到目前为止,绝大多数拟南芥和其他植物的GTs的功能和生化活性还不清楚。本文克隆铁皮石斛糖基转移酶DoGAUT1和DoPGSIP6基因并对其响应昼夜温差的表达分析,为研究铁皮石斛多糖合成与DoGAUT1和DoPGSIP6酶活性关系及调控表达提供理论依据。
1 材料与方法
1.1 材料
铁皮石斛无菌苗为福建农林大学园艺植物生物工程研究所保存,采自福建连城。
将无菌苗诱导的原球茎放于液体培养基中培养10 d后,取未经温度处理的原球茎用于DoGAUT1和DoPGSIP6基因的克隆,经不同昼夜温差处理的铁皮石斛原球茎提取的RNA用于实时荧光定量PCR(qPCR)操作,昼夜处理温度分别为25/20、25/15、25/10 ℃。液体培养基的配方为1/2MS+50 g/L土豆汁,其中白糖20.0 g/L,pH值5.8,光照时间12 h/d,光照强度1 200~2 000 Lux,未经处理的温度为25 ℃。
1.2 方法
1.2.1 总RNA的提取及cDNA的合成 采用Tripure法[16]进行铁皮石斛原球茎总RNA的提取,提取得到的总RNA经1%琼脂糖凝胶电泳检测其完整性,经分光光度计检测其纯度。以合格的总RNA为模板,试验中保守区扩增、3′RACE以及开放阅读框(ORF)验证过程中所用的cDNA的合成都是采用RevertAidTM First Strand cDNA Synthesis Kit(Fermentas)试剂盒,5′RACE 所需cDNA的合成采用System for Rapid Amplification of cDNA Ends,Version 2.0的试剂盒进行,实时荧光定量PCR分析的cDNA合成采用TaKaRa PrimeScript RT reagent Kit(Perfect Real Time,TaKaRa),产物均置于-20 ℃保存。
1.2.2 铁皮石斛的克隆 参考NCBI上与铁皮石斛DoGAUT1和DoPGSIP6基因相关序列,在保守区设计简并引物。根据DoGAUT1和DoPGSIP6基因的测序结果设计3′RACE的2条正向特异引物以及5′RACE的2条反向特异引物,3′末端序列下游锚定引物为AUAP:GGCCACGCGTCGACTAGTAC,5′末端序列上游锚定引物为UPM:CTAATACGACT
CACTATAGGGCAAGCAGTGGTATCAACGCAGAGT。将获得的目的基因的5′RACE序列、ORF验证序列及3′RACE序列采用DNAMAN 软件进行拼接,得到该基因的cDNA全长,并在ORF外或起始密码子和终止密码子处分别设计一对引物用于ORF的扩增。
以反转录的cDNA为模板,进行PCR扩增。PCR扩增程序为:94 ℃预变性 3 min;94 ℃变性30 s,退火30 s,72 ℃延伸1 kb/min;共35个循环;最后72 ℃延伸10 min,10 ℃保持1 h。PCR扩增产物通过琼脂糖(1%)电泳进行检测。采用DNA快速纯化回收试剂盒(Solarbio)回收目的片段,以pEASY-T5连接载体,再经转化大肠杆菌(DH5α)、挑取单克隆、菌液PCR鉴定后,委托北京六合华大基因科技股份有限公司进行测序。所有引物的序列、退火温度及延伸时间见表1。
1.2.3 生物信息学分析 利用在线ExPASy(http://www.expasy.org/resources/)蛋白分析软件Protparam、ProtSite、COIL、SWISS-MODEL分别对蛋白进行理化性质分析,功能位点预测,卷曲结构预测,三维结构预测;利用在线CBS Prediction Servers蛋白分析软件中的SignalP、TMHMM、NetPhos对蛋白进行信号肽、跨膜结构预测和磷酸化位点分析;利用SignalP 4.1 Server进行亚细胞定位;利用NCBI的Conserved Donain Search在线软件进行蛋白保守结构域的预测;利用PredictProtein对该蛋白的二级结构进行预测;并利用MEGA5.0软件构建DoGAUT1和DoPGSIP6的系统进化树,并用bootstrap法(重复1 000次)评估系统进化树。
1.2.4 不同温度处理下铁皮石斛原球茎DoGAUT1和DoPGSIP6基因实时荧光定量表达分析 本研究以18S rRNA为内参基因,检测目的基因DoGAUT1和DoPGSIP6的转录水平。18S rRNA、DoGAUT1和DoPGSIP6基因扩增引物见上表1。PCR扩增反应体系为20 μL,其中2×SYBR 10 μL,cDNA模板2 μL,上下游引物各0.8 μL,ddH2O 6.4 μL,反应于罗氏LightCycler 480仪器中进行,程序为:95 ℃预变性5 min,95 ℃变性10 s,59 ℃退火10 s,72 ℃延伸10 s,40个循环后,40 ℃冷却30 s。反应结束后进行扩增曲线和溶解曲线等分析,检测引物的特异性,各不同温度处理的cDNA模板混合样以不同梯度稀释(5×、25×、125×、375×、625×),进行标准曲线制作,获得扩增效率等相关参数,以上qPCR反应均重复3次。
2 结果与分析
2.1 铁皮石斛原球茎DoGAUT1和DoPGSIP6基因克隆及序列分析
以铁皮石斛原球茎的cDNA第一链为模板,经PCR扩增分别获得2条亮带,与预期结果一致,测序得序列1长度为1 199 bp,序列2长度为364 bp。以获得的部分序列为基础,经3′RACE,序列1和序列2分别获得577和1 242 bp的片段,经5′RACE,序列1和序列2分别获得1 031和676 bp的片段。将所获得的序列1和序列2的3′RACE、保守区序列和5′RACE序列分别进行拼接,而后根据拼接的全长序列设计相应的ORF验证引物,分别扩增得到2 154和936 bp的片段,测序结果与拼接结果相同。利用DNAman 7.0 软件对获得的2个基因全长 cDNA 序列进行分析,序列1的全长为2 518 bp,包含107 bp的5′UTR,2 118 bp的 ORF以及293 bp的3′UTR(含poly A)。序列2的cDNA全长为2 010 bp,包含144 bp的5′UTR,1 650 bp的ORF以及216 bp的3′UTR(含poly A)。测序结果在GenBank 数据库中在线进行Blast,结果表明:序列1,序列2与已登录GenBank的多种植物GAUT1和PGSIP6基因高度同源,可认为是铁皮石斛的GAUT1和PGSIP6基因,命名为DoGAUT1和DoPGSIP6基因,基因已登录GenBank,登录号为1740985。
2.2 铁皮石斛原球茎DoGAUT1和DoPGSIP6基因编码蛋白质一级序列分析
采用ExPASy Protparam工具对铁皮石斛DoGAUT1和DoPGSIP6蛋白序列的理化性质进行分析,结果显示见表2,并且脂溶系数分别为86.62和93.19,一般认为DoGAUT1蛋白为不稳定的脂溶性蛋白,DoPGSIP6蛋白为稳定的脂溶性蛋白。利用ProtScale预测可知DoGAUT1最大的疏水性值为3.344,最大的亲水性值为-3.433,预测结果显示为亲水性,而DoPGSIP6最大的疏水性值为3.222,最大的亲水性值为-2.500,预测结果说明DoPGSIP6是个小的疏水蛋白。
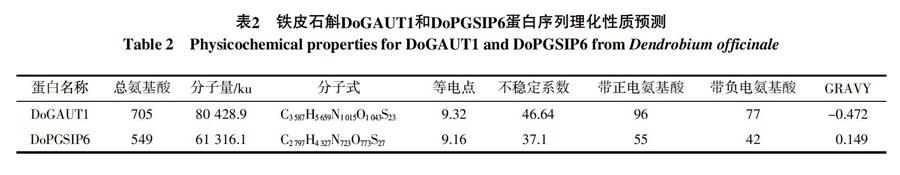
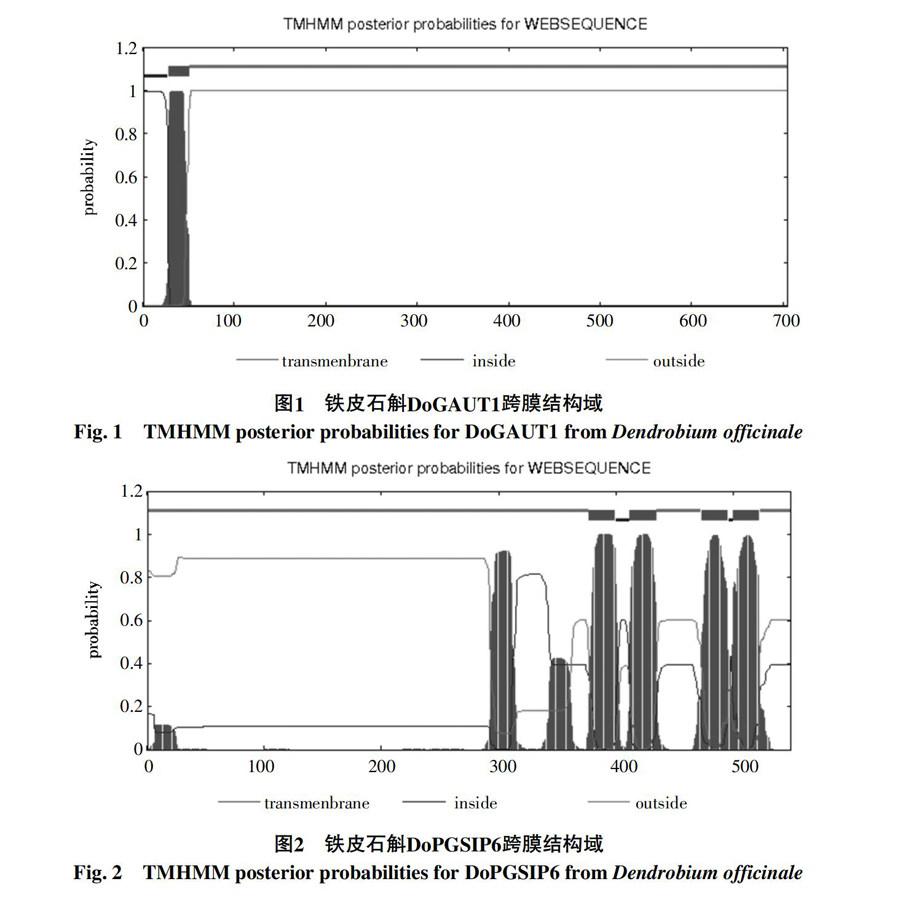
利用TMHMM Server v. 2.0工具对铁皮石斛DoGAUT1和DoPGSIP6蛋白的跨膜结构进行预测,如图1、2所示,结果表明:DoGAUT1可能会在28~50位氨基酸处形成一个跨膜螺旋, DoGAUT1蛋白的跨膜螺旋氨基酸期望值为20.681 79大于18,因此该蛋白很可能是跨膜蛋白。从N末端开始的前60个氨基酸期望值(Exp number, first 60 Aas)为20.673 38,大于10,结合SignalP 4.1 Serve分析,得出该区域是跨膜结构域而非信号肽。DoPGSIP6可能会在377~399、412~434、473~495、500~522位氨基酸处形成跨膜螺旋,DoPGSIP6蛋白的跨膜螺旋氨基酸期望值为117.916 68远大于18,因此该蛋白很可能是一个跨膜蛋白。从N末端开始的前60个氨基酸期望值(Exp number, first 60 Aas)为2.192 4,小于10,对于含有2个以上跨膜结构域的蛋白,TMHMM认为不含信号肽,运用SignalP 4.1 Server加以分析得出信号肽的位置1~25。综上表明 DoGAUT1和DoPGSIP6蛋白均为跨膜蛋白(结合TMpred分析),DoGAUT1蛋白不含有信号肽,而DoPGSIP6含有信号肽。
利用COILS对铁皮石斛DoGAUT1和DoPGSIP6蛋白进行蛋白卷曲螺旋预测,结果显示:DoGAUT1蛋白的氨基酸序列在190~217,264~293,327~355形成卷曲螺旋的概率分别是0.549,0.604,0.848。而铁皮石斛DoPGSIP6蛋白在window=14,21和28时,形成卷曲螺旋的预测概率均低于0.5,说明铁皮石斛DoPGSIP6蛋白不能形成卷曲螺旋结构。
利用NetPhos 2.0 Server预测铁皮石斛DoGAUT1和DoPGSIP6蛋白的磷酸化位点,结果表明在多肽链中可能发生磷酸化的有丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)。DoGAUT1蛋白中以丝氨酸磷酸化位点最多,有26个,预测该位点比较集中的区域序列都是非保守区;其次是酪氨酸,达到6个磷酸化位点,分别为第55、319、500、505、568、690位氨基酸处;苏氨酸的磷酸化位点有5个,分别在第3、138、245、325、450位氨基酸处。DoPGSIP6蛋白的氨基酸序列发生磷酸化修饰的丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)个数分别23、6和7个。通过Prosite 在线软件进一步预测铁皮石斛DoGAUT1和DoPGSIP6潜在蛋白功能位点。结果表明,DoGAUT1蛋白含4个N-糖基化位点、9个蛋白激酶C 磷酸化位点、7个蛋白激酶II 磷酸化位点、4 个N-酰基化位点、1个酪氨酸激酶磷酸化位点、2个cAMP-cGMP依赖性蛋白激酶磷酸化位点。DoPGSIP6蛋白潜在的N-糖基化位点、蛋白激酶C磷酸化位点、蛋白激酶II磷酸化位点、N-酰基化位点、ATP/GTP结合位点基序A(P-loop)位点分别是1、7、6、11和1个,共26个。
2.3 铁皮石斛原球茎DoGAUT1和DoPGSIP6基因编码蛋白质二级结构预测及亚细胞定位分析
利用PredictProtein对铁皮石斛HMGR蛋白的二级结构分析的结果为:DoGAUT1、DoPGSIP6的无规则卷曲所占比例为35.89%、52.46%;α螺旋为56.6%、39.16%;β螺旋为7.52%、8.38%。
运用PSORT软件对铁皮石斛DoGAUT1和DoPGSIP6蛋白的亚细胞定位进行预测,结果表明:铁皮石斛DoGAUT1蛋白定位于高尔基体概率为90%,而DoPGSIP6蛋白定位于质膜的概率为64%,定位于高尔基体概率为46%。
2.4 铁皮石斛原球茎DoGAUT1和DoPGSIP6基因编码蛋白质超二级结构分析
通过NCBI-CDS在线软件分析铁皮石斛DoGAUT1和DoPGSIP6蛋白的保守结构域,见图3、图4,结果发现DoGAUT1蛋白在第394~692 位含有典型的GT8_like_1未知功能的保守结构域,多个配体结合位点、2个金属离子结合位点。而DoPGSIP6蛋白在第29~276 位含有GT8_Glycogenin保守结构域,多个底物结合位点、2个锰结合位点。它还含有一个保守基因序列DXD,主要负责将不同的糖添加到糖链、碳酸盐、蛋白上。此外,该蛋白在第448~522 位含有CCC1_like保守结构域,它具有固氮的作用。DoGAUT1和DoPGSIP6含有GT8家族的序列相关区域,结构上属于GT-A类的糖基转移酶,按糖基化的反应机制,为保留型糖基转移酶。
2.5 铁皮石斛原球茎DoGAUT1和DoPGSIP6基因编码蛋白质三级结构分析
利用SWISSMODEL对铁皮石斛DoGAUT1和DoPGSIP6蛋白进行分析,得到其三维结构如图5所示,左图为DoGAUT1,右图为DoPGSIP6,可以看出该蛋白的主要结构元件是α螺旋、β折叠和无规则卷曲。
2.6 DoGAUT1和DoPGSIP6蛋白的同源性分析
利用DNANAN软件分别对DoGAUT1和DoPGSIP6基因推定的氨基酸序列与GenBank上公布的拟南芥Arabidopsis thaliana、二穗短柄草Brachypodium distachyon、黄瓜Cucumis sativus、马铃薯Solanum tuberosum,拟南芥Arabidopsis thaliana、短花药野生稻Oryza brachyantha、番茄Solanum lycopersicum、马铃薯Solanum tuberosum、可可Theobroma cacao中的同源序列进行多序列比对。分析结果表明,不同植物的之间均具有较高的相似性,DoGAUT1和DoPGSIP6基因推定的氨基酸相似性分别达到63.01%和73.72%,并且C端都存在一段保守序列,这段序列被称为PSPG 结构域(图6、7),该结构域是植物中参与次级代谢产物糖基化的糖基转移酶的信号模块。为进一步明确进化关系,采用MEGA5.0软件构建DoGAUT1和DoPGSIP6的系统进化树(图8)。从进化树结果可以看出,DoGAUT1与单子叶禾本科植物的二穗短柄草亲缘关系较近,聚为同一类,而与双子叶茄科的番茄等植物的亲缘关系较远。DoPGSIP6与蝶形花科的大豆聚为一类,与芸香科柑橘属的甜橙关系最远。
2.7 铁皮石斛原球茎中不同温度处理下DoGAUT1和DoPGSIP6基因实时荧光定量表达分析
在溶解曲线、扩增曲线及标准曲线满足试验要求的前提下,以18S rRNA为内参基因,检测铁皮石斛原球茎中不同温度处理下DoGAUT1和DoPGSIP6基因的表达水平,其相对表达量见图9、图10。DoGAUT1基因在不同温度不同处理时间下其相对表达量均比对照(0 d)的高;昼夜温差为10 ℃,是比较理想的处理温度,随着处理天数的增加,DoGAUT1的表达量逐渐上升,处理10 d,表达水平最高,是对照的9倍;当昼夜温差为5 ℃时,处理10 d,效果最好;当温差为15 ℃,表达相对没有规律,而且表达量较低。DoPGSIP6基因同样是在温差为10 ℃时表达量呈上升趋势;当温差为15 ℃,处理2 d时,表达水平约为对照的4倍,而处理10 d后,基因反而比对照低;当温差为5 ℃时,DoPGSIP6基因几乎不表达。以上结果表明DoGAUT1、DoPGSIP6基因可能受温差的直接特异诱导而且与温差的大小和处理时间相关。
3 讨论与结论
3.1 铁皮石斛DoGAUT1和DoPGSIP6蛋白的结构特点及功能预测
DoGAUT1和DoPGSIP6基因都编码NDP-sugar转移酶超家族蛋白,含有GT8家族的序列相关区域,结构上属于GT-A类的糖基转移酶,然而它们的蛋白质一级结构并不具有同源性,即使这2个糖基转移酶基因之间亲缘关系的很近,我们也不能准确推断其生物学功能,研究表明UrdGT1b和UrdGT1c在氨基酸水平上具有91%一致性,但是它们却转运不同的己糖[18]。将获得的铁皮石斛DoGAUT1和DoPGSIP6推定的氨基酸序列比对分析,发现不同种属同一糖基转移酶的同源性极大,这说明酶的进化是相当保守的[19],进化树分析表明,DoGAUT1与二穗短柄草亲缘关系较近,DoPGSIP6与大豆聚为一类。生物信息学分析,DoGAUT1是亲水性跨膜蛋白,DoPGSIP6属于疏水性的跨膜蛋白,此外DoGAUT1的糖基化位点更多,可能原因是糖基化的发生增加了蛋白的亲水性,从侧面解释了疏水蛋白DoPGSIP稳定存在的原因。GAUT1和PGSIP6在拟南芥均定位于高尔基体上[20-21],预测分析发现,不同的是DoPGSIP6蛋白定位于质膜的概率为64%,定位于高尔基体概率为46%,推测DoPGSIP6蛋白是在高尔基体上完成修饰和包装,被锚定在膜上。发现在重要功能域方面,铁皮石斛DoGAUT1酶含有2个金属离子位点,研究发现当铁皮石斛镁等离子含量较高,这些离子对果胶有封闭作用,影响果胶转化为水溶性果胶[22],这可能是不同地区铁皮石斛多糖成分不一样的原因。与DoPGSIP6所不同的是DoGAUT1具有一个酪氨酸激酶磷酸化位点,提示了该基因可能参与细胞内信号传导[23]。DoPGSIP6酶含有GT-A型的普遍有的2个相连的“Rossmann”样的折叠区,具有一个DXD基序,提供锰离子的结合位点,功能是不同的糖添加到糖链、碳酸盐、蛋白上,这可能决定着该基因与修饰多糖合成有关。此外,DoPGSIP6蛋白有CCC1_like保守结构域,该结构域与植物固氮有关,关于DoPGSIP6蛋白是否具有固氮作用有待进一步研究。
3.2 DoGAUT1和DoPGSIP6参与多糖的合成可能受昼夜温差的调控
多糖的合成酶主要包括合成不同核苷糖的转换酶和合成多糖的糖基转移酶。核苷糖通过不同的酶促反应相互转换,在糖基转移酶的催化下,合成多糖[24]。从微生物的多糖合成途径可推测植物中多糖的合成也是相当复杂的[25-26]。而糖基转移酶作为植物自身防御的第一道防线,能够不断缓冲环境压力并做出适应环境变化的改变,它们在植物次生代谢中具有很高的可塑性,能够高速周转[27]。祁秋霞[28]通过对不同温度条件下的海洋微藻的生物量和多糖含量的研究,实验结果表明不同的温度对微藻生长及体内多糖含量的变化有重要的影响,20~25 ℃有利于微藻的生长,10~15 ℃则有利于微藻多糖的积累。粟君等[29]在青钱柳的研究上发现了相对的适温有利于植物次生代谢物的积累,过高和过低都不利于青钱柳多糖的积累。张宇斌等[30]研究表明温度对铁皮石斛的净光合速率有明显的影响,在 20 ℃时净光合速率最大,较有利于铁皮石斛的生长。李江等[31]在南极菌Pseudoaltermonassp.S-15-13胞外多糖的研究中,发现经过重复的冻融循环后,南极菌S-15-13糖基转移酶的表达量明显提高,在第2个冻融循环后,糖基转移酶的表达量较对照提高了3.667倍。Mancuso等[32]报道从南极海冰和海水中分离的南极菌cAM025EPSs的产量在-2和10 ℃时比其在20 ℃时高出30 倍,南极菌通过提高多糖生物合成酶的表达,以大量合成胞外多糖,从而保护菌体免受低温及重复冻融的伤害。本研究通过昼夜温差调控铁皮石斛DoGAUT1和DoPGSIP6表达分析,表明昼夜温差为25/15 ℃,DoGAUT1基因表达水平呈直线上升,铁皮石斛通过DoGAUT1基因的表达合成多糖,该现象符合次生代谢物的积累规律。而DoPGSIP6基因在25/15 ℃处理2 d表达量急剧上升,以大量合成胞外多糖,该多糖的作用可能是保护铁皮石斛免受低温的伤害,这与南极菌胞外糖功能类似。
参考文献
[1] 李南岍, 吴记贵, 蒋万杰, 等. 北京松山国家级自然保护区兰科植物多样性及其保护评价[J]. 植物科学学报, 2013, 31(5): 510-516.
[2] 张绘芳, 郭 慧. 铁皮石斛有效成分及药理作用的研究进展[EB/OL]. [2010-12-13]. 首席医学网.
[3] 吕圭源, 颜美秋, 陈素红. 铁皮石斛功效相关药理作用研究进展[J]. 中国中药杂志, 2013, 38(4): 489-489.
[4] 邵 华, 张玲琪, 李俊梅, 等. 铁皮石斛研究进展[J]. 中草药, 2004, 35(1): 109-112.
[5] Shen J, Ding X, Liu D, et al. Intersimple sequence repeats (ISSR)molecular fingerprinting markers for authenticating populations of Dendrobium officinale Kimura et Migo[J]. Biological and Pharmaceutical Bulletin, 2006, 29(3): 420-422.
[6] Hua Y F, Zhang M, Fu C X, et al. Structural characterization of a 2-Oacetylglucomannan from Dendrobium officinale stem[J]. Carbohydrate Research, 2004, 339(13): 2 219-2 224.
[7] Sterling J D, Atmodjo M A, Inwood S E, et al. Functional identification of an Arabidopsis pectin biosynthetic homogalacturonan galacturonosyltransferase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(13): 5 236-5 241.
[8] Yin Y, Mohnen D, Gelineo-Albersheim I, et al. Glycosyltransferases of the GT8 family[J]. Annual Plant Reviews Plant Polysaccharides, Biosynthesis and Bioengineering, 2011, 41: 167-211.
[9] Yin Y, Chen H, Hahn M G, et al. Evolution and function of the plant cell wall synthesis-related glycosyltransferase family 8[J]. Plant Physiology, 2010, 153(4): 1 729-1 746.
[10] Ulvskov P, Paiva D S, Domozych D, et al. Classification, naming and evolutionary history of glycosyltransferases from sequenced green and red algal genomes[J]. PloS One, 2013, 8(10): 76 511.
[11] Oikawa A, Joshi H J, Rennie E A, et al. An integrative approach to the identification of Arabidopsis and rice genes involved in xylan and secondary wall development[J]. PloS One, 2010, 5(11): 15 481.
[12] Atmodjo M A, Sakuragi Y, Zhu X, et al. Galacturonosyltransferase (GAUT)1 and GAUT7 are the core of a plant cell wall pectin biosynthetic homogalacturonan: galacturonosyltransferase complex[J]. Proceedings of the National Academy of Sciences, 2011, 108(50): 20 225-20 230.
[13] Chatterjee M, Berbezy P, Vyas D, et al. Reduced expression of a protein homologous to glycogenin leads to reduction of starch content in Arabidopsis leaves[J]. Plant Science, 2005, 168(2): 501-509.
[14] Mortimer J C, Miles G P, Brown D M, et al. Absence of branches from xylan in Arabidopsis gux mutants reveals potential for simplification of lignocellulosic biomass[J]. Proceedings of the National Academy of Sciences, 2010, 107(40): 17 409-17 414.
[15] Bourne Y, Henrissat B. Glycoside hydrolases and glycosyltransferases: families and functional modules[J]. Current Opinion in Structural Biology, 2001, 11(5): 593-600.
[16] Vogt T, Jones P. Glycosyltransferases in plant natural product synthesis: characterization of a supergene family[J]. Trends in plant science, 2000, 5(9): 380-386.
[17] Lao J, Oikawa A, Bromley J R, et al. The plant glycosyltransferase clone collection for functional genomics[J]. The Plant Journal, 2014, 79(3): 517-529.
[18] Méndez C, Salas J A. Altering the glycosylation pattern of bioactive compounds[J]. Trends in Biotechnology, 2001, 19(11): 449-456.
[19] Nakamura N, Fukui Y, Ono E, et al. Glycosyltransferase gene[EB/OL].[2009-07-04]. http://www.freepatentsonline.com/7514597.html.
[20] Mohnen D, Atmodjo M, Tan L, et al. Synthesis of the plant cell wall's most complex glycan: pectin-surprises in glycosyltransferase processing and anchoring in the Golgi[J]. The FASEB Journal, 2012(26): 349.343.
[21] Rennie E A, Hansen S F, Baidoo E E, et al. Three members of the Arabidopsis glycosyltransferase family 8 are xylan glucuronosyltransferases[J]. Plant Physiology, 2012, 159(4): 1 408-1 417.
[22]刘爱文, 陈 忻, 关肖锋. 从芒果皮中提取果胶的工艺研究[J]. 化学研究与应用, 2002, 14(3): 34-345.
[23] 熊安琪, 陈松森. 干细胞因子及其受体介导的细胞内信号转导[J]. 生命的化学, 2001, 21(1): 39-43.
[24] 陈 士, 林元元. 糖基转移酶在植物次生代谢途径中的研究进展[J]. 世界科学技术: 中医药现代化, 2012(6): 2 126-2 130.
[25] Ridley B L, O'Neill M A, Mohnen D. Pectins: structure, biosynthesis, and oligogalacturonide-related signaling[J]. Phytochemistry, 2001, 57(6): 929-967.
[26]刘高强, 赵 艳, 王晓玲, 等. 灵芝多糖的生物合成和发酵调控[J]. 菌物学报, 2011, 30(2): 198-205.
[27]苏 金, Targolli J, 吴乃虎, 等. 在转基因植物中实现外源基因最佳表达的途径[J]. 生物工程进展, 1999, 19(4): 3-6.
[28] 祁秋霞. 温度对两种海洋微藻生长与多糖含量的影响[J]. 水产养殖, 2011, 32(1): 20-23.
[29]粟 君, 方升佐, 李 彦. 温度及种源对青钱柳多糖含量的影响[J]. 林业科技开发, 2011, 25(2): 52-55.
[30] 张宇斌, 陈 婷, 罗天霞, 等. 温度对铁皮石斛幼苗生长期光合速率的影响[J]. 江苏农业科学, 2013, 41(8): 223-225.
[31] 李 江, 谭姣姣. 南极菌Pseudoalteromonas sp. S-15-13引导糖基转移酶基因表达对环境因子变化的响应[J]. 海洋学报, 2012, 34(5): 154-160.
[32] Mancuso Nichols C, Garon S, Bowman J, et al. Production of exopolysaccharides by Antarctic marine bacterial isolates[J]. Journal of applied microbiology, 2004, 96(5): 1 057-1 066.

