乌司他丁联合右美托咪啶在小儿体外循环中的脑保护作用
张立涛 马亚群 戴宜武 柴瑞行
随着医疗技术迅速发展,体外循环下行心脏直视矫正手术日益增多,但术后神经系统功能障碍仍是围术期死亡和术后致残的重要原因。研究表明,术后神经系统功能障碍可能与炎症反应相关[1]。乌司他丁是一种非特异性蛋白酶抑制剂,具有抑制中性粒细胞的过度激活及炎症介质释放的作用。右美托咪啶是一种高选择性的α2 肾上腺素受体激动剂,具有镇静、镇痛、抗焦虑等特点[2],通过抑制神经细胞凋亡发挥神经保护作用。二者单独使用都能对体外循环婴幼儿心脏手术中产生神经保护作用,然而二者联合应用是否可以产生更加显著的脑保护作用目前仍未可知,本研究以体外循环下接受心脏直视术的患儿为研究对象,研究乌司他丁联合应用右美托咪定在婴幼儿体外循环中的脑保护作用。
1 资料与方法
1.1 一般资料 选2014 年10 ~12 月择期行室间隔或房间隔修补术的患儿36 例,其中男23 例,女13 例。病例入选标准(1)ASAⅠ~Ⅱ;(2)年龄2 ~12 个月,体重3 ~10 kg;(3)术前无先天性脑病及精神障碍;(4)3 周内无严重上呼吸道感染;(5)术前无心、肺、肾等功能衰竭,术后血流动力学稳定。患者随机分为对照组(C 组),乌司他丁组(U 组),右美托咪啶组(D组)和乌司他丁+右美托咪啶组(B 组),每组9 例。4组患儿在性别比、年龄、体重、ASA 分级、体外循环时间等术前资料比较,差异无统计学意义(P >0.05)。见表1。
表1 4 组患儿一般情况比较 n =9, ± s
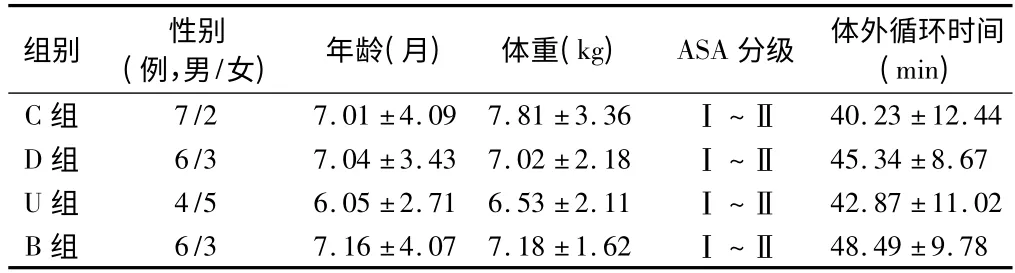
表1 4 组患儿一般情况比较 n =9, ± s
组别 性别(例,男/女) 年龄(月) 体重(kg) ASA 分级 体外循环时间(min)C 组 7/2 7.01 ±4.09 7.81 ±3.36 Ⅰ~Ⅱ40.23 ±12.44 D 组 6/3 7.04 ±3.43 7.02 ±2.18 Ⅰ~Ⅱ 45.34 ±8.67 U 组 4/5 6.05 ±2.71 6.53 ±2.11 Ⅰ~Ⅱ 42.87 ±11.02 B 组 6/3 7.16 ±4.07 7.18 ±1.62 Ⅰ~Ⅱ48.49 ±9.78
1.2 方法 患儿入室常规监测心电图、脉搏血氧饱和度,所有患儿均采用经口气管插管;麻醉诱导:咪达唑仑0.2 ~0.4 mg/kg,芬太尼10 μg/kg,罗库溴铵0.6 mg/kg;麻醉维持:吸入七氟烷1% ~2%,并分别于切皮时、体外循环开始前、复温后静脉注射咪达唑仑0.1 ~0.2 mg/kg,罗 库 溴 铵0.3 mg/kg,芬 太 尼10 μg/kg。U 组麻醉诱导后给予乌司他丁10 000 U/kg,复温后和停机后分别给予乌司他丁5 000 U/kg。D 组于麻醉诱导后给予右美托咪啶1 μg/kg,然后以0.5 μg·kg-1·h-1维持直到手术结束。B 组于麻醉诱导后给予乌司他丁10 000 U/kg,右美托咪啶1 μg/kg 之后以0.5 μg·kg-1·h-1维持直到手术结束,复温后和停机后分别给予乌司他丁5 000 U/kg。C 组用等容量的0.9%氯化钠溶液代替。每个患儿分别于麻醉诱导后30 min(T1)、复温后30 min(T2)、停机后30 min(T3)、停机后4 h(T4)、停机后24 h(T5)经颈内静脉抽取3 ml 血液,血液经过离心处理2 500 r/min 离心10 min,取上层血清注入无菌硅化塑料管,密封置于-80℃冰箱冻存,用ELISA 法测定S100β 蛋白、脑源性神经营养因子(BDNF)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的浓度。
1.3 试剂与设备 乌司他丁(广东天普生化医药股份有限公司,批号H19990134,规格每瓶100 000 U),右美托咪定(江苏恒瑞医药股份有限公司,批号H20090248,规格为2 ml∶200 μg),IL-6、TNF-α、S100β及BDNF 试剂盒购于北京百奥莱博科技有限公司,TD5A-WS 台式高速离心机。
1.4 统计学分析 应用SPSS 17.0 统计软件,计量资料以± s 表示,组内比较采用单因素方差分析,采用LSD 法比较每组不同时间点之间的差异,组间比较采用重复数据双因素方差分析,采用Bonferroni 法进行组间不同时间点的比较,P <0.05 为差异有统计学意义。
2 结果
2.1 4组不同时间点血清内S100β 浓度比较 与C组比较,U 组、D 组、B 组血浆S100β 浓度在各时间点均明显降低(P <0.05);D 组与U 组比较血浆S100β浓度在各时间点差异无统计学意义(P >0.05);与U组、D 组比较,B 组血浆S100β 浓度在各时间点均明显降低(P <0.05)。见表2。
表2 4 组患儿各时间点血清S100β 浓度比较 n =9,ng/L, ± s

表2 4 组患儿各时间点血清S100β 浓度比较 n =9,ng/L, ± s
注:与C 组比较,* P <0.05;与U 组比较,#P <0.05;与D 组比较,△P <0.05
组别T1 T2 T3 T4 T5 C 组 533.87 ±12.37 577.61 ±13.18 583.27 ±10.63 584.55 ±13.90 547.38 ±14.97 U 组 400.89 ±28.46* 455.90 ±15.43* 469.62 ±17.32* 472.14 ±12.42* 135.36 ±17.22*D 组 381.52 ±23.47* 423.35 ±17.95* 458.64 ±18.13* 494.63 ±19.91* 466.36 ±16.73*B 组 348.63 ±28.46* #△ 347.25 ±27.64* #△ 334.80 ±27.36* #△ 362.47 ±28.37* #△ 326.21 ±25.73* #△
2.2 4组不同时间点血清TNF-α 浓度比较 与C 组比较,U 组、D 组在T1 血清TNF-α 浓度略有降低但差异无统计学意义(P >0.05),而在T2、T3、T4、T5 血清TNF-α 浓度均明显降低差异有统计学意义(P <0.05);与C 组比较,B 组血清TNF-α 浓度在各时间点均明显降低(P <0.05);U 组与D 组比较,血浆TNF-α浓度在各时间点无显著变化(P >0.05);与U 组、D 组比较,B 组血浆(P >0.05)在各时间点均明显降低(P <0.05)。见表3。
表3 4 组患儿各时间点血清S100β 浓度比较 n =9,ng/L, ± s

表3 4 组患儿各时间点血清S100β 浓度比较 n =9,ng/L, ± s
注:与C 组比较,* P <0.05;与U 组比较,#P <0.05;与D 组比较,△P <0.05
组别T1 T2 T3 T4 T5 C 组 153.35 ±18.49 180.27 ±21.15 191.39 ±21.44 193.55 ±24.55 175.39 ±16.86 U 组 135.49 ±18.88 142.11 ±32.96* 149.73 ±20.87* 140.84 ±19.72* 143.08 ±13.89*D 组 147.11 ±20.32 150.85 ±19.13* 156.74 ±23.42* 159.81 ±26.03* 150.18 ±22.58*B 组 87.31 ±17.14* #△ 103.67 ±24.43* #△ 114.32 ±23.19* #△ 108.36 ±18.64* #△ 104.20 ±20.49* #△
2.3 4组不同时间点血清IL-6 浓度比较 与C 组比较,U 组、D 组在T1 血清IL-6 浓度略有降低但差异无统计学意义(P >0.05),而在T2、T3、T4、T5 均明显降低且差异有统计学意义(P <0.05);与C 组比较,B 组血清IL-6 浓度在各时间点均明显降低(P <0.05);U组与D 组比较,血浆IL-6 浓度在各时间点无显著变化(P >0.05);与U 组、D 组比较,B 组血浆IL-6 浓度在各时间点略有降低但差异无统计学意义(P >0.05)。见表4。
2.4 4组不同时间点血清内BDNF 浓度的比较 与C组比较,U 组血清BDNF 浓度在各时间点无显著变化(P >0.05),D 组、B 组血清BDNF 浓度在T1 略有升高但差异无统计学意义(P >0.05),在T2、T3、T4、T5 等时间点均明显升高且差异有统计学意义(P <0.05);U组与B 组比较血清BDNF 浓度在各时间点均明显升高(P <0.05)。见表5。
表4 4 组患儿各时间点血清IL-6 浓度比较n =9,ng/L,± s

表4 4 组患儿各时间点血清IL-6 浓度比较n =9,ng/L,± s
注:与C 组比较,* P <0.05
组别T1 T2 T3 T4 T5 C 组 55.27±8.20 67.35±7.73 68.89±9.67 68.69±9.67 64.31±8.96 U 组 46.70±8.69 50.92±7.26* 53.13±8.60* 52.51±18.56* 52.37±9.26*D 组 46.95±7.43 54.78±8.86* 55.28±8.96* 57.77±9.52* 55.90±8.47*B 组 44.68±8.80* 51.80±6.23* 49.99±6.54* 51.20±7.55* 47.38±7.07*
表5 4 组患儿各时间点血清IL-6 浓度比较n =9,ng/L± s

表5 4 组患儿各时间点血清IL-6 浓度比较n =9,ng/L± s
注:与C 组比较,* P <0.05;与U 组比较,#P <0.05
?
3 讨论
体外循环下先天性心脏病手术逐渐增多,然而术后中枢神经系统并发症日趋升高,研究表明术后中枢神经系统功能障碍的发生率为2% ~3%,神经精神功能紊乱的发生率则高达33% ~79%[3]。
文献证明,婴幼儿体外循环后神经系统功能障碍的原因包括长时间低灌注和血液稀释导致血液渗透压发生改变,血液有形成分破坏增加,灌注中形成颗粒或微栓造成的脑梗死[4];此外婴幼儿脑组织对缺氧更加敏感,低灌注时脑组织容易受到损伤。血清S100β 蛋白主要存在于脑组织的神经胶质细胞和神经元中,在缺血缺氧性脑病的早期,神经胶质细胞被激活,神经元胞体膜破坏,释放大量的S100β 到达血液,检测血清S100β 是早期脑缺血缺氧性损伤和判断预后的黄金指标[5]。体外循环后出现早期敏感认知功能障碍的患者与S100 增高的水平密切相关,李绵绵等[6]发现S100蛋白浓度与神经精神学评分有着良好的相关性。
BDNF 是一种分布于大脑的神经营养因子,对神经元具有支持和营养作用,在突触的形成、神经突起形态的维持等方面起重要作用。李志鹏等[7]研究发现,右美托咪啶能增加星形胶质细胞BDNF 的表达而起到抗谷氨酸诱导损伤,该神经保护作用与细胞外信号调节酶途径有关。脑缺血损伤后BDNF 的表达增加,首先可以延缓神经元的坏死和凋亡,其次可以促进内皮细胞分裂与分化,刺激神经血管的生成,实现神经生理功能的重建。
本实验结果显示:与对照组比较,乌司他丁组、右美托咪啶组、乌司他丁+右美托咪啶组血浆S100β 浓度在各时间点均明显降低(P <0.05);与乌司他丁组、右美托咪啶组比较,B 组血浆S100β 浓度在各时间点均明显降低(P <0.05)说明乌司他丁和右美托咪啶在体外循环期间都能降低早期脑缺血缺氧性损伤,二者的联合使用相比于单独使用临床意义明显。与对照组比较,乌司他丁组血清BDNF 浓度在各时间点无显著变化,右美托咪啶组、乌司他丁+ 右美托咪啶组血清BDNF 浓度在T1 略有升高但差异无统计学意义(P >0.05),在T2、T3、T4、T5 等时间点均明显升高且差异有统计学意义(P <0.05),说明右美托咪啶能增强BDNF 的表达对心脏术后的脑功能有一定的保护作用。
体外循环下心脏直视手术由于血液与体外循环管路、氧合器等非生理性表面接触、内毒素血症、缺血再灌注损伤等因素可引起全身性炎症反应综合征,导致血浆中大量炎性介质(TNFα、IL6)的激活与释放[8]。炎症反应时白细胞增多与脑血管内皮细胞的粘附与聚集,可阻塞并损伤脑组织的微血管,导致脑微循环障碍;还可通过激活氧自由基、各种蛋白酶等引起脑损伤[3]。
TNF-α 是体外循环术后炎症反应过程中的重要介质之一。TNF-α 主要由激活的巨噬细胞、中性粒细胞等分泌,是炎性反应的起始因子,可直接损伤血管内皮细胞,对脑水肿的形成、神经元的变性坏死起重要作用。TNF-α 可促进IL-1、IL-6 的表达,引起炎性反应,促进细胞的凋亡;TNF-α 还可以通过抑制NF-κB 的活性而增强脑细胞对TNF-α 细胞毒性的敏感程度,进而产生神经损伤[9]。IL-6 是组织损伤的早期敏感指标,血浆中IL-6 的水平高低可以作为反映组织损伤程度的指标。本试验结果提示4 组患儿在体外循环中各个时间点TNF-α 和IL-6 含量均升高,以对照组升高最显著。
乌司他丁通过抑制多种蛋白酶,稳定溶酶体膜,清除氧自由基和抑制炎性因子的释放;减少白细胞与内血管内皮细胞的粘附、聚集,改善微循环明显抑制炎性反应[10]。研究表明,乌司他丁可以显著的降低体外循环患者中性粒细胞NF-κB 的活性,使TNF-α 和IL-6 表达减少,对体外循环后的脑保护有预防作用[11]。由于婴幼儿体外循环中血液与异物接触面积相对较大,炎症反应较成人更强烈,因此我们使用的20 000 U/kg 乌司他丁能更有效的减轻炎性反应[12]。右美托咪啶是一种高选择性的α2 肾上腺素受体激动剂,以1 μg/kg 静脉推注和0.4 ~0.8 μg·kg-1·h-1静脉输注具有较强的抗炎作用[7]。
本研究中的结果,各组内比较IL-6、TNF-α 在T2、T3、T4、T5 各时间点均明显升高,说明体外循环导致的炎性反应持续存在与临床上出现的认知功能障碍相一致。与乌司他丁组、右美托咪啶组相比,对照组IL-6、TNF-α 浓度均明显降低,说明乌司他丁和右美托咪啶在体外循环期间均能有效的抑制炎性反应,乌司他丁+右美托咪啶组与乌司他丁组、右美托咪啶组相比IL-6、TNF-α 浓度均降低,说明二者联合使用对炎性反应的抑制作用更加明显,更好的起到脑保护作用。
1 Zhang Y,Xing Z,Xu Y,et al.Effects of different doses of dexmedetomidine on cognitive dysfunction in elderly patients early after laparoscopic surgery for colorectal cancer.Nan Fang Yi Ke Da Xue Xue Bao,2014,345:743-746.
2 Hanci V,Gulle K,Karakaya K,et al.Rectal dexmedetomidine in rats:evaluation of sedative and mucosal effects.Braz J Anesthesiol,2015,651:1-6.
3 廖振维,邹小明,王武军.乌司他丁对瓣膜置换手术患者体外循环脑组织白细胞介素-6 含量的影响.新乡医学院学报,2009,26:289-291.
4 邵东华,杭黎华,傅诚章,等.乌司他丁对体外循环心内直视术患者具脑保护的作用.南京医科大学学报(自然科学版),2007,12:1407-1410.
5 陈斌,李云涛,左友波,等.S100 蛋白在体外循环术后认知功能障碍评价中的意义.中国体外循环杂志,2009,7:20-22.
6 李绵绵,楼文文,梅永成.乌司他丁对婴幼儿体外循环心脏病人血浆NSE 和S100β 蛋白的影响.现代实用医学,2008,20:679-681.
7 李志鹏,王飞,李玉娟,等.右美托咪啶对脑神经保护机制的研究进展.医学综述,2014,21:3947-3949.
8 Rothenburger M,Soeparwata R,Deng MC,et al.The impact of anti-endotoxin core antibodies on endotoxin and cytokine release and ventilation time after cardiac surgery.J Am Coll Cardiol,2001,381:124-130.
9 刘涛,贾乙.TNF-α 在高血压导致神经系统损伤中的作用.青海医学院学报,2010,21:267-270.
10 Feng M,Shu Y,Yang Y,et al.Ulinastatin attenuates experimental autoimmune encephalomyelitis by enhancing anti - inflammatory responses.Neurochem Int,2014,64:64-72.
11 Zhao X,Sun X,Gao F,et al.Effects of ulinastatin and docataxel on breast tumor growth and expression of IL-6,IL-8,and TNF-alpha.J Exp Clin Cancer Res,2011,301:22.
12 Xu CE,Zou CW,Zhang MY,et al.Effects of high -dose ulinastatin on inflammatory response and pulmonary function in patients with type -A aortic dissection after cardiopulmonary bypass under deep hypothermic circulatory arrest.J Cardiothorac Vasc Anesth,2013,273:479-484.

