百令胶囊对糖尿病肾病患者单核细胞Toll 样受体4 表达及炎性因子的影响
刘春燕 陈云霞 苏俊平 刘欣荣 朱春景
糖尿病肾病(DN)作为糖尿病(DM)最常见的微血管并发症,已成为全球终末期肾病的首要病因。DN既可表现为肾小球的病理改变,又可表现为肾间质及肾盂改变。其中最常见的是肾小球硬化症,是DM 全身微血管病变在肾脏的表现。研究发现炎性因子及促炎性因子与DN 的发生发展密切相关,并认为DN 是一种炎症性疾病[1]。Toll 样受体4(TLR4)是跨膜信号转导受体家族TLRs 的重要成员,能够特异性结合细菌脂多糖等多种病原分子启动一系列信号级联反应,促进hs-CRP、TNF-α 等炎性因子释放,从而介导天然免疫防御过程。百令胶囊具有提高细胞免疫力、改善循环、抑制氧化应激等功能。本研究通过比较治疗前后糖尿病肾病患者外周血单个核细胞TLR4 表达及血清炎症因子水平变化,旨在探讨百令胶囊对DN 患肾功能的保护作用。
1 资料与方法
1.1 一般资料 选取2014 年1 月至2015 年1 月沧州市人民医院门诊及住院的T1DM 或T2DM 的DN 患者60 例,其中男37 例,女23 例;年龄43 ~57 岁,平均(50.92 ±8.13)岁。同期于我院进行健康体检的正常人50 例为对照组,其中男26 例,女24 例;年龄40 ~59岁,平均(52.14 ±8.86)岁。60 例患者随机分为治疗A 组(n =28)和治疗B 组(n =32),2 组患者性别比、年龄、病程、体重等基础资料比较差异无统计学意义(P >0.05),具有可比性。见表1。
表1 2 组一般资料比较 ± s

表1 2 组一般资料比较 ± s
组别 治疗A 组(n =28) 治疗B 组(n =32)51.24 ±7.32 50.67 ±7.41性别(例,男/女) 17/11 20/12病程(年) 6.13 ±0.92 6.24 ±1.02使用胰岛素剂量(U/d) 39.52 ±5.67 41.12 ±5.72收缩压(mm Hg) 137.04 ±12.69 139.69 ±15.17舒张压(mm Hg) 80.04 ±12.69 82.69 ±15.17血肌酐(μmol/L) 97.44 ±9.69 98.32 ±10.54 24 h 尿蛋白(g/L) 2.56 ±0.28 2.67 ±0.25空腹血糖(mmol/L) 13.79 ±2.06 14.01 ±2.04 HbA1c(%)年龄(岁)11.99 ±1.80 12.18 ±1.79
1.2 纳入标准 (1)符合2010 年美国糖尿病协会制定的糖尿病诊断标准[2],且根据Mogensen DN 诊断与分期标准均为DNⅢ~Ⅳ期;(2)24 h 尿蛋白排泄率>300 mg,且连续2 次以上;(3)GFR >60 ml/min;(4)近期血糖控制稳定;(5)终末期血肌酸酐<265 μmol/L;(6)患者签署知情同意书。
1.3 排除标准 (1)既往肾脏病史者或近期服用过肾毒性药物者;(2)合并有其他肾脏疾病和DM 以外的肾脏损害者;(3)严重感染或心、肝、肺、肾等重要脏器功能不全者;(4)恶性肿瘤患者;(5)精神疾病患者;(6)妊娠及哺乳期女性。
1.4 治疗方法 2 组均给予糖尿病常规治疗,包括健康宣教、饮食控制、适当运动、降糖、降脂等对症措施,并给予优质低蛋白饮食。治疗A 组在常规治疗的同时应用厄贝沙坦(150 mg/d,口服,浙江华海药业),治疗B 组在治疗A 组基础上联合应用百令胶囊(3.0 g/次,3/d,口服,杭州中美华东制药有限公司)。疗程均为12 周。
1.5 观察指标 分别在治疗前后抽取患者清晨空腹静脉血2 ml,不抗凝,37℃恒温箱凝结至少30 min,血标本凝固后,3 000 r/min,4℃、离心10 min,分离血清,-70℃保存备测。采用Real time-PCR 和Western blot测定外周血单个核细胞TLR4 mRNA 和蛋白表达。采用酶联免疫吸附实验(ELISA)测定血清MCP-1、hs-CRP、TNF-α、IL-6、IL-18 水平。所有患者检查前1 d 清淡饮食,以便胃排空,晚餐后禁食≥12 h,检查当日清晨抽肘静脉血。
1.6 检测方法
1.6.1 Real time-PCR:根据GeneBank 中人TLR4 mRNA 序列,采用DNAMAN 软件设计引物,引物序列见表2,由日本Takara 生物技术有限公司合成。Trizol 提取外周血单个核细胞总RNA,紫外分光光度计测定RNA 的纯度和浓度。以总RNA 为模板,按照反转录试剂盒说明书进行操作,合成cDNA 第1 链。PCR 反应在ABI 7300 型实时荧光定量PCR 仪上进行,扩增完毕后进入仪器自带的SDS v1.3 软件结果分析界面,使用SPSS10.0 统计计算样品间Ct 值。设对照组样品为标准1,目的基因mRNA 相对表达水平为2-△△Ct,设β-actin 为内参照基因。见表2。
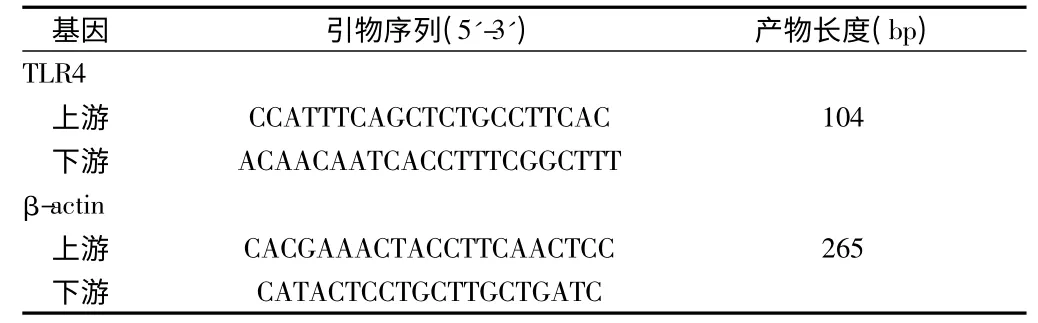
表2 Real time-PCR 引物序列及扩增产物长度
1.6.2 Western blot:外周血单个核细胞加入RIPA 裂解液200 μl,冰上放置30 min 充分裂解细胞。提取细胞总蛋白,BCA 法定量蛋白,每组取100 μg 总蛋白进行10% SDSPAGE 电泳,将目的蛋白电转移至PVDF膜,10%脱脂奶粉室温震荡封闭2 h。加入特异性一抗孵育过夜,洗膜后加入辣根过氧化物酶标记的羊抗鼠IgG,ECL 化学发光法显色、定影。
1.6.3 ELISA 法:采用ELISA 法测定血清MCP-1、hs-CRP、TNF-α、IL-6、IL-18 水平,试剂盒购自武汉博士德生物工程有限公司。严格按照试剂盒说明书操作。960 酶标仪购自美国Sigma 公司。
1.7 统计学分析 应用SPSS 13.0 统计软件,计量资料以±s 表示,组内治疗前后比较采用配对t 检验,组间比较采用独立样本t 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 对照组和DN 组外周血单个核细胞TLR4 mRNA和蛋白表达比较 与对照组比较,DN 组外周血单个核细胞TLR4 mRNA 和蛋白表达均显著增高,差异有统计学意义(P <0.05)。见表3。
表3 对照组和糖尿病肾病组外周血单个核细胞TLR4 mRNA 和蛋白表达比较 ± s

表3 对照组和糖尿病肾病组外周血单个核细胞TLR4 mRNA 和蛋白表达比较 ± s
注:与对照组比较,* P <0.05
组别 TLR4 mRNA 相对表达水平 TLR4蛋白相对表达水平对照组(n =50)0.98 ±0.12 0.79 ±0.11 DN 组(n =60) 4.77 ±0.68* 4.57 ±0.72*
2.2 对照组和DN 组血清炎性因子水平比较 与对照组比较,DN 组血清MCP-1、hs-CRP、TNF-α、IL-6、IL-18 水平显著升高,差异有统计学意义(P <0.05)。见表4。
表4 对照组和糖尿病肾病组血清炎性因子水平比较 ± s

表4 对照组和糖尿病肾病组血清炎性因子水平比较 ± s
注:与对照组比较,* P <0.05
组别 MCP-1(μg/L) hs-CRP(mg/L) TNF-α(ng/L) IL-6(ng/L) IL-18(ng/L)对照组(n =50) 23.56 ±3.44 1.12 ±0.14 6.32 ±0.57 18.87 ±2.76 2 1.42 ±3.25 DN 组(n =60) 278.35 ±34.47* 20.02 ±2.78* 20.33 ±3.25* 124.42 ±19.34* 108.36 ±14.51*
2.3 治疗后TLR4 mRNA 和蛋白表达比较 治疗前治疗A 组和治疗B 组TLR4 mRNA 和蛋白表达比较差异无统计学意义(P >0.05);治疗B 组治疗后TLR4 mRNA 和蛋白表达较治疗前显著降低,差异有统计学意义(P <0.05);且治疗B 组治疗后TLR4 mRNA 和蛋白与治疗A 组治疗后比较显著降低,差异有统计学意义(P <0.05)。治疗A 组治疗前后TLR4 mRNA 和蛋白比较差异无统计学意义(P >0.05)。见表5。
2.4 治疗后炎性因子水平比较 治疗前治疗A 组和治疗B 组MCP-1、hs-CRP、TNF-α、IL-6、IL-18 水平比较差异无统计学意义(P >0.05);治疗B 组治疗后MCP-1、hs-CRP、TNF-α、IL-6、IL-18 水平较治疗前显著降低,差异有统计学意义(P <0.05);且治疗B 组治疗后MCP-1、hs-CRP、TNF-α、IL-6、IL-18 水平与治疗A组治疗后比较显著降低,差异有统计学意义(P <0.05)。治疗A 组治疗前后MCP-1、hs-CRP、TNF-α、IL-6、IL-18 水平比较差异无统计学意义(P >0.05)。见表6。
表5 治疗后TLR4 mRNA 和蛋白表达比较 ± s

表5 治疗后TLR4 mRNA 和蛋白表达比较 ± s
注:与治疗前比较,* P <0.05;与治疗A 组比较,#P <0.05
组别 TLR4 mRNA 相对表达水平 TLR4蛋白相对表达水平治疗A 组(n =28)治疗前 4.72 ±0.65 4.60 ±0.65治疗后 4.69 ±0.71 4.56 ±0.70治疗B 组(n =32)治疗前 4.80 ±0.70 4.51 ±0.61治疗后 2.11 ±0.32* # 2.01 ±0.31*#
表6 治疗后炎性因子水平比较 ± s
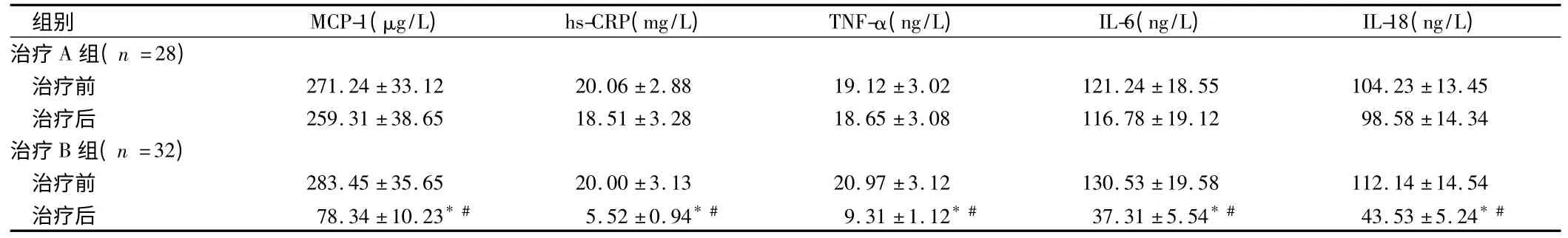
表6 治疗后炎性因子水平比较 ± s
注:与治疗前比较,* P <0.05;与治疗A 组比较,#P <0.05
组别 MCP-1(μg/L) hs-CRP(mg/L) TNF-α(ng/L) IL-6(ng/L) IL-18(ng/L)治疗A 组(n =28)治疗前 271.24 ±33.12 20.06 ±2.88 19.12 ±3.02 121.24 ±18.55 104.23 ±13.45治疗后 259.31 ±38.65 18.51 ±3.28 18.65 ±3.08 116.78 ±19.12 98.58 ±14.34治疗B 组(n =32)治疗前 283.45 ±35.65 20.00 ±3.13 20.97 ±3.12 130.53 ±19.58 112.14 ±14.54治疗后 78.34 ±10.23* # 5.52 ±0.94* # 9.31 ±1.12* # 37.31 ±5.54* # 43.53 ±5.24*#
3 讨论
DN 是DM 一种主要的微血管并发症。其病理特点是肾脏血流灌注增加、清蛋白滤出增加,肾小球基底膜增厚,细胞外基质在肾小球系膜为主的区域进行性积聚,造成肾小球硬化、肾小管纤维化、间质纤维化,最终引起肾衰。DN 的发病包含多种细胞、分子及其相关因子,是一种多因素参与的疾病,代谢紊乱、炎症信号通路、肾素-血管紧张素-醛固酮系统激活、血流动力学改变、氧化应激、细胞因子等参与了DN 的发生和发展。
近年来,炎性反应成为DN 发病机制的研究热点。TLR4 是Toll 样蛋白受体家族的重要成员,主要分布在中性粒细胞、单核巨噬细胞、肾小管上皮细胞表面或细胞内,能够识别细菌脂多糖等配体并与之结合启动髓样分化因子88(MyD88)依赖性和MyD88 非依赖性信号级联反应,通过激活核因子κB(NFκB)促进hs-CRP、TNF-α、IL-6 等炎性因子释放,从而激发一系列的炎症信号通路,引起细胞外基质增厚、肾小管间质纤维化、肾小球硬化,最终导致肾功能障碍。李贞琼等[3]研究表明,DN 模型鼠肾组织中TLR4 异常高表达,可能通过诱发炎性反应在肾小球硬化的发生及进展中发挥重要作用。Verzloa 等[4-6]研究发现,DN 患者外周血单个核细胞TLR4 表达较健康对照组显著升高,且TNF-α 水平呈正相关。
本研究采用Real time-PCR 和Western blot 检测了60 例DN 患者外周血单个核细胞TLR4 mRNA 和蛋白表达,结果表明:与对照组比较,DN 患者外周血单个核细胞TLR4 mRNA 和蛋白表达显著上调(P <0.05),与前人研究结果[4-6]一致,说明TLR4 信号通路的激活及其介导的慢性炎性反应在DN 发病机制中具有重要作用。此外,本研究结果发现,百令胶囊治疗后DN 患者外周血单个核细胞TLR4 mRNA 和蛋白表达、MCP-1、hs-CRP、TNF-α、IL-6、IL-18 水平均显著降低(P <0.05),提示百令胶囊具有明显的抗炎作用,且这一作用与TLR4 炎症信号通路的抑制有关。因此,监测TLR4 信号通路及血清炎性因子水平可作为判断疾病严重程度及疗效评估的可靠指标。
综上所述,DN 患者外周血单个核细胞TLR4 信号通路激活及其介导的慢性炎性反应参与了DN 的发生发展。百令胶囊治疗DN 能够实现保护肾功能,延缓肾脏损害的治疗目的,其机制与抑制TLR4 信号通路激活及炎性因子的分泌和释放有关,这可能是百令胶囊发挥治疗作用的机制之一,同时TLR4 炎症信号通路也可能成为治疗DN 的潜在靶点。
1 Mora C,Navarro JF.The role of inflammation as a pathogenic factor in the development of renal disease in diabetes.Curr Diab Rep,2005,5:399-401.
2 常宝成.2010 版美国糖尿病协会《糖尿病诊疗标准》修订内容解读.国际内分泌代谢杂志,2010,34:321-325.
3 李贞琼,全正莉,刘建社.Toll 样受体4 在糖尿病肾病大鼠肾小球中的表达变化及其意义.临床肾脏病杂志,2006,6:220-223.
4 Verzola D,Cappuccino L,D’Amato E,et al.Enhanced glomerular Tolllike receptor 4 expression and signaling in patients with type 2 diabetic nephropathy and microalbuminuria.Kidney Int,2014,86:1229-1243.
5 秦宁宁,王秋月.LR4 及相关炎性因子在糖尿病肾病中的表达及临床意义.中国老年学杂志,2014,34:3648-3649.
6 殷俊,林宣,何汉武.2 型糖尿病肾病患者外周血单个核细胞Toll 样受体4 的表达及TNF-α 水平的研究.临床内科杂志,2009,26:318-320.

