电致化学发光法高灵敏度测定血清中的辛可宁
谭艳季,雷小东,李建平
(桂林理工大学 化学与生物工程学院,广西 桂林 541006)
电致化学发光法高灵敏度测定血清中的辛可宁
谭艳季,雷小东,李建平*
(桂林理工大学 化学与生物工程学院,广西 桂林 541006)



图1 辛可宁的分子结构
辛可宁(结构式如图1)作为一种喹啉型生物碱,是广泛应用于抗心律失常、抗疟、治疗夜间肌肉痉挛、解热等作用的药物。但辛可宁的使用会产生很多副作用(即金鸡纳反应[1])。因此,辛可宁的微量分析方法研究极其重要。已有报道使用离子选择性电极法[2]、化学发光分析法[3]、高效液相色谱法[4-5]等方法对辛可宁进行微量分析及检测,但这些方法操作过程复杂,检测灵敏度不高。近年来,电致化学发光法(Electrochemiluminescence,ECL)作为一种仪器简单、灵敏度高、选择性好的分析方法而受到关注,已被广泛应用于药物分析[6-8]以及临床分析[9]中,但用于辛可宁的测定尚未见报道。
1 实验部分
1.1 仪器与试剂
MPI-E型电致化学发光分析系统(西安瑞迈分析仪器有限公司);Bransonic200 超声仪(德国Branson Ultraschall公司);pHS-2C型精密酸度计(上海雷磁精密仪器有限公司);GS28-B电子恒速搅拌器(上海安亭电子仪器厂);电致化学发光采用三电极系统:工作电极为金电极,参比电极为Ag/AgCl电极,对电极为铂丝电极。
辛可宁(上海化学试剂站分装厂),三联吡啶氯化钌六水合物(百灵威科技有限公司)。除注明外,其余试剂均为分析纯,实验用水为二次蒸馏水。配制一系列硼砂缓冲液,用0.01 mol/L H3BO3和0.1 mol/L NaOH调节硼砂缓冲溶液的pH值。
1.2 电致化学发光检测方法
金电极在使用前,先用0.05 μm的Al2O3粉末研磨抛光电极表面,然后依次置于50%的硝酸、无水乙醇、水中超声清洗5 min,晾干备用。
将已处理的金电极浸入1 mL含有0.2 mmol/L联吡啶钌的12 mmol/L硼酸-硼砂缓冲溶液(pH 9.0)和一定浓度的辛可宁溶液中,直接测定发光强度。电致化学发光参数设定为:扫描电位0.2~1.3 V,扫描速率为100 mV/s,放大倍数为4级,光电倍增管高压为800 V。
1.3 样品处理方法
血清样品取于桂林理工大学医院,检测前,移取2 mL人血清样品于离心管中,加入2 mL饱和(NH4)2SO4溶液,搅拌使蛋白质沉淀。将试样在7 000 r/min转速下离心15 min,除去血清中的蛋白质。取上清液,保存于4 ℃条件下,并在2周内完成测定,以防止血清样品变质。

图2 辛可宁-Ru(体系的电致化学发光图
2 结果与讨论
2.1 辛可宁增强联吡啶钌发光强度的作用机理

2.2 光电倍增管电压的影响
考察了光电倍增管高压分别为650,700,750,800,850,900 V时ECL信号强度的变化情况。结果表明,在光电倍增管高压从650 V增至900 V的过程中,体系的电致化学发光强度不断增加,同时对应的空白值增大。电压低时,检测灵敏度不高,且峰形不好,随着电压的增加,信噪比和发光强度增加,但信号的稳定性变差。综合考虑检测信号的稳定性和灵敏度,选择光电倍增管的电压为800 V。
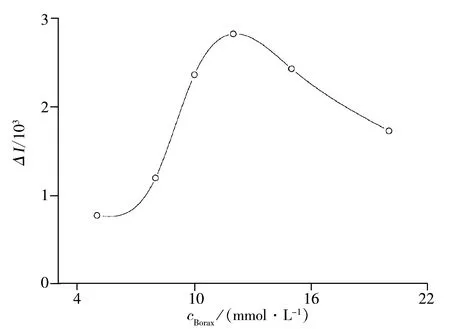
图3 不同浓度缓冲溶液对体系ECL强度的影响

图4 缓冲溶液pH值对发光强度的影响
2.3 缓冲溶液的优化
考察了不同缓冲液对体系ECL强度的影响。分别以硼酸-硼砂缓冲溶液、磷酸盐缓冲溶液、醋酸-醋酸钠缓冲溶液为缓冲底液进行实验,结果发现,辛可宁在硼酸-硼砂缓冲溶液中的发光强度最强且最稳定,因此选择硼酸-硼砂缓冲液进行后续实验分析。

考察了不同pH值的硼酸-硼砂缓冲液对ECL信号的影响,结果如图4所示。当硼酸-硼砂缓冲液在pH 8.0~9.0时,ECL信号强度随着pH值的增大而增加;当pH值大于9.0后,随着pH值的继续增大,ECL信号强度反而下降。因此,实验选择pH 9.0进行后续实验。
2.5 工作曲线与检出限

图5 联吡啶钌浓度对体系发光强度的影响

图6 不同浓度辛可宁的ECL响应曲线
2.6 干扰实验
将5.0×10-9mol/L辛可宁分别与5.0×10-7mol/L的苯丙氨酸、多巴胺、抗坏血酸、葡萄糖、蔗糖混合,以考察常见有机物质对实验的影响。结果显示,混合前后ECL响应信号的变化小于±5%,说明这些血清中常见的有机物质基本不干扰辛可宁的测定。

表1 常见无机干扰离子对体系电致化学发光强度的影响
此外,将5.0×10-8mol/L辛可宁分别与不同浓度倍数的常规离子混合,以考察血清样品中常见无机离子对体系ECL响应信号的影响(表1)。结果显示,混合前后ECL响应信号的变化小于±5%,表明常见离子对测得几乎无影响。
2.7 重现性与稳定性实验

为考察本方法的稳定性,将5.0×10-9mol/L辛可宁加入到含有0.2 mmol/L联吡啶钌的12 mmol/L硼酸-硼砂缓冲液(pH 9.0)中,在一周内每天对该体系进行电致化学发光检测,测得发光强度的RSD小于2.5%。可见本方法具有较高的稳定性。
2.8 实际样品的测定
对已按“1.3”方法处理的血清样品进行检测,同时做加标回收实验,结果如表2所示。方法的回收率为102.1%~109.5%,RSD不大于3.9%,结果令人满意。说明该方法可用于血清样品中辛可宁的测定。

表2 血清样品中辛可宁的加标回收率及相对标准偏差(n=5)
*no detected
3 结 论
本文首次建立了电致化学发光检测辛可宁的方法,该方法具有灵敏度高、重现性好、操作简便、仪器简单等优点,可应用于血清样品中辛可宁的测定。
[1] Barrocas A M,Cymet T.ComprehensiveTherapy,2007,33(3):162-163.
[2] Yao S Z,Shen G L,Dai G L.Chin.Sci.Bull.(姚守拙,沈国励,戴桂林.科学通报),1983,21:1312-1314.
[3] Deng S.J.Instrum.Anal.(邓双.分析测试学报),2001,20(5):56-58.
[4] Gatti R,Gioia M G,Cavrini V.Anal.Chim.Acta,2004,512(1):85-91.
[5] Fabiano-Tixier A S,Elomri A,Blanckaert A,Seguin E,Petitcolas E,Chemat F.Int.J.Mol.Sci.,2011,12(11):7846-7860.
[6] Hu Y F,Li J P,Xu Q.J.Instrum.Anal.(胡月芳,李建平,徐倩.分析测试学报),2011,30(8):853-857.
[7] Ma Y J,Li Q L,Wang W F,Zhou M,He C X,Liu J.J.Instrum.Anal.(马永钧,李琼琳,王伟锋,周敏,何春晓,刘婧.分析测试学报),2012,32(2):127-132.
[8] Kong D X,Li Q L,Chi Y W,Chen G N.J.Instrum.Anal.(孔德贤,李清禄,池毓务,陈国南.分析测试学报),2013,32(11):1283-1288.
[9] Qi H L,Li S G,Li L,Chen L,Gao Q,Zhang C X.Spectrochim.ActaA,2011,82(1):498-503.
[10] Wei H,Wang E K.Luminescence,2011,26(2):77-85.
[11] Yuan Y,Han S,Hu L,Parveen S,Xu G.Electrochim.Acta,2012,82:484-492.
[12] Zhao L M,Chen X M,Tian X T,Huang Z Y,Chen X.Chin.J.Anal.Chem.(赵利敏,陈晓梅,田晓田,黄志勇,陈曦.分析化学),2013,41(8):1274-1278.
[13] Chu L,Zou G Z,Zhang X L.Mater.Sci.Eng.C,2012,32(8):2169-2174.
[14] Leland J K,Powell M J.J.Electrochem.Soc.,1990,137(10):3127-3131.
[15] Knight A W,Greenway G M.Analyst,1996,121(11):101R-106R.
Highly Sensitive Determination of Cinchonine in Serum Samples by Electrochemical Luminescence Method
TAN Yan-ji,LEI Xiao-dong,LI Jian-ping*
(College of Chemistry and Bioengineering,Guilin University of Technology,Guilin 541006,China)
2014-08-04;
2014-09-20
国家自然科学基金项目(21165007,21375031);广西高校科学技术研究项目(2013ZL057)
10.3969/j.issn.1004-4957.2015.02.013
O657.63;TQ460.72
A
1004-4957(2015)02-0200-05
*通讯作者:李建平,博士,教授,研究方向:电化学分析,Tel:0773-5898551,E-mail:likianping@263.net

