家蝇幼虫双翅肽MdDpt I成熟肽基因的克隆与原核表达
孙小宁裴志花卞 路张丹丹马红霞
(1.吉林农业大学动物科学科技学院,长春130118;2.辽宁省农业经济学校,辽宁锦州121001;3.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春130118)
家蝇幼虫双翅肽MdDpt I成熟肽基因的克隆与原核表达
孙小宁1,裴志花1,卞 路2,张丹丹1,马红霞1,3∗
(1.吉林农业大学动物科学科技学院,长春130118;2.辽宁省农业经济学校,辽宁锦州121001;3.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春130118)
对鸡沙门氏菌诱导家蝇幼虫构建的抑制性消减文库(SSH)中筛选得到的家蝇双翅肽 I(Musca domesticaDiptericin I,MdDptI)基因进行克隆、表达,并对表达产物的抑菌活性进行初步研究。以沙门氏菌诱导家蝇幼虫cDNA为模板,采用cDNA末端快速扩增技术(RACE,对MdDptI基因进行扩增,并对扩增产物进行测序和生物信息学分析,进一步去掉信号肽并构建重组表达质粒pET-28a-MdDptI,转化大肠杆菌BL21(DE3,IPTG诱导表达,对表达产物进行SDS-PAGE电泳分析。借助亲和纯化获得目的蛋白,并验证目的蛋白的生物活性。MdDptI基因全长为419 bp,包含一个300 bp的完整开放阅读框(ORF,编码99个氨基酸,其cDNA序列与GenBank中登录号为FJ794602.1的家蝇双翅肽基因同源性为95%。构建了家蝇MdDptI基因的成熟肽原核表达质粒pET-28a-MdDpt-I,并获得成功表达,表达产物约为12 ku,与预期结果一致。纯化后的目的蛋白表现出一定的抑菌活性。本试验获得了MdDptI基因的全长序列,构建了原核表达载体,并成功获得表达纯化。
家蝇;家蝇双翅肽;克隆;序列分析;原核表达
鸡源沙门氏菌(salmonella)是引起鸡白痢和鸡伤寒的主要病原菌,该病原菌具有2500多种血清型,不同血清型沙门氏菌可引发不同的人兽共患病,威胁人畜健康和公共卫生安全[1]。目前,国内外主要采用抗生素对沙门氏菌引起的疾病进行预防和治疗,而抗生素的不合理应用造成了该病原菌耐药性的产生,使得药物的治疗剂量不断加大,不但增加了用药成本,也造成了药物残留,给养禽业带来严重经济损失[1-2]。因此,寻找新型、绿色、安全的抗菌剂代替抗生素,已成为当前国内外抗菌药物研究的一项重要内容。
抗菌肽(antibacterial peptides)是生物体内产生的一类具有抗菌活性的小分子多肽,已经开始受到研究人员的重视。家蝇从幼虫到成虫均表现出很强的环境适应能力,其体内外常携带多种病原菌,却极少出现集体发病的现象,就是源于其体内产生的多种抗菌肽及抗菌蛋白[3]。昆虫双翅肽作为抗菌肽中的重要组成成员对耐药菌株有明显的杀伤作用,且对正常体细胞没有破坏作用,主要对革兰氏阴性菌具有抑制作用[4]。为此,本研究以鸡源沙门氏菌诱导三日龄家蝇幼虫后构建的家蝇幼虫抑制性消减文库中筛选出来的双翅肽差异基因为基础,对MdDptI进行克隆及原核表达,以期为进一步研究其表达产物抗鸡致病性沙门氏菌的活性及其他免疫学活性提供参考。
1 材料与方法
1.1 材料
1.1.1 文库、菌株和表达载体 鸡源沙门氏菌诱导家蝇3日龄幼虫SSH文库,3’和5’-RACE Ready cDNA由吉林农业大学兽医药理学实验室完成[5]。大肠杆菌感受态菌株DH5α、BL21(DE3)、原核表达载体pET-28a(+)均由本实验室保存。
1.1.2 主要试剂及工具酶 SMARTTMRACE cDNA Amplification购自KitClontech公司。Ex TaqTMDNA聚合酶、限制性内切酶EcoR I、XhoI、Hind III、pMD18-T载体试剂盒、DL 2000TMDNA Marker、λ-Hind III digest DNA Marker、T4 DNA Ligase,均购自宝生物工程(大连)有限公司。异丙硫代β-D半乳糖苷(IPTG)、氨苄青霉素(AMP),均购自北京鼎国有限公司。DNA凝胶回收试剂盒购自上海生工生物工程技术服务有限公司。其余试剂均为国产分析纯。
1.2 方法
1.2.1 引物合成和DNA测序 引物合成和重组质粒测序由上海生工生物工程技术服务有限公司完成。
1.2.2 双翅肽基因的3’-RACE扩增和5’-RACE扩增 以鸡源沙门氏菌诱导的家蝇3日龄幼虫SSH文库中筛选的双翅肽序列,分别设计 3’-RACE和5’-RACE特异性扩增引物。5’-RACE特异性扩增引物 Gsp1(5’-CCGACGATAAGTCA⁃CAGCCACCTCC-3’),3’-RACE特异性扩增引物Gsp2(5’-CCACCACCACGGTAATCAGGACGAC-3’),并按照SMARTTMRACE cDNA Amplification Kit试剂盒说明书进行RACE扩增。扩增产物经1%琼脂糖凝胶电泳分离、回收目的DNA片段,与PMD-18T载体进行连接,转化DH-5α感受态细胞,将酶切验证筛选后的阳性克隆送样测序。
1.2.3 生物信息学分析 通过DNAMAN软件将克隆到的5’和3’末端序列拼接得到家蝇的全长cDNA序列。在 NCBI网站 http://blast.ncbi.nlm.nih.gov/Blast.cgi对全长cDNA序列进行BLASTN分析。运用在线工具http://www.ncbi.nlm.nih.gov/gorf/gorf.html寻找该序列的开放阅读框(ORF)并翻译成蛋白质序列。使用SignalP 4.1 Server在线工具预测该蛋白质序列前体信号肽,计算该蛋白的分子质量和等电点。利用NCBI网站http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi对MdDptI基因编码蛋白的保守区域进行搜索。
1.2.4MdDptI基因成熟肽的扩增 利用Primer5.0软件自行设计引物。所设计的引物序列为:(GSP3:5’GGGGGAATTCGACGATAAGTCACAG3’;GSP4:5’GCGCTCGAGCTACCATCTGTAAGTG3’),并在5’端分别添加EcoRⅠ和XhoⅠ酶切位点。以家蝇3日龄幼虫5’-RACE Ready cDNA模板进行扩增。扩增产物经1%琼脂糖凝胶电泳分离、回收目的DNA片段,与PMD-18T载体进行连接,转化DH-5α感受态细胞,将EcoRⅠ+XhoⅠ酶切验证筛选后的阳性克隆送样测序。该重组质粒命名为pMD18-T-MdDptI。
1.2.5 构建原核表达质粒pET-28a-MdDptI 将pMD18-T-MdDptI克隆重组质粒及表达载体pET-28a(+)用限制性内切酶EcoR I+XhoI进行双酶切,经1%琼脂糖凝胶电泳后,分别回收MdDptI片段和pET-28a表达载体片段,经过连接并转化至大肠杆菌DH5α感受态细胞。提取质粒进行双酶切鉴定,将获得的阳性质粒送样测序。该重组质粒命名为pET-28a(+)-MdDptI。
1.2.6 重组质粒的表达及SDS-PAGE分析 将pET-28a-MdDptI阳性质粒转化至大肠杆菌BL21(DE3)中,挑取阳性单克隆菌落接种于含Kan的300 mL液体培养基中,待OD600值在0.6~0.8之间,加入IPTG进行诱导表达。取300 mL菌液离心收集菌体,将诱导菌液进行超声波破碎后分别取上清和沉淀进行SDS-PAGE电泳[6]。
1.2.7 融合蛋白的亲和纯化 收集菌体后用TE(pH 8.0)洗涤沉淀2次,洗涤后对菌体超声破碎,4℃ 12000 r/min离心30 min,收集破碎后上清液,进行纯化,操作过程参照 GE healthcare的 His TrapTMHP说明书进行。
1.2.8 融合蛋白抑菌活性检测 收集融合蛋白,借助牛津杯法,检测融合蛋白对沙门氏菌的抑菌活性。取100 μL菌液(105cfu/mL)均匀涂布于LB平板上,放入牛津杯,杯内加入100 μL蛋白,37℃培养12 h,观察抑菌活性大小。
2 结果
2.1MdDptI基因的RACE扩增 3’RACE和5’RACE扩增产物经测序分析,结果显示,3’RACE获得一条450 bp的片段,5’RACE获得一条490 bp的片段(图1),拼接后得到419 bp的全长序列。
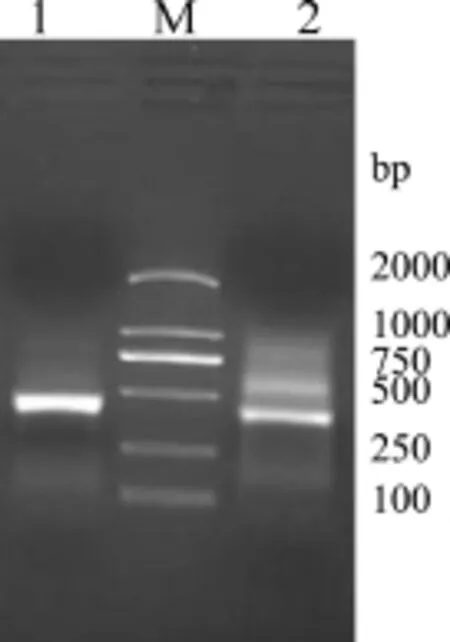
图1 MdDptI基因的3’和5’RACE扩增
2.2 序列分析MdDptI基因全长 419 bp。BLASTN分析发现MdDptI基因 cDNA序列与GenBank中登录号为FJ794602.1家蝇双翅肽基因同源性为95%。用NCBI的ORF Finder分析MdDptI基因的开放阅读框,该基因全长300 bp,编码99个氨基酸。利用SignalP4.1程序预测N端包括20个氨基酸残基的信号肽,说明其为分泌型蛋白。MdDptI成熟肽由79个氨基酸残基组成。理论分子量为 8.79 kD,理论等电点为 8.27,富含 Gly(15.19%)、Asp(11.39%)、Pro(10.13%)、Arg(8.86%)。运用NCBI的CDD程序对MdDptI基因编码成熟肽的保守区域进行搜索,结果显示扩增的MdDptI基因编码的成熟肽与Attacin_C超家族(Attacin_C superfamily)保守区域一致(图2)。
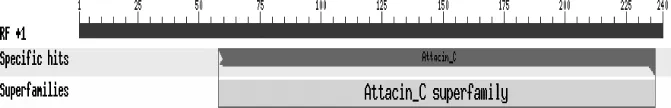
图2 NCBI中MdDptI成熟肽保守结构域分析
2.3MdDptI成熟肽片段的克隆 根据MdDptI基因的成熟肽基因序列,扩增得到一条240 bp的片段(图3A)。重组质粒pMD18-T-MdDptI的双酶切(图3B)和测序验证显示,MdDptI基因被成功克隆。

图3 MdDptI成熟肽基因的PCR扩增和pET-28a-MdDptI的双酶切鉴定
2.4 构建原核表达质粒pET-28a-MdDptI pET-28a-MdDptI重组质粒双酶切后,获得240 bp和5369 bp的片段(图4),分别为MdDptI和pET-28a(+)。表明MdDptI基因原核表达重组质粒构建成功。
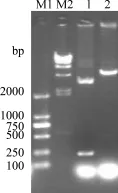
图4 重组质粒的酶切鉴定
2.5 重组质粒在大肠杆菌中表达产物的 SDSPAGE分析MdDptI的理论分子量约为8.8 ku,pET-28a(+)载体具有his标签蛋白,分子量约为3 ku。经过SDS-PAGE电泳检测,与未诱导样品比较,菌株在预期位置12 ku大小附近出现目的蛋白条带(图5)。
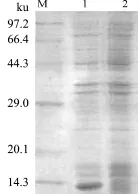
图5 重组质粒pET-28a-MdDptI在大肠杆菌中表达产物的SDS-PAGE分析
2.6 融合蛋白的纯化 取纯化后的融合蛋白进行Tricine-SDS-PAGE电泳检测,可见分子量约为12 ku的融合蛋白条带(图6)。

图6 纯化融合蛋白MdDptI
2.7 融合蛋白抑菌活性检测 实验以洗脱液为对照和纯化后融合蛋白进行抑菌效果检测,由图7可见,融合蛋白对沙门氏菌的抑菌圈直径为9 mm,而空白对照没有抑菌圈,说明融合蛋白对沙门氏菌有抑菌作用。

图7 融合蛋白对沙门氏菌的抑菌试验
3 讨论
抗菌肽的合成成本高,而大部分抗菌肽对蛋白酶都敏感,且抗菌肽或是对宿主菌本身又有毒性,或是表达的产物本身不具有抑菌活性,实验发现采用融合表达可以降低其碱性,并暂时改变抗菌肽的构像而降低其对宿主菌的毒性,增加产物的稳定性,避免被蛋白酶酶降解,所带的分子标签通过亲和层析来纯化[7]。因此,本文利用亲和层析技术纯化来获得活性较高的家蝇双翅肽MdDptI。抗菌肽作为昆虫先天免疫系统中非常重要的一类效应分子,当昆虫被病原微生物感染后,可通过受体模式识别入侵病原微生物,激活Toll或Imd信号途径,通过NF-κB(Nuclear transcription factor κB)核转录因子调控抗菌肽基因的表达,合成高效广谱的抗菌肽,杀灭外源微生物[8]。这些抗菌肽是从昆虫免疫器官分泌,主要从脂肪体释放进入血淋巴中,其浓度可以达到1~100 mM[9],能阻止病原微生物的继续侵染。家蝇抗菌肽作为新型抗菌药物,研究主要集中在家蝇防御素(defensin)、家蝇攻击素(attacin)、家蝇天蚕素(cecropin)等方面,家蝇双翅肽作为attacin中的主要成员,其分子的C端富含Gly,N端富含Pro,分子量为8~27 ku,主要抑制革兰氏阴性菌,但目前关于双翅肽的作用机制还不明确[10],有待进一步研究。
目前关于双翅肽的研究大多集中于对双翅肽的克隆以及表达模式。杨小蓉通过克隆得到家蝇抗菌肽基因diptericin并对其编码区蛋白进行原核表达[11],但未切除信号肽序列。王丽娜对MdDpt基因的成熟肽进行了克隆与表达并进行MdDpt抗血清的制备[12],二者都未就其抑菌活性进行研究。目前,关于MdDptI成熟肽的抑菌活性研究的报道很少,本研究将MdDptI基因的信号肽编码序列切除,只保留成熟肽基因,将其序列插入到载体pET-28a(+)中,构建重组表达质粒,并在BL21菌体中获得高效表达。本实验由于前期切除了信号肽序列,使其表达产物结构理论上更接近于MdDptI从脂肪体中释放到血淋巴中的天然构象,成为一种阳离子多肽,弥补了MdDptI基因体外表达后难以正确折叠的不足,并且确定了MdDptI对沙门氏菌的抑菌活性。本研究为MdDptI的表达、纯化以及抑菌机制的研究提供了参考。
[1]廖成水,程相朝,张春杰,等.鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J].中国兽医科学,2011,41(7):751-755.
[2]Yang B,Wang Q,Cui S,et al.Characterization of extendedspectrum beta-lactamases-producing<i>Salmonella</i>strains isolated from retail foods in Shaanxi and Henan Province,China[J].Food Microbiology,2014,42:14-18.
[3]赵 飞.家蝇抗菌活性物质研究进展[J].山西农业科学,2008,(9):23-26.
[4]Brey P T,Hultmark D.Molecular mechanisms of immune responses in insects[M].London:Chapman&Hall Ltd,1998.
[5]张 惠.沙门氏菌诱导家蝇幼虫 SSH文库构建及差异表达基因分析[D].长春:吉林农业大学,2011.
[6]时 红,陈 斌,何正波.东亚飞蝗 prolixicin基因的克隆与表达分析[J].应用与环境生物学报,2013,19(2):236-240.
[7]陈海旭,胡泰山,王 新,等.抗菌肽Diptericin cDNA的克隆及在E.coli中的融合表达[J].中国生物化学与分子生物学报,2001,17(2):182-184.
[8]万 玲,傅小蒙,唐 艳,等.家蝇幼虫防御素基因 MddI的克隆与原核表达 [J].中国兽医科学,2013,43(12):1280-1284.
[9]Hedengren M,Borge K,Hultmark D.Expression and Evolution of the<i>Drosophila Attacin/Diptericin</i>Gene Family[J].Bi⁃ochemical and biophysical research communications,2000,279(2):574-581.
[10]Yi H Y,Chowdhury M,Huang Y D,et al.Insect antimicrobial peptides and their applications[J].Applied microbiology and biotechnology,2014,98(13):5807-5822.
[11]杨小蓉.家蝇抗菌肽基因diptericin的克隆及其表达模式研究[D].广州:广东药学院,2009.
[12]王丽娜.家蝇MdDpt和MdAtt-2基因的克隆与表达[D].石家庄:河北大学,2010.
(编 辑:侯向辉)
Cloning and Prokaryotic Express of Diptericin I GeneMdDptI Mature Peptide Chain inMusca domesticaLarvae
SUN Xiao-ning1,PEI Zhi-hua1,BIAN Lu2,ZHANG Dan-dan1,MA Hong-xia1,3∗
(1.College of Animal Science and Technology,Jilin Agricultural University,Changchun130118,China;2.Economy of Liaoning Province Agriculture School,Liaoning,Jinzhou121001,China;3.Animal Production&Product Quality and Security of the Ministry of Education,Jilin Agricultural University,Changchun130118,China)
The study was done to clone and express gene ofMdDptI(Musca domesticaDiptericin I)being screened from SSH library bysalmonella,in order to lay the foundation for its bioactivity evaluation.Using cDNA end rapid amlification technology(RACE),MdDptI gene’s full-length cDNA was amplified,then recombonant expression plasmid was reconstructed using pET-28a,transformed intoE.coliBL21(DE3)and then induced by IPTG,the recombinant protein was verified by SDS-PAGE.With the aid of affinity to obtain purified fusion protein,the fusion protein was verified.The full-length cDNA ofMdDptI gene was 419 bp,in size,the openreading frame was 300 bp,encoding a 99-aminoacid protein,the homology of this gene’s cDNA sequence with theMdDptI from GenBank was up to 95%.The mature peptide recombonant expression plasmid pET-28a-MdDptI ofMdDptI gene was constructed,and the protein ofMdDptI gene was expressed successfully with the size of 12 ku,The purified fusion protein showed certain antibacterial activity.The result showed that the recombinant plasmid pET-28a-MdDptI was constructed correctly,which paved the way for further studies on theMdDptI protein expression and its biological activities.
Musca domestica;Musca domestica diptericin;clone;sequence analysis;prokaryotic expression
2014-09-14
A
1002-1280(2015)01-0001-05
S852.743
教育部新世纪优秀人才项目(NCET-10-0174);吉林省世行贷款农产品质量安全项目(2011-Y05);吉林省科技厅项目(20111820)
孙小宁,硕士,从事抗菌肽研究。
马红霞。E-mail:hongxia0731001@163.com

