清瘟败毒散超微粉中黄芩苷的薄层鉴别和含量测定研究
王 林,马 霞,郭振环,张国祖∗,金燕飞,王文文
(1.河南省康星药业股份有限公司,河南中牟451464;2.河南牧业经济学院,郑州450011)
清瘟败毒散超微粉中黄芩苷的薄层鉴别和含量测定研究
王 林1,马 霞2,郭振环1,张国祖2∗,金燕飞1,王文文1
(1.河南省康星药业股份有限公司,河南中牟451464;2.河南牧业经济学院,郑州450011)
分别建立了清瘟败毒散超微粉中黄芩苷的薄层鉴别方法和含量测定方法。采用聚酰胺薄膜为薄层板,乙酸乙酯-甲酸(6∶1)为展开剂,1%三氯化铁乙醇溶液为显色剂,可快速鉴别出黄芩苷成分。高效液相色谱法的色谱条件为:色谱柱为Hypersil ODS2 C18,流动相为甲醇-水-磷酸(47∶53∶0.2,检测波长为280 nm。结果显示,黄芩苷在12~72 μg/mL范围内线性关系良好,平均回收率为99.12%。黄芩苷在清瘟败毒散超微粉中的含量相对较高,且稳定可靠,可以作为质量控制的指标。
清瘟败毒散超微粉;黄芩苷;薄层鉴别;含量测定
清瘟败毒散是清代著名温病学家余师愚所创制的名方,载于其所著的《疫疹一得》一书中,现收录于《中华人民共和国兽药典》二○一○年版二部。本药由石膏、生地黄、黄芩等14味药材组成,是“白虎汤”、“黄连解毒汤”和“犀角地黄汤”三方加减化裁而得。清瘟败毒散具有清热泻火、凉血解毒之功效,在兽医临床上广泛用于畜禽流行性出血热、败血症、毒血症、尿毒症等疾病[1]。
中药超微粉是利用超微粉碎技术得到的中药超细粉,药物颗粒细度达到48 μm以下,细胞破壁率达到85%以上。其优势在于增加有效成分溶出率,提高生物利用度,减少用药量等。清瘟败毒散超微粉综合了清瘟败毒散和中药超微粉的优势,使清瘟败毒散药理作用得到最大发挥,不仅明显降低用药成本,且无污染、无残留,在兽医临床应用潜力巨大[2-3]。
目前清瘟败毒散的质量标准中仅有显微鉴别和黄连的薄层鉴别,很难完全控制药物的质量。此外,有关黄芩苷的薄层鉴别和含量测定研究多见于提取物、颗粒剂或口服液等剂型[4-5],鲜有散剂或超微粉制剂的相关研究。因此,本试验研究了清瘟败毒散超微粉中黄芩主要成分黄芩苷的薄层鉴别和含量测定方法,为其质量控制提供依据。
1 仪器与试剂
P230型高效液相色谱仪(配置紫外检测器),大连伊力特公司;AUW220D1电子天平,岛津国际贸易有限公司;GZX-9030 MBE电热恒温鼓风干燥箱,上海博讯实业有限公司医疗设备厂。
清瘟败毒散(批号14030201,河南省康星药业股份有限公司);清瘟败毒散超微粉(实验室自制,用超微粉碎技术将批号为14030201的清瘟败毒散粉碎至95%颗粒在48 μm以下);黄芩苷对照品(批号110715-201016,含量94.0%,中国食品药品检定研究院);聚酰胺薄膜(上海鑫楚实业有限公司)。
2 方法
2.1 黄芩苷的薄层鉴别
2.1.1 供试品溶液的制备 取清瘟败毒散及其超微粉各5 g,加乙醇30 mL,加热回流1 h,放冷,滤过,取续滤液作为供试品溶液。
2.1.2 对照品溶液的制备 取黄芩苷对照品10 mg,加乙醇溶解,定容至10 mL,制备成每1 mL含1 mg的对照品溶液。
2.1.3 黄芩阴性样品溶液的制备 按清瘟败毒散超微粉的处方和生产工艺制备不含黄芩的阴性样品,称取 5 g,按供试品制备方法制成阴性样品溶液。
2.1.4 薄层色谱法试验 分别吸取上述溶液各5 μL,点于同一聚酰胺薄膜上,以乙酸乙酯-甲酸(6∶1)为展开剂,展开,取出,晾干,喷以1%三氯化铁乙醇溶液。观察供试品溶液和阴性样品溶液在对照品位置是否出现相同的斑点。
2.1.5 实际样品的薄层鉴别 取批号为14030201的清瘟败毒散和超微粉样品,按照上述薄层鉴别方法处理,考察药材的不同粉碎程度对黄芩苷薄层鉴别的影响。
2.2 黄芩苷的含量测定
2.2.1 色谱条件 色谱柱为 Hypersil ODS2C18(5 μm,4.0 mm×150 mm);流动相为甲醇-水-磷酸(47∶53∶0.2);流速 1.0 mL/min;检测波长280 nm;进样量10 μL。
2.2.2 对照品溶液的制备 取60℃减压干燥4 h的黄芩苷对照品12.77 mg,用甲醇溶解并定容至100 mL量瓶中,得到1 mL含120 μg的溶液。精密吸取5 mL,定容至10 mL量瓶中,制成每1 mL含60 μg的对照品溶液,进样前过0.45 μm微孔滤膜。
2.2.3 供试品溶液的制备 取清瘟败毒散超微粉3 g,精密称定,加70%乙醇40 mL,加热回流3 h,放冷,滤过,滤液置100 mL量瓶中,用少量70%乙醇分次洗涤容器和残渣,洗液滤入同一量瓶中,加70%乙醇至刻度,摇匀。精密量取2 mL,置10 mL量瓶中,加甲醇至刻度,摇匀,即得,进样前过0.45 μm微孔滤膜。
2.2.4 阴性样品溶液的制备 按清瘟败毒散超微粉的处方和生产工艺制备不含黄芩的阴性样品,称取4.8 g,按照供试品溶液的制备方法制成阴性样品溶液,即得。
2.2.5 专属性试验 按照2.2.1色谱条件,分别吸取供试品溶液、对照品溶液和阴性样品溶液各10 μL注入液相色谱进行检测。观察在对照品出峰位置,供试品溶液和阴性样品溶液是否出现保留时间一致的色谱峰,以考察方法的专属性。
2.2.6 线性关系的考察 取120 μg/mL的对照品溶液,用甲醇稀释成72、60、48、30、12 μg/mL系列浓度。按浓度由低到高,吸取10 μL进样,记录峰面积。以浓度为横坐标,峰面积为纵坐标进行线性回归。记录回归方程和线性系数,考察线性关系。
2.2.7 精密度试验 取60 μg/mL的对照品溶液,连续进样6次,记录峰面积,统计相对标准偏差(RSD),考察系统的精密度。
2.2.8 重复性试验 取同一批次清瘟败毒散超微粉样品,称取6份,按照供试品制备方法处理,分别进高效液相色谱仪分析。计算含量,统计RSD,考察方法的重复性。
2.2.9 稳定性试验 取清瘟败毒散超微粉样品,按照供试品制备方法处理,于处理后的0、3、6、9、12、24 h分别进样。记录峰面积,计算RSD,考察方法的稳定性。
2.2.10 回收率试验 取已知含量(0.573%)的清瘟败毒散超微粉样品,称取9份,每份1.5 g,3份为1组。分别加入适量黄芩苷对照品,使3组的添加药量为原有药量的80%、100%和120%。按照供试品制备方法处理,用高效液相色谱仪分析,计算黄芩苷含量,统计平均回收率和RSD。
2.2.11 供试品含量测定 取批号为14030201的清瘟败毒散粉碎得到的超微粉样品,按照上述建立的方法处理,测定超微粉样品中黄芩苷的含量。
3 结果与分析
3.1 黄芩苷的薄层鉴别 黄芩苷对照品、黄芩阴性样品、清瘟败毒散和清瘟败毒散超微粉的薄层鉴别结果如图1,结果表明该方法阴性无干扰,可以用来鉴别两种剂型中的黄芩苷。

图1 黄芩苷的薄层鉴别图
3.2 黄芩苷的含量测定
3.2.1 专属性试验 在上述色谱条件下,供试品溶液出现黄芩苷的药物峰,保留时间约为13 min,黄芩阴性样品在药物峰处无干扰,说明方法专属性较好。对照品溶液、阴性样品溶液、清瘟败毒散超微粉样品的色谱图见图2-图4。
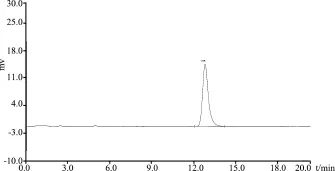
图2 黄芩苷对照品

图3 黄芩苷阴性样品
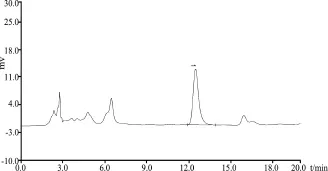
图4 清瘟败毒散超微粉样品
3.2.2 线性关系考察 黄芩苷的线性回归方程为y=79.513x-15.561,线性系数r=0.9993,表明在12~72 μg/mL浓度范围内黄芩苷浓度与峰面积线性关系良好。
3.2.3 精密度和重复性试验 对照品连续进样6次,峰面积的RSD为1.3%;同一批次样品重复测定6次,平均含量为0.574%,RSD为3.2%。表明方法的精密度和重复性良好。
3.2.4 稳定性试验 取供试品溶液,分别在0、3、6、9、12、24 h测定,结果黄芩苷峰面积的RSD为0.21%。表明供试品溶液在24 h内稳定。
3.2.5 回收率试验 加样回收试验测定结果见表1。该方法平均回收率99.12%,RSD为1.98%,回收率较高,满足含量测定要求。
3.2.6 供试品含量测定 清瘟败毒散超微粉样品重复测定3次,平均含量为0.579%。黄芩苷在该复方中的含量较高,可以作为清瘟败毒散超微粉的主要检测指标。

表1 回收率试验结果
4 讨论
黄芩苷的薄层鉴别研究分别尝试了硅胶G板和聚酰胺薄膜,发现其它条件相同条件下,两种薄层板都可以很好的鉴别出黄芩苷成分。因此,本鉴别方法可以用硅胶G板代替聚酰胺薄膜。此外,本试验对文献中不同的展开剂进行了筛选,分别选用乙酸乙酯-丁酮-甲酸-水(5∶3∶1∶1)[6]、甲苯-乙酸乙酯-甲醇-甲酸(10∶3∶1∶2)[7]、乙酸乙酯-甲酸(6∶1)进行对比。结果发现以乙酸乙酯-甲酸(6∶1)为展开剂的斑点较为清晰,且与杂质斑点分离较好。此外,该展开剂配制简单,也避免用到毒性较大的溶剂。
研究中黄芩苷的含量测定方法主要参考了《中华人民共和国兽药典》二○一○年版黄芩药材的测定方法[7]。分别从称样量、稀释倍数、进样量等条件进行优化,得到了稳定、快速、准确的含量测定方法。黄芩在处方中的所占比例为5.21%,而二○一○年版兽药典规定黄芩药材中黄芩苷含量不得低于9.0%。可以认为,清瘟败毒散超微粉中黄芩苷含量超过0.469%即为合格。因此,本试验检测的清瘟败毒散超微粉为合格样品。黄芩苷在该复方中的含量相对较高,可以作为质量控制的主要指标。
本试验尝试检测相同药材来源的清瘟败毒散中黄芩苷的含量,发现检测结果比超微粉含量低10%左右,说明该提取方法不能将黄芩苷从散剂中充分提取出来,不适合清瘟败毒散散剂的含量测定。但从另一方面看,中药进行超微粉碎后,细胞破壁增多,有效成分溶出量增加,提取率必然提高[8]。黄一帆等[9]比较了普通粉碎和超微粉碎对黄连解毒汤中黄芩苷溶出量的影响,发现相同提取条件下超微粉的溶出量比细粉提高32%以上,这与本试验结果相一致。在兽医临床中,超微粉的这种优势提高了中药的生物利用度,也降低了用药成本。因此,预期中药超微粉会成为未来中兽药发展的一个重要方向。
[1]吴元才.加味清瘟败毒散防治猪高热病的临床试验[J].中兽医学杂志,2008,(3):18-19.
[2]周希平,付夫根.中药超微粉在兽医临床的应用前景[J].中兽医学杂志,2011,(2):53-54.
[3]李 茜,侯海锋.中药超微粉在畜禽养殖业中的应用前景[J].动物医学进展,2010,31(S):260-262.
[4]彭小萍.热感宁胶囊中黄芩苷含量的测定[J].内蒙古中医药,2014,(5):57-58.
[5]蒋俊毅,李 祥,邱蓉丽,等.消炎灵口服液中黄芩苷含量的测定[J].中西医结合学报,2005,3(1):54-56.
[6]王 野.小儿感冒宁糖浆的薄层鉴别及黄芩苷的含量测定[J].成都中医药大学学报,2006,29(2):59-64.
[7]中国兽药典委员会.中华人民共和国兽药典二○一○年版二部[S].
[8]张国祖,王 林,于 瑞,等.不同条件对扶正解毒散及其超微粉有效成分溶出影响的研究[J].黑龙江畜牧兽医,2013(11):148-150.
[9]黄一帆,李富文,马玉芳,等.超微粉碎对黄连解毒汤中黄芩苷溶出的影响[J].福建农林大学学报:自然科学版,2004,33(2):215-218.
(编 辑:陈 希)
Study on the TLC Identification and Quantitative Determination of Baicalin in Qingwen Baidu San Ultra-Fine Powder
WANG Lin1,MA Xia2,GUO Zhen-huan1,ZHANG Guo-zu2∗,JIN Yan-fei1,WANG Wen-wen1
(1.Henan Kangxing Pharmaceutical Co.,Ltd,Zhongmou,Henan451464,China;2.Henan University of animal husbandry&economy,Henan450011,China)
A TLC identification method and a quantitative determination mthod were established for baicalin in Qingwen Baidu San ultra-fine powder.The polyamide chromatography plate was used,developing solvent was acetidine-formic acid(6∶1)and the chromogenic agent was 1%ferric chloride ethanol solution.In this condition,baicalin was identified quckly.The HPLC methods were as follows:chromatographic column was Hypersil ODS2 C18,mobile phase was methanol-water-phosphate(47∶53∶0.2),and the detective wavelength was 280 nm.Results showed that baicalin had good linear relationship in the range of 12~72 μg/mL,the average recovery rate was 99.12%.The content of baicalin in Qingwen Baidu San ultra-fine powder was high and stable,so it can be used as the quality index.
Qingwen Baidu San ultra-fine powder;baicalin;TLC identification;quantitative determination
2014-09-26
A
1002-1280(2015)01-0033-04
S853.72
河南省重点科技攻关项目(122102110185,122102110224),河南省成果转化项目(132201310002)
王 林,硕士,从事中兽药开发与应用研究。
张国祖。E-mail:zhangguozu@126.com

