多中心性骨肉瘤治疗及预后六例报告
张增亮 李南 陈秉耀 宋光泽 王硕 韦兴
多中心性骨肉瘤 ( multifocal osteosarcoma,MFOS ) 这一概念最早是于 1936 年由 Silverman 提出,是指在患者初次就诊时,存在两个或者两个以上的骨肉瘤病灶,初次就诊时无肺部或者其它软组织的转移[1-4]。该病发病率很低,仅占骨肉瘤患者的1%~10%,对放疗、化疗均不敏感,预后差[5-9]。MFOS 是多中心起源还是转移,目前仍没有定论。Amstutz[3]对此概念进行了完善,并提出了 MFOS Amstutz 分型。2010 年 3 月至 2014 年 12 月,我院共收治 6 例 MFOS 患者,现将其治疗及预后情况总结如下。
资料与方法
一、一般资料
本组 6 例,其中男 4 例,女 2 例,中位年龄为13 ( 5~16 ) 岁。按 Amstutz 分型,I 型 4 例 ( A1~A4 ),III A 型 2 例 ( B1、B2 )。所有患者有临床表现后行影像学检查及病理学检查证实多中心骨肉瘤诊断,初次就诊时均无明确的肺部病灶,其中 III A 型的 2 例在治疗过程中分别在初诊后 6 个月及 13 个月出现第 2 处骨肉瘤病灶 (表1)。I 型的 4 例在诊断时碱性磷酸酶明显升高 ( 均>1500 U / L )。X 线片主要表现是在病变区有斑点状的骨破坏,边缘有骨质密度增高,周围可见骨膜反应及可见 Codman三角,邻近软组织肿胀,内见斑片状高密度影,边界不清;全身骨扫描可见至少 2 处的放射性浓聚区( 图 1~2 )。病理证实骨肉瘤。
二、治疗方法
A1 患者在确诊多发性骨肉瘤后因经济原因放弃治疗,其余 5 例均给予 MAPI 方案,其 1 个周期的用药为:第 1~2 天给予阿霉素 60 mg / m2,1 次 /天;第 3 天给予顺铂 100 mg / m2,1 次 / 天;第 14 天给予甲氨蝶呤 8~12 g / m2、长春新碱 1.4 mg / m2,1 次 / 天;第 21~25 天给予异环磷酰胺 12.5 g / m2,1 次 / 天。前、后 2 次化疗间隔时间为 3 周。其中有4 例 ( A3、A4、B1、B2 ) 在接受 1~2 次化疗后给予手术治疗,手术以切除最大瘤体为主。
三、随访方法
所有患者均进行随访。继续治疗者门诊随访,放弃治疗者电话随访,每 3 周随访 1 次。
四、统计学分析
累积生存率采用 SPSS 16.0 软件 Kapla-Meier 曲线进行计算。
结 果
生存情况:本组中 1 例 ( A1 ) 因经济原因放弃治疗,存活 5 个月,因呼吸衰竭死亡。其余 5 例均接受了阿霉素、顺铂、甲氨蝶呤及异环磷酰胺的联合化疗方案:其中 1 例 ( A4 ) 发病至今 4 个月,仍在治疗中;1 例 ( A2 ) 接受 6 次联合化疗,因家属不同意未进行手术治疗,生存 19 个月,因呼吸衰竭死亡;1 例 ( A3 ) 因右大腿疼痛剧烈,行截肢术,术后存活6 个月,生存时间短,可能与手术后因伤口愈合需要时间、不能及时化疗有关,最终死亡原因为左肩部肿物快速生长,皮肤破溃,导致局部感染、高热,进而全身感染;1 例 ( B1 ) 接受手术及 3 次化疗后存活 13 个月死亡,死亡原因为消化道出血引起的循环衰竭;1 例 ( B2 ) 接受手术联合 4 次联合化疗后,生存18个月,因呼吸衰竭死亡。12 个月累积生存率60%,18 个月累积生存率 20% ( 表 2,图 3 )。

表1 患者一般情况Tab.1 General conditions of the patients
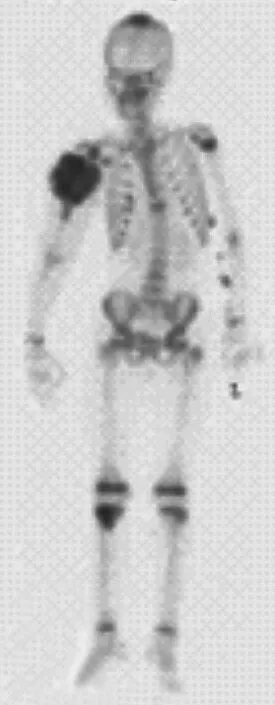

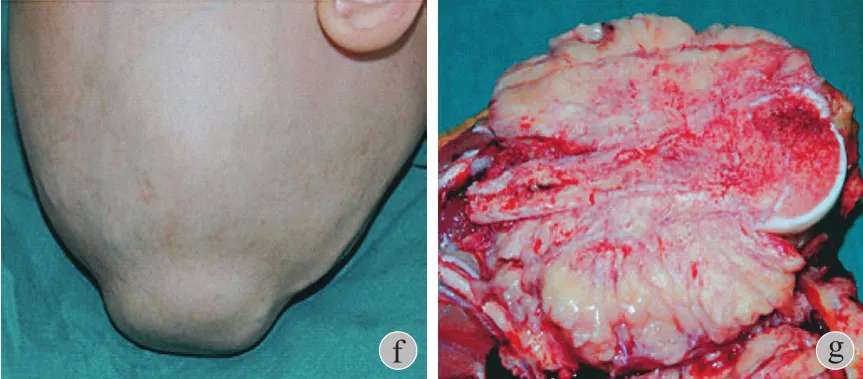
图1 病例 A4,女,12 岁 a:全身骨扫描提示右肱骨近端、颅骨、右胫骨近端放射性浓聚灶;b~c:X 线片显示右肱骨近端及右胫骨近端骨密度明显增高;d:右肱骨 MRI 显示巨大软组织肿块;e~f:显示右肱骨及头部肿物大体照;g:右上肢截肢后大体标本;h:右上肢截肢后 X 线片表现Fig.1 A 12-year-old female patient ( A4 ) a: A whole body bone scan showed multiple foci in the right proximal humerus, skull and proximal tibia with abnormal bone uptake; b-c: The X-ray showed pure and patchy osteosclerotic lesions in the right proximal humerus and proximal tibia; d: The MRI in the right proximal humerus showed a great mass of soft tissues; e-f: The picture of the right proximal humerus and skull; g: The postoperative sample of the right proximal humerus; h: The postoperative X-ray of the right proximal humerus

图2 A2,男,14 岁。全身骨扫描:颅骨多发,双侧肩关节,肋骨多发,胸腰椎,骨盆、髋臼,股骨、胫骨等多处放射性浓聚区。右股骨、肱骨正侧位 X 线片显示骨密度增高伴软组织肿块Fig.2 A 14-year-old male patient ( A2 ). A whole body bone scan showed multiple foci in the skull, bilateral shoulder joints, ribs,vertebra thoracalis, vertebra lumbalis, pelvis, acetabular bone, femur and tibia with abnormal bone uptake. The anteroposterior and lateral X-ray showed pure and patchy osteosclerotic lesions in the right proximal tibia and proximal humerus with a great mass of soft tissues

图3 生存曲线Fig.3 The overall survival of the patients
讨 论
一、流行病学
MFOS 好发于青少年,国内报道男性发生率较女性高,国外的报道男女比例基本相同[10]。本单位收治的 6 例均为青少年,男 4 例,女 2 例,这与文献报道相符。MFOS 的发病部位多见于长骨的干骺端、骨盆、脊柱以及肋骨,本组 6 例中先后均出现股骨及胫骨的病灶,与文献报道的以股骨远端和胫骨近端为高发部位一致。
MFOS 的诊断有以下依据:( 1 ) 发病迅速,多个骨肉瘤病灶同时、对称出现;( 2 ) 各个病灶的大小及病理分级类似;( 3 ) 通常单个骨肉瘤很少见骨转移;( 4 ) 患者没有 Paget 病,没有接触过大量的放射线及致癌物质。本单位 MFOS 的发生率为 11.3%( 6 / 53 ),与文献报道的 10% 接近[9]。
二、发病机制
1. 多中心还是转移:MFOS 到底是转移还是多中心,目前仍存在争议。多数学者认为骨肉瘤是多中心起源的,骨肉瘤很少通过骨转移,其它部位骨骼病变可能因为病灶小,未及时发现,认为发病时即存在多中心病变[11-12]。本组病例中,4 例在初诊时即存在多处骨肉瘤病灶,支持多中心起源的学说。还有部分学者认为,MFOS 为一个骨肉瘤病灶转移到其它部位所致,即转移起源论[10,13]。本组病例中 B2 患者初诊时仅发现右股骨远端肿瘤,术前化疗及右髋离断术后 ALP 从 4047 U / L 下降为72 U / L, LDH 从 890 U / L 降为 148 U / L,证实其治疗效果较满意,术后行 ADMI 方案化疗 1 个周期后,因经济情况放弃化疗,术后 9 个月复查肺 CT 发现左肺门巨大转移灶,但头颅 CT 未见异常,术后12 个月全身骨扫描提示颅骨代谢异常,进一步影像学证实颅骨病灶,行局部放疗 1 个周期,并行化疗2 个周期,最终因左肺巨大占位、双侧胸腔积液,引起呼吸困难、呼吸衰竭死亡,共存活18个月。结合本例情况,该患者肺部病灶出现时头颅 CT 并未见异常,入院时骨扫描颅骨未见异常,在发现肺转移后 3 个月,骨扫描及 MRI 才证实颅骨存在病灶。笔者认为 MFOS 有骨转移可能性,而关于多中心骨肉瘤的发病机制尚须进一步的研究来证实。
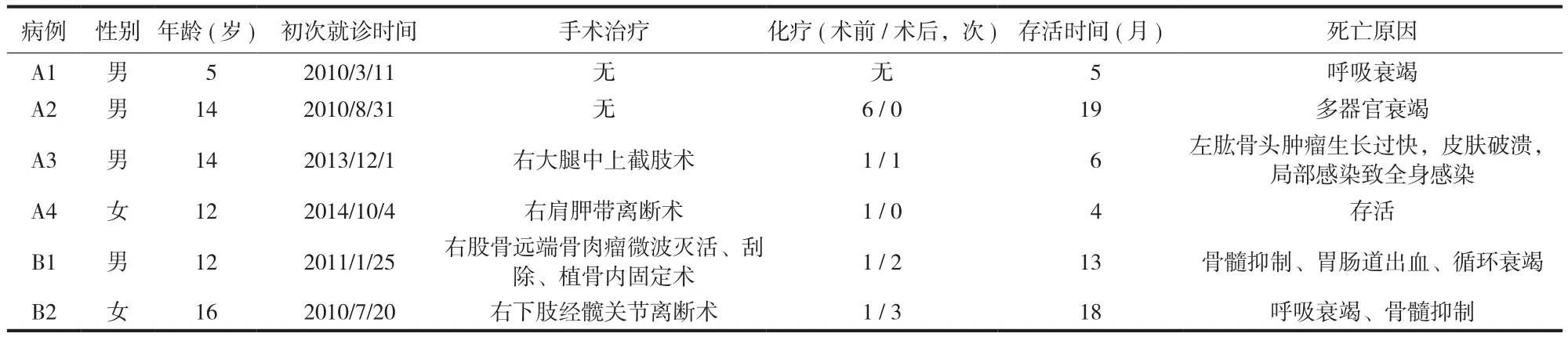
表2 患者治疗情况及预后Tab.2 Treatment and prognosis of the patients
2. 基因学研究:骨肉瘤的发生是多基因、多步骤、多阶段、多重损伤并存的过程。大多学者认为,由于细胞核 DNA 分子破坏,细胞不能修复受损的 DNA 分子,其继续存在并复制可激活癌基因和 ( 或 ) 抑癌基因异常,则可发展成为骨肉瘤。郭卫等[14]对国内情况进行报道,46 例骨肉瘤中 27 例( 58.7% ) 有 p53 蛋白高表达,有肺转移的为 75%,无转移者为 55.5%。国外也有研究显示,在 MFOS的患者中 p53 基因突变发生率很高,这强烈提示 p53基因在 MFOS 的发病中起重要作用[15]。
三、诊断
MFOS 的诊断主要依靠影像学及病理诊断。影像学包括 X 线或 CT 检查,大病灶表现为骨质破坏明显,骨髓腔密度增高,呈团块状硬化改变,骨膜反应明显,可见层状骨膜反应及 Codman 三角,周围可见不规则软组织肿块形成,而多发的小病灶多表现为骨质内圆形或者椭圆形的高密度灶,骨皮质尚连续,无明显骨膜反应及软组织肿块。MRI 影像学表现:骨质破坏,呈长 T1、长 T2信号,可累及骺板及骨骺,皮质低信号影局部中断;骨膜反应,皮质增厚或放射状低信号影;软组织肿块,呈稍长 T1、稍长 T2信号;髓腔内跳跃性病灶,远处骨质出现片状长 T1、长 T2信号,STIR 序列呈高信号,与肿瘤之间存在正常骨质,增强后可见环状或不规则强化。MRI 不但能清楚显示骨肉瘤的软组织肿块,而且能显示肿瘤对周围肌肉、血管的侵犯程度,有利于手术方案的制订。全身骨显像 ( ECT ) 可以协助诊断全身骨骼发病情况。
除影像学检查外,碱性磷酸酶和乳酸脱氢酶可以作为判断骨肉瘤发展程度的重要指标,本组中有 5 例在初诊时血清碱性磷酸酶升高在 1500 U / L以上,同时乳酸脱氢酶也明显升高。B1 患者手术后 ALP 及 LDH 分别为 204 U / L、184 U / L,去世前ALP 达到了 4134 U / L,LDH 达到了 1643 U / L。
四、治疗及预后
MFOS 发病率低,临床相关研究较少,病情进展较快,临床预后较差。目前对 MFOS 的生存率及疗效尚缺乏大宗病例统计。Bacci 等[7]统计 42 例MFOS 患者,经过积极的综合治疗后,中位生存时间仅 23 个月,其中病灶的数目、原发病灶是否手术、多发瘤灶的手术数目影响患者的预后。MFOS治疗原则与骨肉瘤基本相同,大剂量的化疗联合手术的综合治疗模式[7,16-17]。阿霉素、顺铂、甲氨蝶呤、异环磷酰胺联合的方案是目前公认的对骨肉瘤最有效的新辅助化疗方案之一[17]。MFOS 采用手术切除最大瘤体,会减轻疼痛,减少瘤体负荷,增加化疗药物的作用强度,但有时会因围手术期而耽误化疗时间,加剧其它部位肿瘤的生长,存活时间可能会更短。陈秉耀等[18]采用微波灭活治疗骨肉瘤也有一定的疗效。对于 MFOS 较小的病灶是否可以选择微波灭活,进而对多部位肿瘤进行干预,值得进一步探讨。
笔者认为化疗不能按计划完成也是 MFOS 疗效差的原因之一。部分患者因全身情况差不能耐受化疗,部分因经济原因不能使用化疗药物,最终规律治疗的患者较少。本组 6 例仅有 2 例相对规律治疗并最终在医院去世,其他患者均最后放弃治疗出院。化疗中,患者及家属对治愈此病信心不足,悲观、情绪差,也是不能坚持化疗的一个原因。我科试行联合精神卫生科协助药物及心理治疗,取得一定疗效。ADMI 化疗方案证实为骨肉瘤的标准治疗方案,初诊时就多处骨肉瘤病灶的患者较单一病灶患者化疗反应明显差[13]。
总之,MFOS 发病率低,好发于青少年,疾病进展迅速,对手术及化疗的反应差,预后差,坚持化疗有可能会延长 MFOS 患者的生存期。对该疾病需要进行更深层面的研究,更深入地认识该疾病,从而更好地指导临床治疗,改善预后。
[1] Silverman G. Multiple osteogenic sarcoma. Arch Pathol, 1936,21(5):88-95.
[2] Daffner RH, Kennedy SL, Fox KR, et al. Synchronous multicentric osteosarcoma: the case for metastases. Skeletal Radiol, 1997, 26(10):569-578.
[3] Amstutz HC. Multiple osteogenic sarcomata-metastatic or multicentric? Report of two cases and review of literature.Cancer, 1969, 24(5):923-931.
[4] Parham DM, Pratt CB, Parvey LS, et al. Childhood multifocal osteosarcoma. Clinicopathologic and radiologic correlates.Cancer, 1985, 55(11):2653-2658.
[5] Jones RD, Reid R, Balakrishnan G, et al. Multifocal synchronous osteosarcoma: the Scottish bone tumour registry experience. Med Pediatr Oncol, 1993, 21(2):111-116.
[6] Jaffe N, Pearson P, Yasko A, et al. Single and multiple metachronous osteosarcoma tumors after therapy. Cancer,2003, 98(11):2457-2466.
[7] Bacci G, Fabbri N, Balladelli A, et al. Treatment and prognosis for synchronous multifocal osteosarcoma in 42 patients. J Bone Joint Surg Br, 2006, 88(8):1071-1075.
[8] Campanacci M. Bone and soft tissue tumors. 2nd ed. Padova:Piccin Nuova Libraria. 1999: 507-518.
[9] Unni KK. Dahlin’s bone tumors: general aspects and data on 11087 cases. 5th ed. Philadelphia: Lippincott-Raven. 1996:143-183.
[10] 郭卫, 李大森, 沈丹华, 等. 多中心成骨肉瘤的治疗. 中华骨科杂志, 2006, 26(6):376-380.
[11] Fitzgerald RH Jr, Dahlin DC, Sim FH. Multiple metachronous osteogenic sarcoma. Report of twelve cases with two long-term survivors. J Bone Joint Surg Am, 1973, 55(3):595-605.
[12] Mahoney JP, Spanier SS, Morris JL. Multifocal osteosarcoma:a case report with review of the literature. Cancer, 1979,44:1897-1907.
[13] Hopper KD, Moser RP Jr, Haseman DB, et al. Osteosarcomatosis. Radiology, 1990, 175:233-239.
[14] 郭卫, 王申五, 冯传汉, 等. 骨肉瘤标本中P53抗癌基因异常的研究. 中华外科杂志, 1994, 32(7):412-415.
[15] Iavarone A, Matthay KK, Steinkirchner TM, et al. Germline and somatic p53 gene mutations in multifocal osteogenic sarcoma. Proc Natl Acad Sci USA, 1992, 89:4207-4209.
[16] Jaffe N, Pearson P, Yasko AW, et al. Single and multiple metachronous osteosarcoma tumors after therapy. Cancer,2003, 98(11):2457-2466.
[17] Bacci G, Briccoli A, Rocca M, et al. Neoadjuvant chemotherapy for osteosarcoma of the extremities with metastases at presentation: recent experience at the Rizzoli Institute in 57 patients treated with cisplatin, doxorubicin, and a high dose of methotrexate and ifosfamide. Ann Oncol, 2003, 14(7):1126-1134.
[18] 陈秉耀, 韦兴, 李南, 等. 微波消融治疗下肢长骨骨肉瘤15例随访报告. 中国骨与关节杂志, 2014, 3(4):272-276.

