酯化微孔玉米淀粉制备及其吸附番茄红素的研究
龙海涛,孙 艳,张慧秀,牛红艳,蒲陆梅,2,*
(1.甘肃农业大学理学院,甘肃兰州730070;2.甘肃农业大学农业资源化学与应用研究所,甘肃兰州730070;3.甘肃农业大学食品科学与工程学院,甘肃兰州730070)
酯化微孔玉米淀粉制备及其吸附番茄红素的研究
龙海涛1,2,3,孙 艳3,张慧秀1,牛红艳1,蒲陆梅1,2,*
(1.甘肃农业大学理学院,甘肃兰州730070;2.甘肃农业大学农业资源化学与应用研究所,甘肃兰州730070;3.甘肃农业大学食品科学与工程学院,甘肃兰州730070)
为了提高番茄红素的储存稳定性,首先以玉米淀粉为原料,辛烯基琥珀酸酐为酯化剂,α-淀粉酶为酶解剂,制备了酯化微孔淀粉,测定了酯化微孔淀粉的取代度及水解度,并通过红外光谱及扫描电镜对其进行了表征。其次将其应用于吸附番茄红素,以番茄红素吸附量为指标,考察了吸附浓度、吸附时间、吸附温度的影响,并测定了酯化微孔淀粉吸附番茄红素的饱和吸附量。最后测定了酯化微孔淀粉吸附番茄红素在自然光、紫外光、不同温度及氧气存在不同条件下的稳定性。结果表明,制备的酯化微孔淀粉取代度DS=0.0227,水解度DE=0.46,且经红外光谱及扫描电镜表征说明制备的酯化微孔淀粉不仅成功引入了酯基且具有良好的开孔性能。单因素实验表明较佳吸附浓度、吸附时间、吸附温度分别为10 μg/mL,30 min,45℃。酯化微孔淀粉对番茄红素饱和吸附量高达225.45 μg/g。稳定性实验表明,酯化微孔淀粉吸附的番茄红素具有良好的稳定性,因此酯化微孔淀粉可用于番茄红素的保存。
酯化微孔淀粉,吸附,番茄红素
微孔淀粉是指通过物理、化学、生物的方法作用于原淀粉颗粒,使得淀粉颗粒表面布满直径为1 μm左右的小孔,从而允许小分子进入淀粉颗粒的内部[1]。近年来,使用微孔淀粉吸附及包埋天然产物的提取物,从而延长天然产物提取物的货架期引起了大家的广泛关注,如多孔淀粉吸附葵花籽油[2],叶黄素[3],大蒜素[4]等。由于淀粉自身结构的限制,微孔淀粉对于亲油性物质的吸附能力是有限的,而辛烯基琥珀酸酯淀粉由于它的两亲性,在微孔淀粉的基础上引入辛烯基,从而提高了其对于亲油性物质的吸附能力[5]。
番茄红素是一种重要的脂溶性天然色素。具有良好的抗氧化性而受到关注,但是其存在容易异构化[6],限制了其应用。本文主要研究内容是制备酯化微孔淀粉,并探讨其吸附番茄红素的能力及吸附稳定性,从而为酯化微孔淀粉吸附番茄红素,并提高番茄红素储存稳定性提供理论支持。
1 材料与方法
1.1 材料与仪器
玉米淀粉 食品级,甘肃省临洮县华泰玉米深加工有限责任公司;α-淀粉酶(酶比活力≥2000 U/g,实测酶比活力为2600 U/g) 上海源叶生物科技有限公司;辛烯基琥珀酸酐 分析纯,杭州中香化学有限公司;番茄红素(纯度为91%) 实验室自制。
722型可见分光光度计 上海欣茂仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市予华仪器有限责任公司;DF-101 S集热式磁力加热搅拌器 金坛市顺华仪器有限公司
1.2 实验方法
1.2.1 酯化微孔玉米淀粉的制备 酯化淀粉制备方法参考文献[7],其中淀粉乳浓度为40%,酸酐用量占淀粉干基15%,反应温度为30℃;以酯化淀粉为原料制备酯化微孔淀粉方法参考文献[8],其中酯化淀粉乳浓度为30%,α-淀粉酶占淀粉干基2%,反应温度为60℃,水解时间为15 h。
1.2.2 酯化微孔玉米淀粉取代度及水解度测定 取代度测定方法见参考文献[9],水解度测定方法见参考文献[10]。取代度的计算按照下式:

式中:DS—产品取代度;A—每克辛烯基琥珀酸玉米微孔淀粉酯所消耗的标准NaOH溶液的物质的量,mmol。
水解度的计算按照以下公式计算:

式中:C为水解液还原糖浓度,mg/mL;V为反应体系中液相浓度,mL;0.9为从葡萄糖到淀粉的转化系数;m为反应前底物质量,g。其中水解液中还原糖浓度的测定按照3,5-二硝基水杨酸比色定糖法进行测定。
1.2.3 酯化微孔玉米淀粉红外分析 称取少量干燥的样品置于玛瑙研钵内与溴化钾粉末充分混合后研磨,将混合物压膜制片,取出样品薄片,置于样品架上,用傅里叶红外光谱仪在500~4000cm-1波数范围内扫描。
1.2.4 酯化微孔玉米淀粉扫描电镜 将样品真空下镀金后,置于扫描电镜下观察。
1.2.5 番茄红素吸附量的测定 番茄红素标准曲线的确定参见参考文献[11]。番茄红素吸附量的确定参见参考文献[12]。番茄红素标准曲线方程y=0.2307 x-0.0155,此方程相关系数为0.9997。番茄红素吸附量按下式计算:
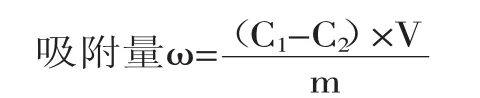
式中:ω—吸附量,μg/g;C1—吸附前番茄红素溶液的浓度,μg/mL;C2—吸附后番茄红素溶液的浓度,μg/mL;V—番茄红素溶液的体积,mL;m—用于吸附番茄红素的样品干重,g。
1.2.6 单因素实验 以酯化微孔吸附番茄红素的吸附量为指标,探讨不同的吸附浓度、吸附时间、吸附温度对吸附量的影响。
1.2.6.1 吸附浓度对吸附量的影响 取0.5 g酯化微孔淀粉为吸附剂,对20 mL浓度为4、6、8、10、12、14、16、18、20 μg/mL的番茄红素溶液进行吸附,吸附时间为60 min,吸附温度为室温,研究吸附浓度对于吸附量的影响。
1.2.6.2 吸附时间对吸附量的影响 取0.5 g酯化微孔淀粉为吸附剂,对20 mL浓度10 μg/mL的番茄红素溶液吸附,吸附时间分别为10、20、30、40、50、60 min,吸附温度为室温,研究吸附时间对于吸附量的影响。
1.2.6.3 吸附温度对吸附量的影响 取0.5 g酯化微孔淀粉,20 mL浓度10 μg/mL的番茄红素溶液进行吸附,分别在30、35、40、45、50、55、60℃的水浴中振荡60 min,研究吸附温度对于吸附量的影响。
1.2.7 番茄红素饱和吸附量的测定 将浓度为10 μg/mL番茄红素溶液持续流过淀粉柱,直至柱下端流出液吸光度不再增大为止[13],记录消耗掉溶液的体积,测定吸附前后溶液的吸光度,根据标准曲线和吸附量计算公式即可求得淀粉对番茄红素的饱和吸附量。
1.2.8 酯化微孔淀粉吸附番茄红素的稳定性实验以番茄红素的损失率为指标,分别将酯化微孔淀粉吸附的番茄红素置于自然光、紫外光、不同温度、氧气条件下进行实验,并以玉米淀粉吸附的番茄红素为对照,研究其储存稳定性。
1.2.8.1 光照对吸附番茄红素稳定性影响 将吸附番茄红素饱和的玉米淀粉、玉米酯化微孔淀粉放置于透明的玻璃瓶中抽真空充氮气密封储存,分别在室温下接受室外自然光的照射[14],每隔2 d取样测定番茄红素损失率,以及室温下在自制的紫外光的暗盒(自制规格:40 cm×20 cm×20 cm)进行照射,每隔12 h取样,按下式计算番茄红素损失率。研究光照对于番茄红素损失率的影响。
1.2.8.2 温度对吸附番茄红素稳定性影响 分别取吸附番茄红素饱和的玉米淀粉、玉米酯化微孔淀粉置于透明的玻璃瓶中抽真空充氮气密封储存,而后将其置于烘箱中,分别在40、70、100℃三个温度下进行加热,每隔2 h取样测定其损失率,以测定温度对于番茄红素稳定性的影响,研究温度对于番茄红素稳定性的影响。
1.2.8.3 氧气对吸附番茄红素稳定性影响 取吸附番茄红素饱和的玉米淀粉、玉米酯化微孔淀粉置于透明的玻璃瓶中敞口保存,保存温度为40℃,自然光照射,每隔8 h测定其番茄红素保留率。同时另准备样品抽真空充氮气密封储存,作为对照,以观察氧气对于番茄红素损失率的影响,研究氧气对于番茄红素稳定性的影响。
1.2.9 数据处理 全部数据采用Origin7.5统计分析,图中数据为平均means±SD,数据分析使用SPSS Statistics 19.0专业版统计软件进行Duncan’s差异显著性处理。
2 结果与分析
2.1 酯化微孔淀粉取代度及水解度测定
以葡萄糖浓度为横坐标,溶液的吸光度为纵坐标,得到葡萄糖浓度C与吸光度A的关系式为:y= 0.6786x-0.025,R2=0.9998,p<0.0001,表明该曲线在葡萄糖浓度为0.2~1.2 μg/mL的范围内线性关系良好。经过测定所制备的酯化微孔淀粉取代度DS= 0.0227,水解度DE=0.46。
2.2 酯化微孔淀粉表征
2.2.1 酯化微孔淀粉红外光谱图 由图1可以看出,波数3438 cm-1具有-OH伸缩振动吸收峰,波数2933 cm-1出现了C-H的伸缩振动吸收峰,波数1648 cm-1处出现的是属于淀粉结合水的吸收峰,波数1159、1081、1016 cm-1处属于-C-O的伸缩振动[15],酯化玉米淀粉与原淀粉相比出现了两个新的吸收峰,波数1725 cm-1处出现的吸收峰属C=O的特征吸收峰,波数1575 cm-1处的吸收峰,属RCOO-的特征吸收峰[16],这说明玉米淀粉经辛烯基琥珀酸酐变性后引入了新的官能团RCOO-和-C=O。此外,酯化微孔淀粉与酯化淀粉相比,没有出现新的吸收峰,但酯化微孔淀粉的吸收强度降低,主要是由于微孔酯化淀粉中的部分直链淀粉被水解。

图1 玉米淀粉与玉米酯化微孔淀粉的红外光谱Fig.1 FTIR spectra of corn starch and corn porous starch
2.2.2 酯化微孔玉米淀粉颗粒结构 玉米淀粉经过酯化,在淀粉颗粒的表面产生了沟壑状,如图2(b);随着水解时间的延长,淀粉酶淀粉颗粒的内部进行水解,促使淀粉颗粒上出现众多的针状小孔,如图2(c);随着淀粉酶继续在淀粉颗粒内部进行水解,孔洞逐渐的增大,并在淀粉内部产生了空腔,从而产生了类似蜂窝状的中空结构,这些空腔为微孔淀粉吸附番茄红素提供了良好的依据,如图2(d)。但是水解过度则会导致空腔碎裂,如图2(e)所示。综上所述,水解时间为15 h的酯化微孔淀粉,即具有良好的开孔性能,又不至于水解过度造成淀粉颗粒的破裂,从而降低其比表面积,造成吸附能力的下降。

图2 玉米淀粉、酯化微孔淀粉SEM照片Fig.2 SEM diagram of corn starch and esterified microporous starch
2.3 单因素实验
2.3.1 吸附浓度对吸附量的影响 由图3可以看出,玉米微孔酯化淀粉的吸附量随着番茄红素浓度的不断增大而增大,在番茄红素浓度达到10 μg/mL之前随着番茄红素浓度增加,吸附量显著上升,当番茄红素浓度达到10 μg/mL以后,随着番茄红素溶液浓度的增加,吸附量增加不显著。因此较适宜吸附浓度为10 μg/mL。

图3 吸附浓度对酯化微孔淀粉吸附能力的影响(25℃)Fig.3 Effect of concentration of solution on the adsorption property of esterified microporous starch
2.3.2 吸附时间对吸附效果的影响 由图4可见,微孔淀粉对番茄红素吸附过程分为2个阶段,前期快速吸附阶段和后期慢速吸附阶段。在前期快速吸附阶段,30 min时吸附量上升至162 μg/mL,在后期慢速吸附阶段吸附量变化较小。微孔淀粉对番茄红素吸附在30 min左右达到较佳值。

图4 吸附时间对微孔酯化淀粉吸附性能的影响Fig.4 Effect of absorption time on the adsorption property of esterified microporous starch
2.3.3 吸附温度对吸附效果的影响 由图5可见,玉米微孔酯化淀粉对番茄红素的吸附量随着温度的升高总体趋势先升高后降低,当温度达到45℃吸附量接近最大。因此,玉米微孔酯化淀粉对番茄红素的吸附最优温度为45℃。分析其原因番茄红素分子随着温度的升高运动速率加快,能够快速的运动至吸附部位,从而使得吸附量增加,但是吸附的温度过高,番茄红素分子自身热运动加剧,导致已经被吸附的番茄红素分子也受到干扰,进而吸附量下降。其次,温度太高,淀粉颗粒部分出现糊化,不利于吸附[17]。

图5 温度对微孔淀粉吸附性能的影响Fig.5 Effect of temperature on the adsorption property of esterified microporous starch
2.4 饱和吸附量比较
由图6可知,玉米酯化淀粉的饱和吸附量为167.63 μg/g,玉米微孔酯化淀粉的饱和吸附量为225.45 μg/g,相对于玉米原淀粉的饱和吸附量106.90 μg/g两者均有一定的提高。造成玉米多孔酯化淀粉吸附番茄红素能力最高的原因有两点,其一是在原淀粉的基础上引入辛烯基,从而提高了其对于亲油性物质的吸附能力[18]。其二是由于在酯化淀粉的基础上用α-淀粉酶形成了多孔结构,增加了其比表面积,使得吸附能力得以提高[19]。

图6 不同淀粉对番茄红素的饱和吸附量Fig.6 Different starch on the adsorption of the lycopene

图7 自然光对番茄红素损失率的影响Fig.7 Effect of nature light on the loss rate of lycopene
2.5 番茄红素的吸附稳定性
2.5.1 光照对于番茄红素损失率的影响 由图7可以看出,玉米淀粉吸附的番茄红素在室外自然光照射下,存放14 d时,番茄红素的损失率达到24.4%,而玉米微孔酯化淀粉吸附的番茄红素在同样的时间下,番茄红素的损失率为9.0%,充分反映出玉米微孔酯化淀粉对于吸附的番茄红素具有较好的保护作用。这是由于玉米微孔酯化淀粉具有许多的孔洞,产生的吸引力较为集中,番茄红素被吸附于孔的内壁,相对于玉米淀粉具有更高的吸附稳定性而且起到了一定的保护作用。而未被吸附的番茄红素,在室外自然光作用下,24 h后番茄红素几乎就全部损失[20]。此外,比较图7与图8可以看出,紫外光对于淀粉吸附的番茄红素影响较自然光大,并且紫外光对于玉米淀粉和酯化微孔淀粉吸附的番茄红素在48 h之前影响不明显,但是在48 h之后,可以看出两者之间番茄红素损失率出现了较大的差别。分析其原因是0~48 h玉米淀粉与微孔酯化淀粉的番茄红素残留率相近的原因在于紫外光首先作用于淀粉颗粒的表面,首先降解的是位于表面吸附的番茄红素,因此两者之间残留率差距不大,当进行到一定时间,表面吸附的番茄红素基本降解,此时影响残留率的关键因素就是微孔内部吸附的番茄红素,酯化微孔淀粉由于存在大量的微孔,部分番茄红素位于孔洞之内,而紫外光对于固体颗粒的穿透能力较差,造成48 h以后两种淀粉吸附的番茄红素损失率出现较大区别。

图8 紫外光对番茄红素损失率的影响Fig.8 Effect of ultraviolet light on the loss rate of lycopene
2.5.2 温度对于番茄红素损失率的影响 总体上由图9可以看出,温度越高,番茄红素的损失率越大,且相同温度下酯化微孔淀粉吸附的番茄红素损失率较玉米淀粉小,但是也注意到一个很关键的问题:在70℃以下,酯化微孔淀粉吸附的番茄红素损失率保持一个较稳定的趋势,但是在100℃时酯化微孔淀粉吸附的番茄红素损失率出现了较大的变化,这说明酯化微孔淀粉吸附的番茄红素在高温时降解较快,在低温时降解较慢,且存在一个降解速率的临界温度。

图9 温度对于番茄红素损失率的影响Fig.9 Effect of temperature on the loss rate of lycopene
2.5.3 有氧条件对于番茄红素损失率的影响 由图10可知,氧气对于番茄红素残留率影响较大,在有氧条件下酯化微孔淀粉吸附的番茄红素残留率相对于玉米淀粉较高。说明酯化微孔淀粉能够有效阻止内部的番茄红素与氧气接触,从而控制氧气对番茄红素的氧化降解。
3 结论
3.1 以玉米淀粉为原料,占淀粉干基质量分数为15%辛烯基琥珀酸酐为酯化剂,α-淀粉酶为酶解剂水解15 h,制备了酯化微孔淀粉,其取代度DS=0.0227,水解度DE= 0.46,并通过红外光谱及扫描电镜对其进行了表征,结果表明成功制备了酯化微孔淀粉,且开孔性能良好。

图10 有氧条件对于番茄红素损失率的影响Fig.10 Effect of oxygen on the loss rate of lycopene
3.2 以制备的酯化微孔淀粉为吸附剂,通过单因素实验探讨了吸附浓度、时间和温度对于吸附量的影响,结果表明较佳的吸附浓度为10 μg/mL,吸附时间为30 min,吸附温度为45℃;并对实验结果进行了单因素方差分析,上述三个因素对于吸附量均有极显著影响。且在上述优化条件下,玉米淀粉经过酯化反应和酶解开孔后,吸附能力得到明显提升,饱和吸附量从106.90 μg/g提高到225.45 μg/g。
3.3 酯化微孔淀粉吸附的番茄红素在自然光照、紫外光照、高温及氧气存在的条件下损失率低,说明酯化微孔淀粉可用于提高番茄红素的储存稳定性。
[1]胡飞.酶(酸)法合成微孔淀粉的研究[J].食品科技,2007,32(2):61-64.
[2]Claudia Belingheri,Barbara Giussani,Maria Teresa Rodriguezestrada,et al.Oxidative stability of high-oleic sunflower oil in a porous starch carrier[J].Food Chemistry,2015,166(1):346-351.
[3]Wang Yu-Feng,Ye Hong,Zhou Chun-Hong,et al.Study on the spray-drying encapsulation of lutein in the porous starch and gelatin mixture[J].European Food Research and Technology,2012,234(1):157-163.
[4]Wang Yu-Feng,Shao Jiang-Juan,Wang Zhao-Long,et al. Study of allicin microcapsules in beta-cyclodextrin and porous starch mixture[J].Food Research Internaional,2012,49(2):641-647.
[5]杨圣岽,侯聚敏,张琳,等.酶法制备微孔淀粉的研究进展[J].吉林农业科学,2012,37(4):77-80.
[6]Lee M T,Chen B H.Stability of lycopene during heating and illumination in a modern system[J].Food Chemistry,2002,78(4):425-432.
[7]JeonYoung-Seon,ViswanathanArvindLowell,GrossRichard A. Studies of starch esterification:Reactions with alkenylsuccinates in aqueous slurry systems[J].Starch/Stärke,1999,51(2):90-93.
[8]Dura A,Błaszczak W,Rosell C M.Functionality of porous starch obtained by amylase or amyloglucosidase treatments[J].
Carbohydrate Polymers,2014,101(3):837-845.
[9]虎玉森,蒲陆梅,张红利,等.辛烯基琥珀酸马铃薯淀粉酯的制备及结构表征[J].食品科学,2010,31(2):22-24.
[10]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[11]刘玉梅,刘奎钫.番茄红素油树脂中番茄红素的分析方法的研究[J].食品工业科技,2004,25(12):127-130.
[12]徐忠,王鹏,缪铭.玉米多孔淀粉吸附性能研究[J].哈尔滨工业大学学报,2007,39(7):581-585.
[13]苏东明,金华丽,任顺成,等.微孔变性淀粉吸附性质研究[J].郑州粮食学院学报,2000,21(2):24-27.
[14]Glaucia Aguiar Rocha,Carmen Sílvia Fávaro-Trindade,Carlos Raimundo Ferreira Grosso.Microencapsulation of lycopene by spray drying:Characterization,stability and application of microcapsules[J].Food and Bioproducts Processing,2012,90(1):37-42.
[15]Sindhu Mathew,T Emilia Abraham.Physico-chemical characterization ofstarch ferulatesofdifferentdegreesof substitution[J].Food Chemistry,2007,105(2):579-589.
[16]Fang J M,Fowler P A,Sayers C,et al.The chemical modification of a range of starches under aqueous reaction conditions.[J].Carbohydrate Polymers,2004,55(3):283-289.
[17]胡爱军,张志华,郑捷,等.大米纳米淀粉的超声法制备及载药性研究[J].粮食与饲料工业,2011,34(8):32-35.
[18]张甲奇,张燕萍.大米多孔淀粉基大米多孔酯化淀粉吸附特性的研究[J].食品工业科技,2011,32(8):108-111.
[19]宁青,蒋艳荣,张振海,等.多孔淀粉固化肉桂挥发油的考察[J].中国实验方剂学杂志,2013,19(3):29-32.
[20]冯晓梅,韩玉谦,隋晓,等.番茄红素稳定性的研究[J].青岛海洋大学学报,2003,33(6):875-880.
Preparation of esterified microporous corn starch and its adsorption property of lycopene
LONG Hai-tao1,2,3,SUN Yan3,ZHANG Hui-xiu1,NIU Hong-yan1,PU Lu-mei1,2,*
(1.College of Science,Gansu Agricultural University,Lanzhou 730070,China;2.Institute of Agricultural Resources Chemistry and Application,Gansu Agricultural University,Lanzhou 730070,China;3.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
In order to improve the storage stability of lycopene,firstly corn starch as raw material,octenyl succinate anhydride as esterifying agent and α-amylase as enzymatic hydrolysis agent to prepare esterified microporous starch.The esterified microporous starch of degrees of substitution and degree of hydrolysis was determined. The characterization of esterified microporous starch was carried out by FT-IR spectra and scanning electron microscopy.The influence of the adsorption time,adsorption temperature and adsorption concentration on the esterified microporous starch adsorption of lycopene were studied.The stability of adsorbed lycopene by esterified microporous starch under natural light,ultraviolet light,differing temperatures and oxygen was tested. The esterified microporous starch with substitution degree 0.0227 and degree of hydrolysis 0.46 was characterized by FT-IR spectra and scanning electron microscopy,the results showed the ester group was introduced and had a good opening performance.The single factor test showed that the better adsorption concentration,adsorption time,adsorption temperature were 10 μg/mL,30 min,45℃.The saturated adsorption amount of lycopene by esterified microporous starch was 225.45 μg/g.Compared with native starch,the adsorption ability and adsorption stability of the esterified microporous starch to lycopene had improved significantly,and the adsorption stability was also improved.So the esterified microporous starch could be used for the preservation of the lycopene.
esterified microporous starch;adsorption property;lycopene
TS210.1
B
1002-0306(2015)22-0293-06
10.13386/j.issn1002-0306.2015.22.052
2015-04-02
龙海涛(1982-),男,硕士,讲师,研究方向:天然产物化学,E-mail:dapanji@163.com。
*通讯作者:蒲陆梅(1968-),女,博士,教授,研究方向:天然产物化学,E-mail:pulm@gsau.edu.cn。
甘肃省科研基本业务项目(044-041009)。

