呋喃它酮代谢物直接竞争化学发光酶免疫分析法的建立
吕月霞,王 瑞,黄登宇,*,王云贵,李 涛
(1.山西大学,生命科学学院,山西太原030006;2.深圳易瑞生物技术有限公司,广州深圳518101;3.山西先锋科技开发有限公司,山西太原030006)
呋喃它酮代谢物直接竞争化学发光酶免疫分析法的建立
吕月霞1,王 瑞1,黄登宇1,*,王云贵2,李 涛3
(1.山西大学,生命科学学院,山西太原030006;2.深圳易瑞生物技术有限公司,广州深圳518101;3.山西先锋科技开发有限公司,山西太原030006)
采用以对碘苯酚为增强剂的鲁米诺-辣根过氧化物酶-过氧化氢化学发光检测体系,建立检测动物组织中呋喃它酮代谢物5-吗啉甲基-2-氨基-2-僫唑烷基酮(AMOZ)残留的直接竞争化学发光酶免疫分析法(dc-CLEIA)。结果表明:此方法IC50为0.62 ng/mL,检测限为15.52 pg/mL,线性范围0.038~9.78 ng/mL,变异系数均小于10%;该方法中抗体除了与呋喃它酮原药有一定交叉外,与其他结构类似物无交叉,表现了良好的特异性;鸡肉样品添加回收率为83%~94%,验证了该方法的准确性,为实际动物组织中AMOZ残留提供了便捷、准确、快速筛查的手段。
呋喃它酮代谢物,直接竞争化学发光酶免疫分析法,鸡肉
兽药残留是影响食品安全问题最主要也是最严重的因素之一[1]。硝基呋喃类药物对革兰氏阴性和阳性菌都有抗菌作用,破坏细菌体内氧化还原酶使细菌正常代谢紊乱,起到很好的杀菌作用[2-4]。呋喃它酮主要用来治疗动物肠道感染疾病,也可作为促进生长的添加剂,呋喃它酮及其代谢物能够诱导机体基因突变,且能诱发癌症[5]。欧盟1995年规定动物性食品中禁止使用硝基呋喃类药物[6],美国FDA 2002年公布的进口动物性食品中禁用11种药物清单中就包括呋喃西林和呋喃唑酮[7],我国农业部2002年在235号文件《动物性食品中兽药最高残留限量》中规定呋喃它酮和呋喃唑酮在所有可食性动物组织中都不得检出[8]。硝基呋喃类药物进入动物体内会很快分解和代谢,其代谢物可与蛋白质形成稳定且长期存在的结合物,烧烤、微波加热和蒸煮等方式无法有效降解,人们食用后在胃酸作用下经过水解,使其代谢物与蛋白质分离,从而对人体产生危害,故检测其代谢物更有意义[9-11]。
目前,硝基呋喃类代谢物检测方法主要有高效液相色谱法、液相色谱-质谱联用法、免疫分析法[12-15]等。高效液相色谱法及其联用技术虽检测结果准确,但需要专业技术人员操作且过程复杂、设备昂贵。化学发光酶免疫分析法将化学发光法和酶免疫分析法结合起来[16-17],具有检测灵敏度高、特异性强、且操作简单方便等优点,更适用执法人员现场快速检测。杨武英等[15]建立了虾肉中呋喃它酮代谢物化学发光酶免疫分析方法,IC50为1.38 ng/mL,LOD为0.09 ng/mL。2013年,何方洋等[18]用间接竞争CLEIA法制备呋喃它酮代谢物检测试剂盒,畜禽组织和水产品LOD为0.1 ng/mL,2014年[19]用“包被抗原-酶标抗体”直接CLEIA法制备试剂盒,IC50为0.198 ng/mL。冯才伟等[20]用间接竞争CLEIA法,对猪肉、猪肝、鸡肉等样品呋喃它酮代谢物进行了检测,LOD为0.086~0.094 ng/mL。Ying-Chun Liu等[21]对鱼肉、鸡蛋、蜂蜜等样品中该物质进行了检测,LOD为0.01 ng/mL。本文对呋喃它酮代谢物AMOZ进行衍生化,活化酯法合成酶标抗原,建立“包被抗体-酶标抗原”直接竞争CLEIA法,对实验中包被抗体稀释倍数、酶标抗原稀释倍数、包被条件、封闭液、竞争时间参数进行优化,从精密度、准确性、特异性方面对该方法进行评估,以期得到一种适用于实际样品快速筛查的方法。
1 材料与方法
1.1 材料与仪器
AMOZ单克隆抗体 北京艾旗斯德科技有限公司提供;5-吗啉-3-[(2-硝基基苯基)-甲基]氨基-2-唑烷酮(NPAMOZ)标准品(99.9%)、呋喃它酮、呋喃西林、呋喃唑酮、呋喃妥因、AMOZ、氨基脲(SEM)、3-氨基-2-恶唑烷酮(AOZ)、1-氨基乙内酰脲(AHD)、N-羟基琥珀亚胺(NHS)、鲁米诺、碳化二亚胺(DCC)、卵清蛋白(OVA)、辣根过氧化物酶(HRP)、N,N-二甲基甲酰胺(DMF)、2-硝基苯甲醛、对醛基苯甲酸(4-CBA)、1-(2硝基苯亚甲基)-氨基乙内酰脲(NPAHD)、1-(2硝基苯亚甲基)-氨基乙内酰脲(NPAOZ)、2-硝基苯亚甲基-氨基脲(NPSEM) 美国Sigma公司;KCl、KH2PO4、Na2HPO4·12H2O、NaCl、对碘苯酚、对甲苯酚、过氧化氢脲、乙酸乙酯、正己烷 国药集团化学试剂有限公司,均为分析纯;鸡胸肉 市购。
BSA224S电子天平 德国Sartorius公司;单道微量移液器 0.5~10 μL、10~100 μL、96孔可拆卸化学发光板,美国Thermo公司;8通道移液器 30~300 μL,德国Eppendorf公司;1000~5000 μL移液器 大龙兴创实验仪器有限公司;UPT-I-10T超纯水机 四川优普超纯科技有限公司;SC-3610低速离心机 安徽中科中佳科学仪器有限公司;UV-1600PC紫外可见分光光度计 上海美谱达仪器有限公司;INFINITE 200PRO酶标仪 瑞士Tecan公司;AVANCE 600MHZ超导核磁共振波谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 溶液系统 包被缓冲液(pH9.6,0.05 mol/L)、PBS缓冲液(pH7.4,0.01 mol/L)、PBST洗涤液(pH7.4,0.01 mol/L)、封闭液、终止液均参照文献[15]方法配制。鲁米诺储备液(0.25 mol/L):0.4429 g鲁米诺,溶于10 mL DMF。过氧化氢脲储备液(0.3 mol/L):0.2822 g过氧化氢脲溶于10 mL超纯水。对碘苯酚储备液(0.01 mol/L):0.0220 g对碘苯酚溶于10 mL DMF。对甲苯酚储备液(0.01 mol/L):0.0108 g对甲苯酚溶于10 mL DMF。
1.2.2 AMOZ衍生物半抗原5-吗啉-3-[(4-羧基苯基)-甲基]氨基-2-僫唑烷酮(CPAMOZ)的合成75.0 mg AMOZ溶于937.5 μL 0.1 mol/L HCl,得溶液A;60.0 mg对醛基苯甲酸4-CBA溶于937.5 μL DMF,得溶液B;A与B混匀后室温反应48 h。混合液4500 r/min离心10 min,弃上清液,乙醇洗沉淀3次,烘干,得白色固体粉末CPAMOZ[22]。
1.2.3 酶标抗原的合成 30.0 mg CPAMOZ,15.8 mg NHS,28.5 mg DCC,混合溶于350 μL DMF,室温下反应16 h,得溶液D。19.6 mg辣根过氧化物酶HRP,溶于1 mL pH7.4的PBS,加入D溶液,4℃反应过夜。混合液转移到透析袋,室温下PBS透析5 d,每隔8 h换一次透析液。透析后混合液4500 r/min离心15 min,上清液加入等体积甘油,分装,-20℃保存备用[23]。
1.2.4 直接竞争化学发光酶免疫分析法(dc-CLEIA)检测步骤 单克隆抗体用碳酸盐缓冲液(CBS)包被液稀释后依次加入到96孔化学发光板中,100 μL/孔,孵育2~16 h。PBST洗板3次。每孔200 μL封闭液,37℃封闭2 h,每孔依次加入50 μL梯度稀释标品NPAMOZ溶液与50 μL酶标抗原,空白对照以标品稀释液代替标品,37℃进行孵育30~150 min,洗板4次。将发光液混合后立即加入,100 μL/孔,室温下避光反应1~5 min后用INFINITE 200PRO酶标仪测化学发光值RLU。
1.2.5 dc-CLEIA各参数优化
1.2.5.1 化学发光液优化 将鲁米诺储备液、对甲苯酚和对碘苯酚储备液、过氧化氢脲储备液、30%H2O2配制成不同摩尔比的化学发光液组合,见表1,通过RLU值比较选出最佳发光液。
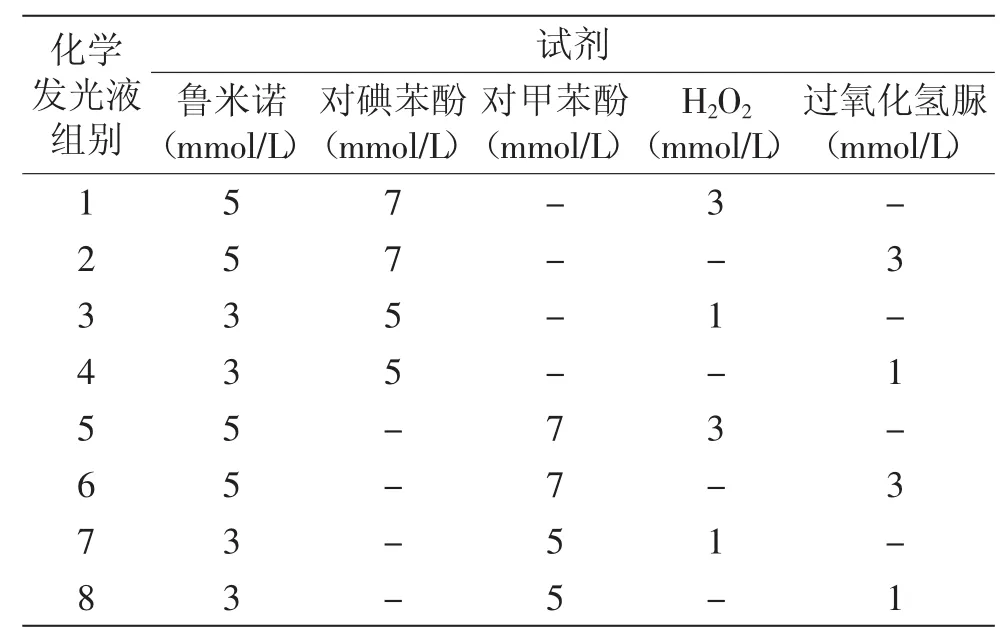
表1 化学发光液优化Table 1 Chemiluminescence solution optimization
1.2.5.2 化学发光板均一性测定 在化学发光板中随机抽取3条,根据1.2.4中检测步骤进行包被,封闭后加入100 μL/孔发光液,根据各孔RLU值计算孔间变异系数。
1.2.5.3 优化包被抗体和酶标抗原稀释倍数 采用棋盘法[15]进行确定,将包被抗体按1000、2000、4000、8000、16000稀释倍数纵向包被,将酶标抗原按40、80、160、320、640、1280稀释倍数横向加入酶标板,竞争物NPAMOZ浓度为100 ng/mL,以添加标品的RLU值为B,不添加标品的RLU值为B0,计算B/B0,根据B/B0比值最小选取最佳稀释倍数。
1.2.5.4 包被条件优化 在选择最佳包被抗体和酶标抗原稀释倍数基础上,设置4℃包被过夜、37℃放置2 h后4℃过夜、37℃放置2 h三个包被条件,每组设三个平行。
1.2.5.5 封闭液优化 在选择最佳包被抗体量、酶标抗原稀释倍数、包被条件基础上,以1%脱脂乳粉、1% BSA、1%明胶为封闭液进行实验,每组设三个平行。
1.2.5.6 竞争时间优化 在选择最佳包被抗体量、酶标抗原稀释倍数、包被条件、封闭液基础上,设置45、60、120、150 min四个竞争时间进行实验,每组设三个平行。
以上各参数最佳值以RLUmax/IC50、半抑制浓度IC50为判断依据,RLUmax/IC50越大,IC50越小,则实验灵敏度越高。
1.2.6 dc-CLEIA方法学评估
1.2.6.1 dc-CLEIA标准曲线建立与灵敏度的测定 经过各参数优化,以抑制率为纵坐标,NPAMOZ log浓度为横坐标,绘制dc-CLEIA方法标准曲线,根据标准曲线计算该方法灵敏度IC50、线性范围和最低检测线IC10。
抑制率=(不添加标品孔RLU值-添加标品孔RLU值)/(不添加标品RLU值-空白孔RLU值)
1.2.6.2 精密度测定 以变异系数来反映方法精密度,取5个不同浓度的NPAMOZ标准品溶液进行dc-CLEIA分析,每个浓度做5个平行,分批进行3次实验,将得到RLU值进行批内和批间差异分析。
1.2.6.3 特异性测定 特异性以交叉反应率来反映,将呋喃它酮结构类似物呋喃妥因、呋喃西林、呋喃唑酮、AHD、SEM、AOZ、NPAMOZ、NPAHD、NPSEM、NPAOZ分别配制成100、20、4、0.8、0.16、0.032 ng/mL系列浓度,作为酶标抗原竞争物,按dc-CLEIA检测步骤测定,求出各自结构类似物IC50值,计算交叉率CR:
CR(%)=IC50(NPAMOZ)/IC50(类似物)×100
1.2.6.4 准确性测定 准确性以加标回收率来反映,采用该方法对鸡肉样品AMOZ添加进行检测,每个添加浓度3个平行,计算样品AMOZ平均回收率。
样品前处理方法:50 g鸡胸肉均质,均质后称取2 g样品共4份,每份样品加9 mL超纯水,4份样品中分别加AMOZ标品,浓度分别为0、0.5、1.0、2.0 ng/g。搅拌均匀,每份样品加1 mL 1 mol/L HCl,200 μL 2-硝基苯甲醛,将处理好样品混合液置于37℃培养箱中振荡16 h。振荡后,每份混合液加10 mL 0.1 mol/L K2HPO4,0.8 mL 1 mol/L NaOH,10 mL乙酸乙酯,4500 r/min离心15 min,吸取乙酸乙酯上清液,氮气吹干,在吹干样品中加1 mL正己烷,晃荡30 s,加1 mL PBS,室温4500 r/min离心10 min,取下层溶液备用。
1.3 数据处理
数据采用Excel软件进行处理。
2 结果与分析
2.1 AMOZ衍生物半抗原(CPAMOZ)鉴定
由表2和图1可知,有对醛基苯甲酸(4-CBA)与AMOZ连接的H存在,即表中④H存在,根据化学结构式,说明4-CBA与AMOZ连接成功,证明CPAMOZ成功合成。

表2 CPAMOZ氢谱分析结果Table 2 The 1HNMR analysis results of CPAMOZ

图1CPAMOZ结构式Fig.1 Chemical structure of CPAMOZ

图2 活化酯法酶标抗原CPAMOZ-HRP、CPAMOZ和HRP紫外扫谱图Fig.2 The activated ester method UV spectrum of CPAMOZ-HRP,CPAMOZ and HRP
2.2 酶标抗原合成鉴定
紫外图谱见图2。HRP载体蛋白最大紫外吸收峰在403 nm,半抗原CPAMOZ的最大紫外吸收峰在293 nm,CPAMOZ与HRP偶联后,CPAMOZ-HRP最大紫外吸收峰在289 nm和407 nm。CPAMOZ-HRP紫外吸收峰包括了CPAMOZ和HRP,并相对于CPAMOZ和HRP紫外吸收峰都发生了明显偏移,且吸收曲线也发生了明显变化,说明CPAMOZ-HRP偶联成功。
2.3 化学发光液的选择
表1中1~8组浓度比例不同的发光液组合的RLU值见图3。化学发光值越大,则检测灵敏度相对较好。从图3中看出,发光增强剂对碘苯酚(1~4组)比对甲苯酚(5~8组)的RLU值大,对碘苯酚(1~4组)的RLU值在50万以上,而对甲苯酚RLU值则保持在1万到2万间,故选择对碘苯酚为发光增强剂。在对碘苯酚作为增强剂前4组中,使用H2O2作为氧化剂1组和3组,随着时间推移,RLU值下降程度大,而使用过氧化氢脲作为氧化剂2组和4组,RLU值随着时间延长比较平缓,H2O2随着时间延长会自动分解,故选择过氧化氢脲作为氧化剂;2组比4组RLU值大,且6 min内第2组RLU值是增大的,故选择2组化学发光液组合即鲁米诺5 mmol/L、对碘苯酚7 mmol/L、过氧化氢脲3 mmol/L作为最佳组合。
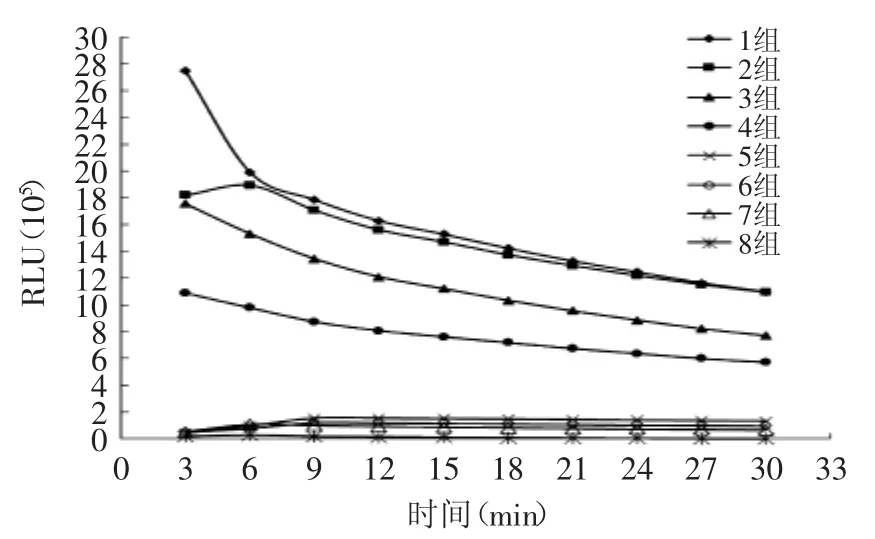
图3 化学发光液的优化RLU值Fig.3 The optimization RLU of chemiluminescent solution
2.4 化学发光酶标板均一性
从表3中看出,化学发光板变异系数为2.52%,说明各孔间的均一性良好[24]。
2.5 包被抗体与酶标抗原稀释倍数确定
由表4可看出,随着抗体包被量减少或酶标抗原稀释倍数增大,B0值呈现下降趋势,根据棋盘法和B/B0,选择抗体稀释倍数为8000倍,酶标抗原稀释倍数为160倍,这时B/B0值最小,即方法灵敏度最高。
2.6 包被条件确定
从图4中看出,4℃过夜和37℃放置2 h后4℃过夜组IC50接近,且37℃放置2 h后4℃过夜组的RLUmax/ IC50大于其它两组,即此组灵敏度最好,能使抗体更好吸附于固相载体上,选择37℃放置2 h后4℃过夜组为最佳包被条件。
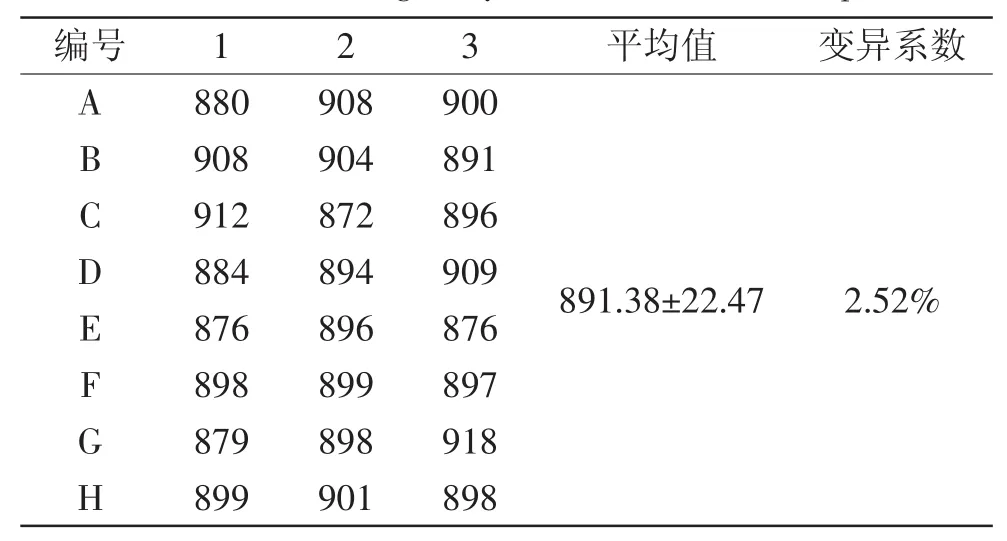
表3 化学发光板均一性数据Table 3 The homogeneity of chemical luminous plate
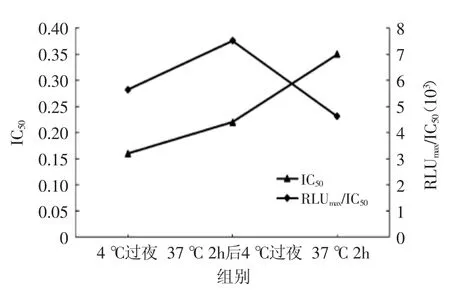
图4 不同包被条件对直接竞争法的影响Fig.4 The effect of different coating method for dc-CLEIA
2.7 封闭液确定
从图5看出,1%明胶组RLUmax/IC50明显大于1%脱脂乳粉组和1%BSA组,但在实验过程中发现,用明胶封闭完洗板,板底部明胶很难清洗干净,背景值大,故它的RLU值明显大于其他两组,IC50也大,比其他组大一个数量级,造成用明胶封闭的灵敏度降低;1%BSA的RLUmax/IC50大于1%脱脂乳粉,而两个组IC50接近,故选择1%BSA作为本实验最佳封闭液。

表4 直接竞争化学发光酶免疫法棋盘格数据Table 4 The checkerboard experiment data of dc-CLEIA
2.8 竞争时间确定
从图6可以看出,随着时间延长,IC50和RLUmax/IC50呈上升趋势,150 min时,IC50比其他三个时间下均大,IC50为方法学灵敏度,说明150 min时实验灵敏度降低程度大,选择150 min不适宜,60 min与120 min时的IC50接近,反应基本达到平衡,60 min时的RLUmax/ IC50值大,所以选择竞争时间为60 min。

图5 不同封闭液对直接竞争法的影响Fig.5 The effect of different blocking solution for dc-CLEIA
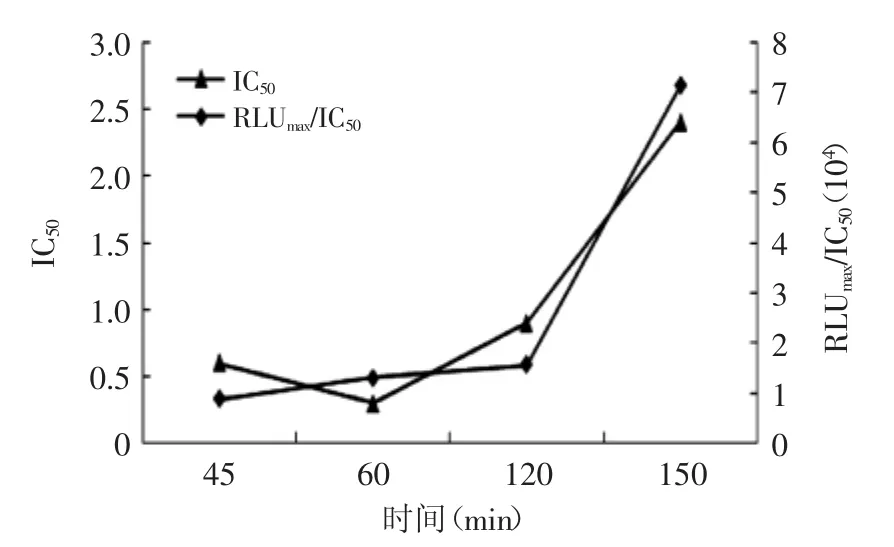
图6 竞争时间对直接竞争法的影响Fig.6 The effect of competitive time for de-CLEIA
2.9 标准曲线
根据优化后各参数,得到标准曲线见图7。线性方程为y=0.2499x-0.1976,根据曲线计算出IC50为0.62 ng/mL,最低检测限IC10为15.52 pg/mL,线性范围(IC20~IC80)为0.038~9.78 ng/mL。
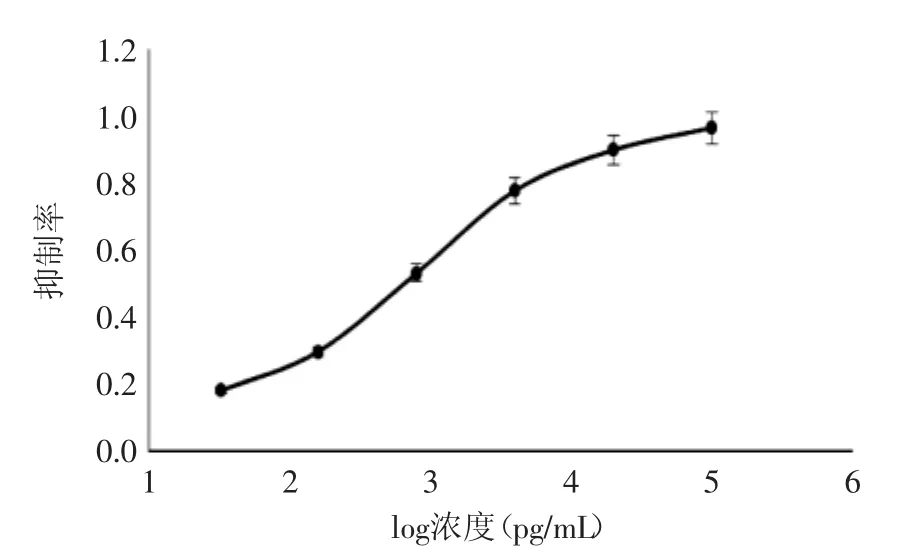
图7 dcCLEIA标准曲线Fig.7 Standard curve of dcCLEIA
2.10 精密度测定
从表6看出,批内和批间变异系数均小于10%,表明建立dcCLEIA方法精密度较好[24]。
2.11 特异性测定
结果见表7。呋喃它酮原药IC50为78.2 ng/mL,CR为0.80%,除与呋喃它酮交叉外,与其他结构类似物交叉率均小于0.01%,说明该方法特异性良好。
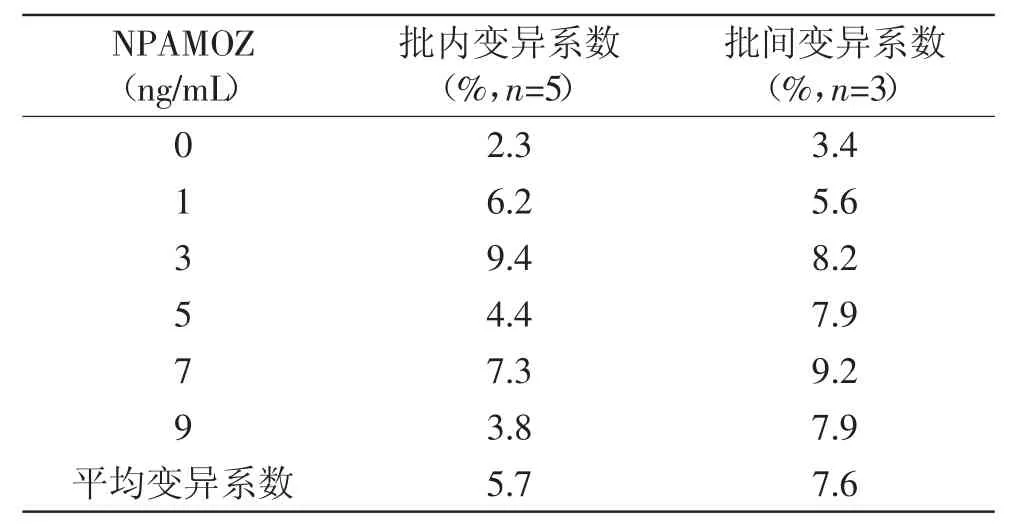
表6 NPAMOZ化学发光酶免疫分析法的精密度Table 6 Precision of NPAMOZ dcCLEIA

表7 化学发光酶免疫分析法的特异性Table 7 The specificity of CLEIA
2.12 回收率测定
结果见表8。该方法检测AMOZ回收率在83%~94%之间,变异系数在4.24%~7.03%之间,说明该方法准确性良好。

表8 样品添加AMOZ回收率测定Table 8 Recoveries of AMOZ from different animal tissues
3 结论
本文建立了呋喃它酮代谢物AMOZ直接竞争化学发光酶免疫分析法,通过对各项参数优化,该方法IC50为0.62 ng/mL,检测限为15.52 pg/mL,其最低检测限低于国标[25]中液相色谱-串联质谱法(LC-MS/MS)检测限0.5 μg/kg和我国出入境行业标准[26]中ELISA法检测限0.1 μg/kg,可以满足标准中对呋喃它酮代谢物限量要求。该方法特异性良好,除了与呋喃它酮原药有一定交叉外,与其他结构类似物无交叉,由于呋喃它酮原药在动物体内代谢迅速,故在实际样品检测中不会发生。通过对鸡肉样品中添加不同浓度的AMOZ,回收率(83%~94%)较好,为进一步检测AMOZ残留检测提供了便捷、准确的方法,也为下一步制备检测AMOZ残留化学发光酶免疫试剂盒提供了基础。
[1]张远,刘璞.动物性食品中兽药残留问题及对策[J].中国动物检疫,2005,22(6):17-19.
[2]Cooper KM,Kennedy DG.Nitrofuran antibiotic metabolites detected at parts per million concentrations in retina of pigs-a new matrix for enhanced monitoring of nitrofuran abuse[J]. Analyst,2005,130(4):49-51.
[3]Mottier P,Hure I,Putong S,et al.Analysis of four 5-nitroimidazoles and their corresponding hygroxylated metabolites in eggs,processed eggs and chicken meat by isotope dilution liquid chromatography tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry,2006,54(6):2018-2026.
[4]Auro A,Sumano H,Ocampo L,et al.Evaluation of the carcinogenic effects of furazolidone and its metabolites in two fish species[J].PHarmacogenomic Journal,2004,4:24-28.
[5]Barbosa J,Freitas A,Moura S,et al.Detection,Accumulation,Distribution,and Depletion of Furaltadone and Nifursol Residues in Poultry Muscle,Liver,and Gizzatd[J].Agric Food Chem,2011,59(22):11927-11934.
[6]European Commission(EC).Amending decision as regards the setting of minimum required performance limits for certin residues in food of animal origin[Z].Communities.No.1442/95. 1995,No.L143:26-30.
[7]Federal Register.Topical nitrofurans;extralabel animal drug use;order of prohibition[R].Federal Register,2002,67:5470-5471.
[8]中华人民共和国农业部公告第235号:动物性食品中兽药最高残留量[Z].2002.
[9]Kevin MC,Christopher TE.Production and characterization of polyclonal antibodies to a derivative of 3-amino-2-oxazolidinone,a metabolite of the nitrofuran furazolidone[J].Analytica Chimica Acta,2004,520:79-86.
[10]徐一平,胥传来.动物源性食品中硝基呋喃类物质及其代谢物残留的检测技术研究[J].食品科学,2007,28(10):590-593.
[11]徐一平,金征宇.ELISA方法检测呋喃妥因代谢物1-氨基乙内酰脲[J].食品工业科技,2008,29(8):272-275.
[12]丁涛,徐锦忠,沈崇钰,等.高效液相色谱-串联质谱联用测定蜂王浆中的四种硝基呋喃类药物的代谢物[J].色谱,2006,24(5):432-435.
[13]Cooper AD,Creaser CS,F arrington WHH.Development of multi-residue methodology for the HPLC determination of veterinary drugs in animal tissues[J].Food Additives and Contaminants,1995,12(2):167-176.
[14]林黎明,林回春,刘心同,等.固相萃取高效液相色谱-质谱法测定动物组织中硝基呋喃代谢产物[J].分析化学,2005,33(8):1081-1086.
[15]杨武英,董洁娴,沈玉栋,等.虾肉中呋喃它酮化学发光酶免疫分析方法的建立[J].分析化学,2012,40(12):1816-1821.
[16]李萍,雷红涛,王弘,等.黄曲霉毒素B1直接竞争化学发光酶免疫分析方法的建立[J].食品工业科技,2013,34(19):287-290.
[17]张丽丽,藏立国,陈蓁蓁,等.化学发光分析法应用进展理化检验[J].化学分册,2004,40(4):243-246.
[18]何方洋,万余平,陶光灿,等.检测呋喃它酮代谢物的化学发光试剂盒:中国,202794039[P].2013-03-13.
[19]何方洋,冯才伟,冯月君,等.一种呋喃它酮代谢物的化学发光检测试剂盒:中国,103698519[P].2014-04-02.
[20]冯才伟,冯月君,崔海峰,等.呋喃它酮代谢物化学发光试剂盒的建立[J].江苏农业科学,2013,41(9):277-279.
[21]Ying-Chun Liu,Wei Jiang,Yong-Jun Chen,et al.A novel chemiluminescent ELISA for detecting furaltadone metabolite,3-amino-5-morpholinomethyl-2-oxazolidone(AMOZ)in fish,egg,honey and shrimp samples[J].Journal of Immunological Methods,2013:29-36.
[22]刘迎春,蒋蔚,陈永军,等.呋喃它酮代谢物人工抗原及多克隆抗体的制备[J].畜牧与兽医,2013,45(2):69-73.
[23]宋珊珊,彭池方,匡华,等.莱克多巴胺和土霉素人工抗原的合成与鉴定[J].食品科学,2011,32(9):167-169.
[24]王硕,张鸿雁,王俊平.酶联免疫吸附分析方法基本原理及其在食品中化学污染物检测应用[M].北京:科学出版社,2011:38-39.
[25]GB/T 20752-2006猪肉、牛肉、鸡肉、猪肝和水产品中硝基呋喃类代谢物残留量的测定.液相色谱-串联质谱法[S].
[26]SN/T 3380-2012出口动物源食品中硝基呋喃代谢物残留量的测定.酶联免疫吸附法[S].
Development of a direct competitive chemiluminescent enzyme immunoassay for detection of furaltadone metabolite
LV Yue-xia1,WANG Rui1,HUANG Deng-yu1,*,WANG Yun-gui2,LI Tao3
(1.School of Life Science,Shanxi University,Taiyuan 030006,China;2.Shenzhen Bioeasy Technology,Inc.,Shenzhen 518101,China;3.Shanxi Vanguard Technology Co.,Ltd.,Taiyuan 030006,China)
A direct competitive chemiluminescent enzyme immunoassay method(dc-CLEIA)for detection of AMOZ which based on lodine phenol enhancer Luminol-HRP-H2O2system was developed.The 3-amino-5-morpolinomethyl-2-oxazolidinone was metabolite of furaltdone.The sensitivity(IC50)and detection limit(LOD)of the method were 0.62 ng/mL and 15.52 pg/mL respectively.The linear range was 0.038~9.78 ng/mL.The relative standard deviations was below 10%.The antibody was high specific for furaltdone derivative and no cross-reactivity except the furaltdone original drug.The accuracy of the method was verified and the recovery in chicken tissues was 83%~94%.The method provided a convenient,accurate and rapid screening means for detecting AMOZ in actual animal tissue.
furaltdone metabolite;dc-CLEIA;chicken
TS207.3
A
1002-0306(2015)22-0071-06
10.13386/j.issn1002-0306.2015.22.006
2015-03-20
吕月霞(1989-),女,硕士研究生,研究方向:食品质量与安全,E-mail:yuexialv2008@163.com。
*通讯作者:黄登宇(1968-),男,博士,副教授,研究方向:食品质量与安全,食品新工艺与食品安全,E-mail:Huangdy110@126.com。

