碱激发粉煤灰对Cs+的吸附行为
罗 洁,张海军,刘 璟,杨 剑,黄 胜,邓仕明
(1. 西南科技大学 环境与资源学院,四川 绵阳 621010;2. 西南科技大学 理学院,四川 绵阳 621010;3. 西南科技大学 应用技术学院,四川 绵阳 621010)
碱激发粉煤灰对Cs+的吸附行为
罗 洁1,张海军2,刘 璟1,杨 剑3,黄 胜1,邓仕明1
(1. 西南科技大学 环境与资源学院,四川 绵阳 621010;2. 西南科技大学 理学院,四川 绵阳 621010;3. 西南科技大学 应用技术学院,四川 绵阳 621010)
将粉煤灰进行碱激发改性,运用XRD和SEM技术对碱激发粉煤灰进行了表征,通过静态平衡吸附实验研究了碱激发粉煤灰对Cs+的吸附动力学和热力学特性,并对吸附前后的碱激发粉煤灰进行了FTIR分析。表征结果显示,碱激发处理后,粉煤灰的晶相发生了改变,且粉煤灰表面密实的硬壳层被破坏。实验结果表明:在初始Cs+质量浓度为200 mg/L、吸附温度为25 ℃、溶液pH为10、碱激发粉煤灰投加量为12.0 g/L的条件下,碱激发粉煤灰对Cs+的平衡吸附率可达80%以上,其吸附能力比碱激发前提高了3倍以上;吸附过程可用准二阶动力学方程来描述,并较好地符合Langmuir等温吸附模型;碱激发粉煤灰对Cs+的吸附是吸热过程,且能自发进行;该过程以物理吸附为主,并伴随化学吸附。
粉煤灰;碱激发;物理吸附;铯离子;放射性废水
当今中国,核工业的迅速发展使放射性废水的处理处置问题变得日益突出。Cs137作为重要的裂变产物,其裂变产额高、半衰期长、对人体危害大,故如何处理放射性废水中的Cs137引起广泛关注[1]。在放射性废水处理方法中:蒸发法的去除效果较好,但耗能巨大;化学絮凝沉淀法能够处理含盐量高的废水,但去除效果较差;而吸附法凭借其去除效果显著、成本低廉等优点得到广泛应用[2]。一些学者研究了高岭土、膨润土、蒙脱石、云母、沸石等矿物材料对Cs+的吸附行为,并对原材料进行修饰以提高其吸附性能[3-7]。
粉煤灰是目前世界上排放量最大的工业废物之一,比表面积大(2 500~5 000 cm2/g),具有一定的吸附能力[8]。但粉煤灰结构中存在着大量性能稳定的玻璃相,必须进行表面或结构改性来增强其活性[9]。改性粉煤灰作为吸附材料在污水处理等环保研究领域已得到广泛关注,并取得了一定的成果[9-13],但研究方向主要集中在重金属、有机物、染料等废水处理中,利用粉煤灰来处理放射性废水的研究较少。
本研究通过静态平衡吸附实验考察了碱激发粉煤灰对Cs+的吸附特性,进行了吸附过程的动力学和热力学研究,以期为粉煤灰作为吸附材料处置放射性废水的可行性提供理论依据,从而实现以废治废的目的。
1 实验部分
1.1 试剂、材料和仪器
氯化铯、碳酸钠、氢氧化钠、盐酸:分析纯。
粉煤灰:取自四川省绵阳市某电厂,主要成分见表1。由表1可见,粉煤灰的主要成分为SiO2,A12O3,Fe2O3,CaO等。

表1 粉煤灰的主要成分w,%
PB-10标准型pH计:德国赛多利斯公司;DC-B型马弗炉:上海光地仪器公司;AA700型石墨炉原子吸收光谱仪:美国铂金埃尔默公司;X’pert PRO型X射线衍射仪:荷兰帕纳科公司;EVO 18型钨灯丝扫描电子显微镜:德国蔡司公司;Spectrum One型傅里叶变换红外光谱仪:美国PE公司。
1.2 碱激发粉煤灰的制备
称取一定量的粉煤灰(过200目筛),与碳酸钠按一定比例充分混合后,置于850 ℃马弗炉中煅烧3 h(碱熔);冷却后研磨过筛,并移入锥形瓶中,加入4 mol/L的氢氧化钠溶液,于50 ℃,150 r/ min条件下恒温振荡一定时间(碱激发);冷却至室温,抽滤,用蒸馏水反复洗涤至pH为10,于干燥箱中充分干燥,得碱激发粉煤灰。
1.3 吸附实验
准确移取一定浓度的氯化铯溶液150 mL于250 mL容量瓶中,调节溶液pH,以一定的投加量加入适量碱激发粉煤灰,以150 r/min的振荡速率恒温反应一定时间后,用0.45 μm针头过滤器过滤取样。
1.4 分析方法
采用XRD技术表征碱激发前后粉煤灰的晶相变化;采用SEM技术观察碱激发前后粉煤灰的微观形貌变化;采用原子吸收光谱仪测定滤液中残留的Cs+含量;采用FTIR技术分析碱激发粉煤灰吸附Cs+前后的结构变化。
按式(1)计算平衡吸附率(R,%)

式中:ρ0和ρe分别为初始和吸附平衡时的Cs+质量浓度,mg/L。
2 结果与讨论
2.1 碱激发粉煤灰的表征结果
2.1.1 XRD谱图
碱激发前后粉煤灰的XRD谱图见图1。
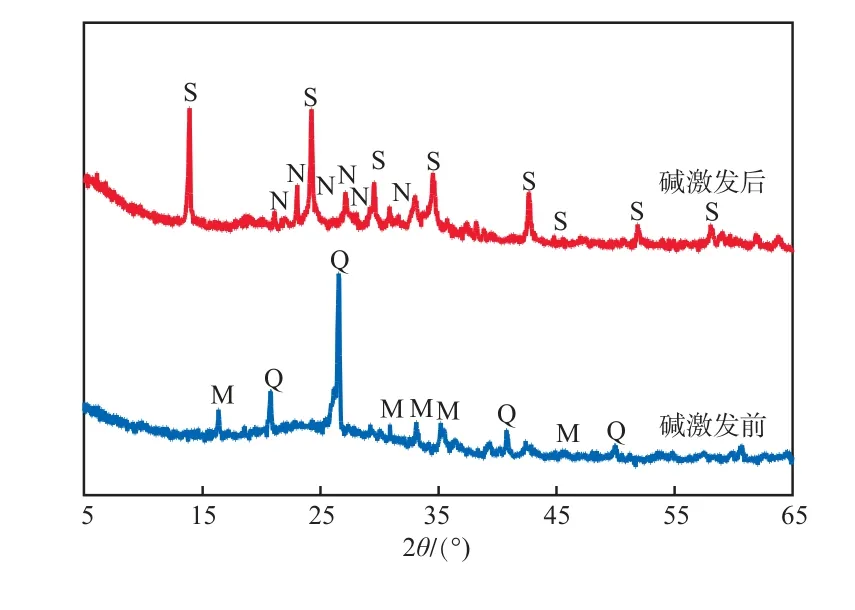
图1 碱激发前后粉煤灰的XRD谱图
由图1可见:在2θ=15º~35º的区域出现弥散状的峰包隆起,此峰包的大小可表征粉煤灰中玻璃体的相对含量,碱激发处理后峰包面积减小,说明粉煤灰的玻璃体结构被破坏[14];粉煤灰中存在莫来石和石英相,碱激发处理后,晶相发生了改变,生成了方钠石和霞石相,属架状结构的硅酸盐矿物,内部孔隙密布,推测其具有更优秀的吸附潜力。将粉煤灰与助熔剂在高温下熔融,对粉煤灰中的稳定结构造成了一定的破坏;进一步与氢氧化钠反应,高浓度的OH-使原先聚合度较高的玻璃相网络中的Si—O,Al—O键断裂,成为不饱和活性键,增强了粉煤灰的活性。
2.1.2 SEM照片
碱激发前后粉煤灰的SEM照片见图2(放大倍数为2 000倍)。由图2可见:碱激发后,颗粒表面粗糙化,褶皱明显增多,且粒径分布变得集中;碱激发前大小不一的玻璃微珠结构已观察不到,仅可见玻璃微珠破碎后的散落碎片。说明碱激发破坏了粉煤灰表面密实的硬壳层,使玻璃微珠内部的松散层暴露出来,这有利于提高粉煤灰的活性。研究表明,碱激发会使粉煤灰颗粒表面发生化学解离,从而破坏其坚硬外壳,使比表面积增大[10]。

图2 碱激发前后粉煤灰的SEM照片
2.2 碱激发前后粉煤灰吸附性能的比较
在初始Cs+质量浓度为200 mg/L、吸附温度为25 ℃、溶液pH为10的条件下,碱激发前后粉煤灰的吸附性能比较见图3。由图3可见,在粉煤灰投加量从0.5 g/L升至14.0 g/L的过程中,碱激发粉煤灰的吸附率呈上升趋势,而碱激发前的粉煤灰几乎没有变化;当投加量为12.0 g/L时,碱激发粉煤灰的吸附率可达80%以上,较碱激发前提高了3倍以上。碱激发改性使粉煤灰对Cs+的吸附性能有了较大提高,达到了改性处理的目的。以下实验均采用碱激发粉煤灰作为吸附剂。
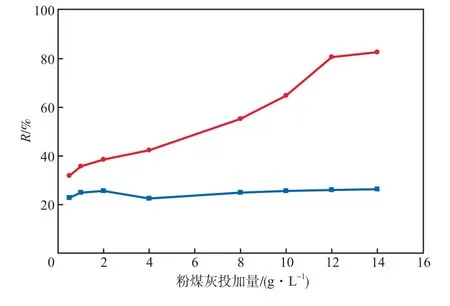
图3 碱激发前后粉煤灰的吸附性能比较
2.3 最佳溶液pH的确定
在碱激发粉煤灰投加量为3.3 g/L,初始Cs+质量浓度为50 mg/L、吸附温度为25 ℃的条件下,溶液pH对Cs+平衡吸附量(qe,mg/g)的影响见图4。
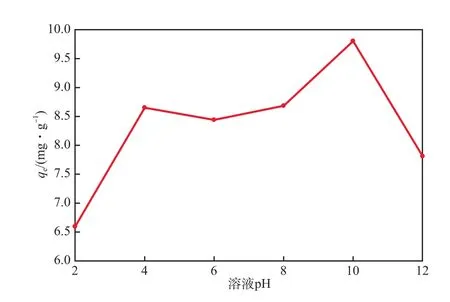
图4 溶液pH对Cs+平衡吸附量的影响
由图4可见,在pH较低时,Cs+的平衡吸附量较低。这是由于在低pH时,碱激发粉煤灰表面的羟基难以解离,表面的电负性较小,阻碍了羟基与Cs+的作用,且H+与Cs+产生竞争吸附,占据吸附位点,导致Cs+吸附量降低。Giannakopoulou等[15]发现,H+可有效地去除粘土矿物晶格边缘的Cs+,与上述观点相符。由图4还可见,随pH升高平衡吸附量呈上升趋势,当pH=10时吸附量达最大值,继续增大pH吸附量反而减少。这是由于:在较高pH时,溶液中的OH-浓度较高,不会与Cs+产生竞争吸附,且随着OH-浓度升高,碱激发粉煤灰表面的质子数量下降,更多的静电吸附位点出现,能吸附更多的Cs+,故吸附量增加;而当pH>10时,可能由于Cs+在强碱性溶液中会发生水解或与其他氢氧化物产生络合而阻碍吸附作用。综上所述,最佳溶液pH为10。
2.4 吸附动力学
在碱激发粉煤灰投加量为3.3 g/L、溶液pH为10、初始Cs+质量浓度为100 mg/L的条件下,不同吸附温度时的qt~t曲线见图5;在碱激发粉煤灰投加量为3.3 g/L、溶液pH为10、吸附温度为25 ℃的条件下,不同初始Cs+质量浓度时的qt~t曲线见图6。由图5和图6可见:碱激发粉煤灰对Cs+的吸附速率很快,吸附10 min时即能达到平衡吸附量的80%以上;在10~180 min内吸附量变化不大,吸附180 min时均达到平衡。由此可见,碱激发粉煤灰对Cs+的吸附由前期的快速吸附和后期的慢速吸附两个阶段组成,且以前期的快速吸附为主。由于物理吸附的速度较化学吸附要快,因此可推测碱激发粉煤灰对Cs+的吸附作用以表面的物理吸附为主。由图5还可见,温度升高有利于碱激发粉煤灰对Cs+的吸附,Cs+的吸附量随温度升高而逐渐增大,但增幅并不显著,这与物理吸附的特征基本相符[4]。

图5 不同吸附温度时的qt~t曲线
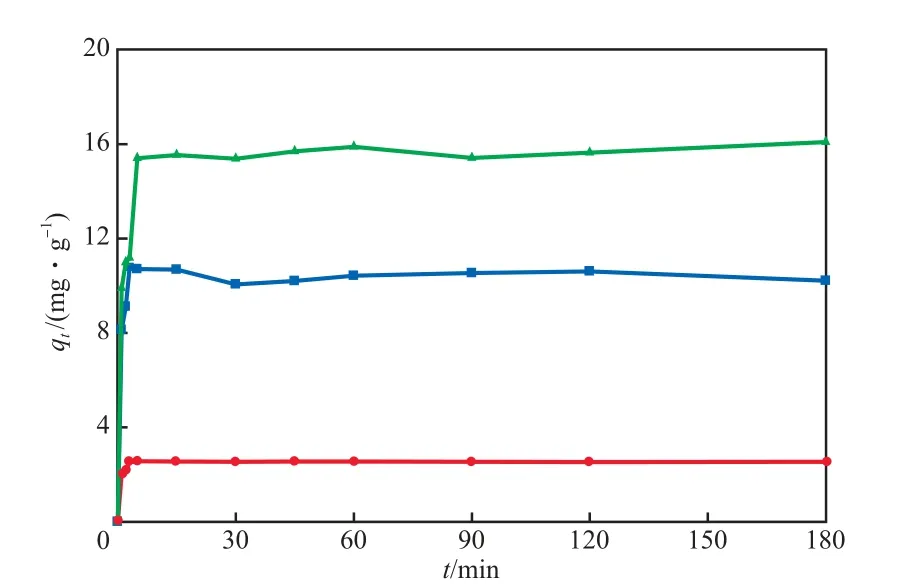
图6 不同初始Cs+质量浓度时的qt~t曲线
常见的描述吸附过程的动力学方程有准一阶动力学方程(见式(2))、准二阶动力学方程(见式(3))、Elovich动力学方程(见式(4))和双常数动力学方程(见式(5))[16]。
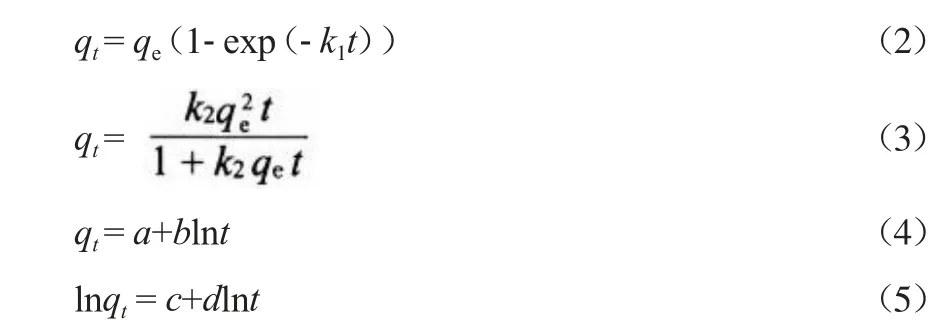
式中:t为吸附时间,min;qt为t时刻的吸附量,mg/g;k1,k2,a,b,c,d为动力学参数。
分别采用上述方程对吸附动力学实验数据进行拟合,其中拟合度较高的准二阶动力学方程和Elovich动力学方程的拟合结果见表2。由表2可见,准二阶方程、Elovich方程的相关系数均较高,准二阶方程较之Elovich方程的拟合效果更好,且用准二阶方程计算出的平衡吸附量与实验所得非常接近,说明碱激发粉煤灰对Cs+的吸附过程可用准二阶动力学方程来描述。由表2还可见,随温度的升高,k2增大,这符合化学反应的特征,且准二阶方程是建立在速率控制步骤为化学反应或通过电子共享、得失发生的化学吸附的基础上的,说明该吸附过程也包含了化学吸附[17]。
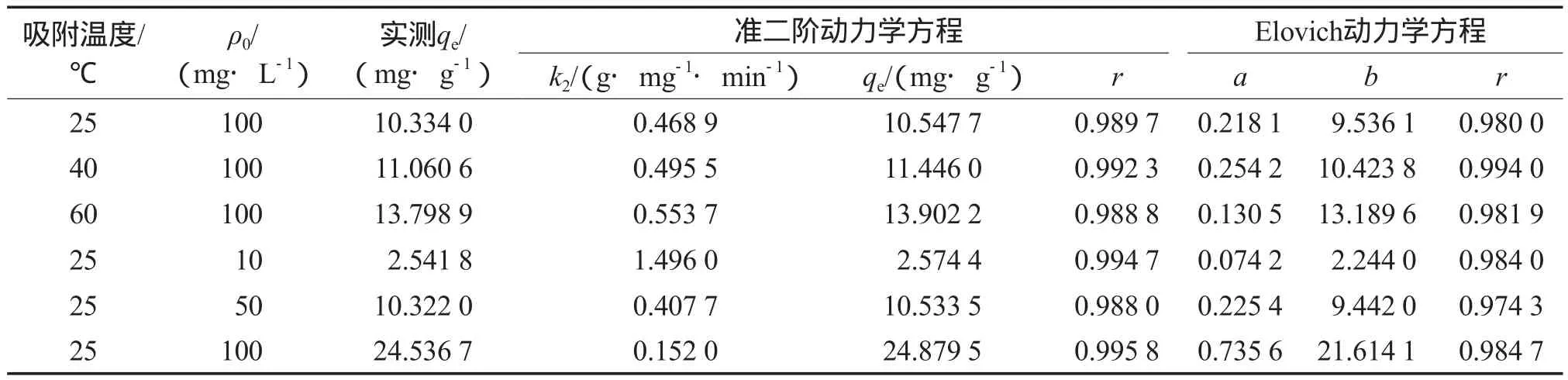
表2 动力学方程的拟合结果
2.5 等温吸附模型
常见的等温吸附模型有Langmuir等温吸附模型、Freundlich等温吸附模型和Redlich-Peterson等温吸附模型,见式(6)~(8)[18]。

式中:qsat为饱和吸附量,mg/g;KL,KF,n,KR,aR,α为与吸附有关的常数。另有分离系数RL=1/(1+ρ0KL)。
采用上述模型对碱激发粉煤灰投加量为3.3 g/L、溶液pH为10、吸附温度为60 ℃时的等温吸附实验数据进行拟合,拟合结果见表3。由表3可见,3种模型对吸附过程都有不错的拟合结果,其中Langmuir模型的相关系数要稍高于Freundlich和Redlich-Peterson模型。由Langmuir模型得到的饱和吸附量为45.15 mg/g。
2.6 吸附热力学
由2.4节可知,碱激发粉煤灰对Cs+的吸附过程可用准二阶动力学方程描述。根据Arrhenius公式(见式(9)),以准二阶动力学方程的lnk2对1/T作曲线(碱激发粉煤灰投加量为3.3 g/L、溶液pH为10、初始Cs+质量浓度为100 mg/L),可得碱激发粉煤灰对Cs+的吸附活化能,由热力学方程(见式(10)和式(11))可得更多热力学参数。

式中:k为吸附速率常数;K0为温度影响因子;T为吸附温度,K;Ea为吸附活化能kJ/mol;R为气体摩尔常数,8. 314 J/(mol·K)-1;K为吸附平衡常数;ΔG0为自由能变化,kJ/mol;ΔH0为焓变,kJ/ mol;ΔS0为熵变,J/(mol·K)-1。
吸附热力学参数见表4。由表4可见:ΔG0均为负值,说明吸附为自发过程,且温度升高自发的程度大;ΔH0大于0,说明吸附为吸热过程;ΔS0大于0,表明碱激发粉煤灰吸附Cs+时在固液相界面的自由度增加;Ea约为7.5 kJ/mol,而化学吸附的活化能一般大于40 kJ/mol[6],说明碱激发粉煤灰对Cs+的吸附以物理吸附为主。
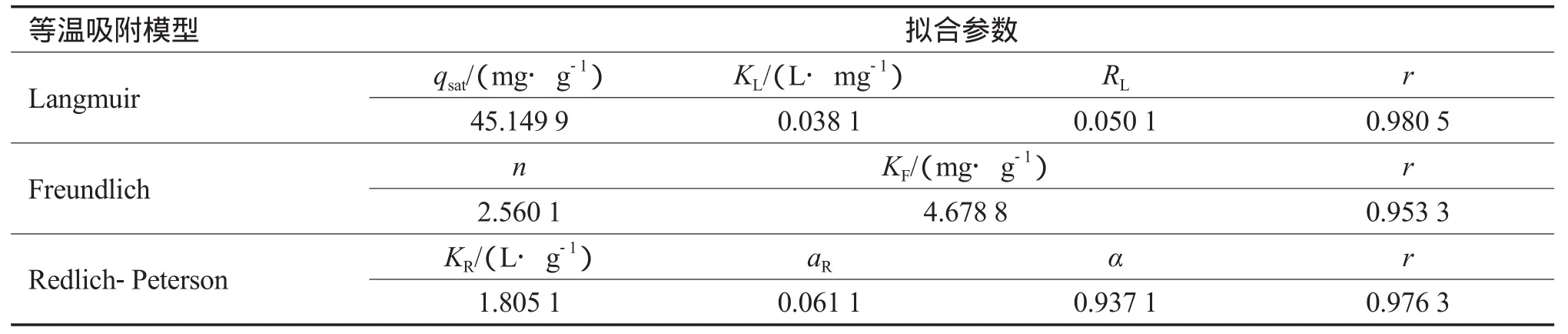
表3 等温吸附模型的拟合结果
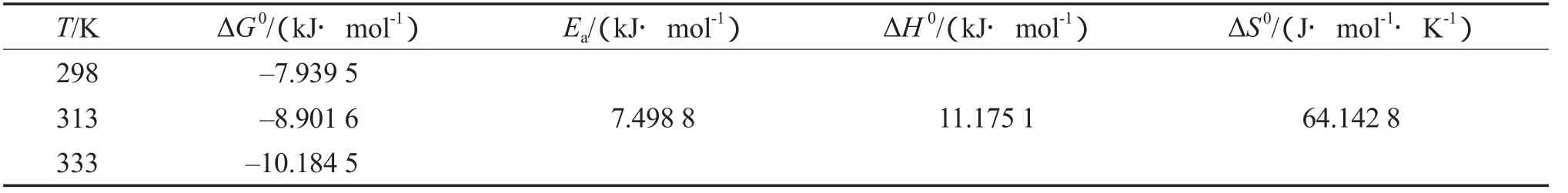
表4 吸附热力学参数
2.7 碱激发粉煤灰吸附Cs+的FTIR分析结果
碱激发粉煤灰吸附Cs+前后的FTIR谱图见图7。由图7可见:吸附前的碱激发粉煤灰在3 434.41 cm-1处出现强宽峰,它归属于结晶水或结构水中O—H键的伸缩振动,1 639.96 cm-1处产生的特征峰归属于O—H键的弯曲振动;995.56 cm-1处的吸收带归属于Si—O—Si(或Si—O—Al)键的不对称伸缩振动,691 cm-1处的吸收带则归属于Si—O—Si键的对称伸缩振动;在444.57 cm-1处出现O—Si—O(或O—Al—O)键的弯曲振动带[7]。由图7还可见:吸附后,谱图总体来说变化不大,没有出现新的特征峰,仅在局部发生微小变化,说明碱激发粉煤灰吸附Cs+后结构仍保持相对完整;O—H键伸缩振动和弯曲振动峰发生微小的偏移,振动频率发生变化;996.03 cm-1处由Si—O—Si(或Si—O—Al)键不对称振动衍射峰的强度变大,O—Si—O(或O—Al—O)键弯曲振动特征峰从444.57 cm-1红移至441.80 cm-1,振动频率变低。这可能是由于:碱激发粉煤灰中的Na+,K+等离子部分被原子质量更大、半径也更大的Cs+置换,Cs+与O—H键发生作用使其极性大小发生改变,导致振动频率发生变化;Cs+进入孔道、孔隙后,对四面体骨架结构产生作用,使Si—O键极性大小发生改变,导致碱激发粉煤灰中硅氧骨架的振动频率和强度发生改变[19]。从FTIR结果可推测,在碱激发粉煤灰吸附Cs+的过程中物理吸附占优,并伴随化学吸附。

图7 碱激发粉煤灰吸附Cs+前后的FTIR谱图
3 结论
a)采用碱激发改性粉煤灰。在初始Cs+质量浓度为200 mg/L、吸附温度为25 ℃、溶液pH为10、碱激发粉煤灰投加量为12.0 g/L的条件下,碱激发粉煤灰对Cs+的平衡吸附率可达80%以上,其吸附能力比碱激发前提高了3倍以上。
b)表征结果显示,碱激发处理后,粉煤灰的晶相发生了改变,且粉煤灰表面密实的硬壳层被破坏。
c)碱激发粉煤灰对Cs+的吸附过程可用准二阶动力学方程来描述,并较好地符合Langmuir等温吸附模型。
d)动力学、热力学及FTIR的研究结果表明:碱激发粉煤灰对Cs+的吸附是吸热过程,且能自发进行;该过程以物理吸附为主,并伴随化学吸附。
e)粉煤灰对Cs+的吸附能力很有限,必须通过合理的表面或结构修饰来改善。作为排放量最大的工业废弃物之一,寻找合适的改性方法提高其吸附性能并用于放射性废水的处理,是一个值得深入研究的方向。
[1] Datta S J,Moon Won Kyung,Choi Do Young,et al. A Novel Vanadosilicate with Hexadeca-Coordinated Cs+Ions as a Highly Effective Cs+Remover[J]. Angew Chem,2014,162(28):7331 - 7336.
[2] Avramenko V A,Zheleznov V V,Kaplun E V,et al. Sorption-Reagent Method in Liquid Radioactive Waste Management[J]. MRS Proc,2002,713:893 - 900.
[3] Vejsada J,Jelı nek E,Řanda Z,et al. Sorption of Cesium on Smectite-Rich Clays from the Bohemian Massif(Czech Republic) and Their Mixtures with Sand[J]. Appl Radiat Isot,2005,62(1):91 - 96.
[4] El-Naggar M R,El-Kamash A M,El-Dessouky M I,et al. Two-Step Method for Preparation of NaA-X Zeolite Blend from Fly Ash for Removal of Cesium Ions[J]. J Hazard Mater,2008,154(1/2/3):963 - 972.
[5] Ding Dahu,Lei Zhongfang,Yang Yingnan,et al. Eff ciency of Transition Metal Modif ed Akadama Clay on Cesium Removal from Aqueous Solutions[J]. Chem Eng J,2014,236:17 - 28.
[6] Volchek K,Miah M Y,Kuang Wenxing,et al. Adsorption of Cesium on Cement Mortar from Aqueous Solutions[J]. J Hazard Mater,2011,194:331 - 337.
[7] Kim Jong-Oh,Lee Seung-Mok,Jeon Choong. Adsorption Characteristics of Sericite for Cesium Ions from an Aqueous Solution[J]. Chem Eng Res Des,2014,92(2):368 - 374.
[8] 钱觉时,吴传明,王智. 粉煤灰的矿物组成:上[J].粉煤灰综合利用,2001(1):26 - 31.
[9] 黎苇,汪国元,曹树祥. 粉煤灰的改性及其吸附性能[J]. 化工环保,2010,30(4):352 - 355.
[10] Nascimento M,Soares P S M,de Souza V P. Adsorption of Heavy Metal Cations Using Coal Fly Ash Modif ed by Hydrothermal Method[J]. Fuel,2009,88(9):1714 - 1719.
[11] 叶爱英,徐景峰. 粉煤灰的改性、成型及深度除磷应用[J]. 化工环保,2013,33(1):84 - 86.
[12] Papandreou A D,Stournaras C J,Panias D,et al. Adsorption of Pb(Ⅱ),Zn(Ⅱ) and Cr(Ⅲ) on Coal Fly Ash Porous Pellets[J]. Miner Eng,2011,24(13):1495 - 1501.
[13] Rodella N,Bosio A,Zacco A,et al. Arsenic Stabilization in Coal Fly Ash through the Employment of Waste Materials[J]. J Environ Chem Eng,2014,2(3):1352 - 1357.
[14] 赵晓光,刘转年,刘源,等. 粉煤灰基成型吸附剂的制备及其对亚甲基蓝的吸附性能[J]. 硅酸盐学报,2009,37(10):1683 - 1688.
[15] Giannakopoulou F,Haidouti C,Chronopoulou A,et al. Sorption Behavior of Cesium on Various Soils under Different pH Levels[J]. J Hazard Mater,2007,149(3):553 - 556.
[16] 张双圣,刘喜坤,刘倩,等. 纳米羟基磷灰石的制备及其对Pb2+的吸附性能[J]. 化工环保,2012,32(2):123 - 128.
[17] Chen Yilan,Tong Yueyu,Pan Rongwei,et al. The Research on Adsorption Behaviors and Mechanisms of Geopolymers on Sr2+,Co2+and Cs+[J]. Adv Mater Res,2013,704:313 - 318.
[18] 近藤精一,石川达雄,安部郁夫. 吸附科学[M]. 李国希译. 2版. 北京:化学工业出版社,2006:37 -39.
[19] 易发成,金承黎,李玉香. 4A沸石吸附模拟核素Sr,Cs后的组分变化和结构表征[J]. 矿物岩石,2005,25(2):35 - 39.
(编辑 魏京华)
一种净化乙苯催化脱氢制苯乙烯工艺凝液的方法
该专利涉及一种净化乙苯催化脱氢制苯乙烯工艺凝液的方法。其特征在于,在酸性脱氢液进入空冷器前向酸性脱氢液中加入胺类物质中和,从而最大程度地避免金属腐蚀而产生铁离子;在进汽提塔前向工艺凝液中加入阻聚剂,有效控制工艺凝液中苯乙烯等组分在汽提塔内的聚合结垢,提高烃类在该塔内的汽提去除率;且将汽提塔底来水不经过降温直接引入空气吹脱塔中,进一步除去其中的烃类,同时提高吹脱气的温度,从而提高蒸汽过热炉的热效率;最后将吹脱后的工艺凝液送入砂滤塔中,除去氧化形成的聚苯乙烯、胶体状的烃类和金属氧化物等。/CN 104341069 A,2015-02-11
一种电解锰生产废渣的处理方法
该专利涉及一种电解锰生产废渣的处理方法。包括如下步骤:a)先将电解锰生产废水中Cr(Ⅵ)还原成Cr(Ⅲ),沉淀后压滤形成第一泥渣;b)利用第一次中和反应调整还原处理后废水的pH为碱性,沉淀后压滤形成第二泥渣;c)对NH3-N进行吹脱处理,经吹脱处理后的废水再采用折点加氯法去除剩余NH3-N;d)采用氢氧化钙进行第二次中和反应,去除废水中的Mn2+和H2SO4,继续添加非离子型高分子絮凝剂去除废水中的悬浮物,在砂滤池进行沉淀过滤,沉淀后压滤形成第三泥渣。该专利能有效去除电解锰生产废渣中的Mn2+、H2SO4、Cr(Ⅵ)、Cd2+、NH3-N等有害物质及重金属离子,且处理工艺简单,成本低廉。/CN 104261584 A,2015-01-07
一种制革污泥热处理过程中铬的形态转化控制工艺
该专利涉及一种制革污泥热处理过程中铬的形态转化控制工艺。包括以下工序:将含铬制革污泥置于可密闭的反应器中,通入保护气氛排尽氧气后,加热至450~1 200 ℃,保护气流量为每公斤污泥0~20 L/min,热解10~180 min,至制革污泥中所有有机质全部热解完全;停止加热,待反应器降温至150 ℃以下(以免空气中的氧气氧化铬),取出制革污泥。该专利的优点在于:热解过程中,制革污泥中的铬从可交换态、还原态、氧化态这三种形态向残渣态转化,降低重金属对环境的影响;热解后,制革污泥中的铬主要以残渣态形式存在(残渣态比例大于66.67%),生物有效性低,环境风险小;热解后,制革污泥中铬的可交换态比例降低(小于1%),环境风险降低,根据风险评价因子(RAC)评级标准,其对环境表现为无风险。/CN 104261646 A,2015-01-07
电解锌厂生产废水的处理方法
该专利涉及一种电解锌厂生产废水的处理方法。包括以下步骤:将电解锌厂生产废水经过格栅进入调节池,平衡调节后由泵提升进入混合反应沉淀池,加入硫酸亚铁,搅拌反应20 min,同时用氢氧化钠调节pH至8~10,反应结束后沉淀2 h,上清液废水即可达到排放要求。该专利方法工艺简单,操作方便,运行费用低,处理效果好,可广泛应用于此类电解锌厂生产废水的处理。/CN 104261527 A,2015-01-07
Adsorption Behavior of Alkali Activated Fly Ash to Cesium Ions
Luo Jie1,Zhang Haijun2,Liu Jing1,Yang Jian3,Huang Sheng1,Deng Shiming1
(1. School of Environment and Resources,Southwest University of Science and Technology,Mianyang Sichuan 621010,China;2. School of Science,Southwest University of Science and Technology,Mianyang Sichuan 621010,China;3. School of Applied Technology,Southwest University of Science and Technology,Mianyang Sichuan 621010,China)
The f y ash was modif ed by alkali activation and characterized by XRD and SEM. The adsorption kinetics and thermodynamics characteristics of Cs+on alkali activated fly ash were investigated through an experiment of static equilibrium adsorption,and the alkali activated f y ash before and after adsorption was analysed by FTIR. The characterization results show that the crystal phase of the alkali activated f y ash is changed,and the hard shell layer on the surface of f y ash is destroyed after alkali activation. The experimental results show that:Under the conditions of initial Cs+mass concentration 200 mg/L,adsorption temperature 25 ℃,solution pH 10 and alkali activated f y ash dosage is 12.0 g/L,the equilibrium adsorption ratio of Cs+on the alkali activated f y ash can reach above 80%,which is more than 3 times higher than that on the f y ash before alkali activation;The adsorption is coincident with quasi-second order kinetics equation and f ts Langmuir isothermal adsorption model well;The adsorption of Cs+on alkali activated f y ash is a spontaneous endothermic process,and the main adsorption behavior is physical adsorption accompanied with chemical adsorption.
f y ash;alkali activation;physical adsorption;cesium ion;radioactive wastewater
X703
A
1006 - 1878(2015)02 - 0192 - 07
2014 - 10 - 27;
2015 - 01 - 09。
罗洁(1990—),男,安徽省六安市人,硕士生,电话 15228356401,电邮 978415194@qq.com。联系人:杨剑,电话 15983636676,电邮 yangj616@126.com。
西南科技大学博士科研基金项目(11zx7112)。

