人参二醇组皂苷提取物对再生障碍性贫血小鼠免疫调节作用的研究
郑智茵,尹利明,庄海峰,成 志,赵燕娜,余潇苓,高瑞兰
(浙江中医药大学1.附属第一医院血液病研究所,浙江杭州 310006; 2.附属第二医院,浙江杭州 310005)
人参二醇组皂苷提取物对再生障碍性贫血小鼠免疫调节作用的研究
郑智茵1,尹利明1,庄海峰1,成志2,赵燕娜1,余潇苓1,高瑞兰1
(浙江中医药大学1.附属第一医院血液病研究所,浙江杭州310006; 2.附属第二医院,浙江杭州310005)
摘要:目的观察自行提取分离的中药新药人参二醇组皂苷提取物(PDS-C)对再生障碍性贫血(再障)小鼠促进造血和调节免疫的作用。方法BALB/c小鼠经亚致死量照射后输入DBA/2小鼠的淋巴细胞,制成免疫介导型再障模型。实验分6组,正常小鼠、模型组、PDS-C低、中和高剂量治疗组及环孢素阳性药物对照组,均灌胃给药15 d。检测外周血象、骨髓病理检查造血组织增生状况、脾脏T细胞亚群比例,及T细胞分化相关T-bet、GATA-3和FOXP3转录调控蛋白的表达水平。结果PDS-C治疗再障小鼠的疗效明显,中、高剂量组的外周血红蛋白、白细胞和血小板计数均明显高于模型组,骨髓造血组织增生状况也明显优于模型组。PDS-C升高Th2细胞和调节性T细胞(Treg)的比例,降低Th1细胞比例,并上调GATA-3和FOXP3蛋白及下调T-bet蛋白的表达。结论PDS-C有效地促进造血,改善再障的骨髓抑制,加快造血功能恢复而升高外周血象;同时通过恢复再障小鼠失衡的Th1/Th2/Treg细胞比例而参与调节免疫,该文为PDS-C的临床应用提供实验依据。
关键词:人参二醇组皂苷;再生障碍性贫血;免疫调节; T细胞亚群;小鼠;实验研究
再生障碍性贫血(再障,AA)是一种以造血组织为靶器官的自身免疫性疾病,而Th1细胞的异常活化及自身反应性T细胞功能亢进,导致造血干细胞过度凋亡、造血微环境损伤、最终造血衰竭的主要原因[1-2]。目前免疫抑制疗法为治疗再障的一线方案,但其疗效尚不够理想,且有诸多严重的毒副作用,如肝肾毒性反应,并可诱发恶性肿瘤,存在高花费和高风险的问题。因此寻找并研究安全有效治疗再障的中药新药很有必要。我们从人参原料提取分离出人参总皂苷,并进一步分离出促进造血活性明显的人参二醇组皂苷提取物(PDS-C),经液相色谱-质谱联用法分析主含5个人参皂苷单体,完成了新药临床前研究的实验和资料23项,成功获得国家药监局批准的临床试验批件,体外研究显示具有促进造血和调节免疫的双重功效,功能主治用于治疗多种血细胞减少症,如免疫性血小板减少症和原因不明的白细胞减少症[3],但是PDS-C治疗再障的研究尚未见报道。本文制备免疫介导型再障小鼠模型,采用低、中和高剂量PDS-C治疗,通过观察外周血象、骨髓增生状况、T细胞亚群比例及相关转录调控蛋白等,综合评价PDS-C治疗再障的疗效,并探讨其调节免疫的机制。
1 材料与方法
1.1实验动物和药物BALB/c小鼠(18~22 g,♂♀不限) 60只,用于制备再障小鼠模型; DBA/2小鼠(18~22 g,♂♀不限) 6只,作为免疫活性细胞的供体,均由浙江中医药大学动物中心提供。
PDS-C干燥粉剂由浙江中医药大学附属第一医院血液病研究所提取分离,经液相色谱-质谱联用技术分析,主含5个人参皂苷单体,纯度达到94.2%,生理盐水配制成工作液。环孢素由杭州中美华东制药公司生产,批号为H10960121,生理盐水配制成工作液。
1.2方法
1.2.1制备免疫介导型再障小鼠模型按照本研究所建立的方法[4],无菌取DBA/2小鼠胸腺及颈部、颌下、腋窝、腹股沟等处的淋巴结。置200目的不锈钢过滤网上,轻轻捣碎研磨,生理盐水冲洗,收集单细胞悬液,计数并调整细胞浓度为5×109· L-1。BALB/c小鼠经60Coγ射线(1.0 Gy,5 min)全身均匀照射后,于4 h内自尾静脉输入供鼠的淋巴细胞106/只。
1.2.2PDS-C治疗及外周血象检测60只BALB/c小鼠随机分6组,每组10只;包括正常小鼠、模型组、PDS-C低、中和高剂量治疗组(20、40和80 mg· kg-1·d-1,剂量根据预实验及临床患者治疗剂量折算)及环孢素(CsA 50 mg·kg-1·d-1)为阳性对照组。均灌胃给药治疗15 d(相当于患者治疗10个月的疗程),模型组灌胃等量的生理盐水。治疗7、15 d,分别用ABX血细胞分析仪检测各组小鼠的外周血细胞数量。
1.2.3流式细胞术检测小鼠脾脏T细胞亚群比例
治疗后取各组小鼠的脾脏,制备脾脏单个细胞悬液,按照Th1/Th2和Treg试剂盒进行标记。Th1/Th2/Treg细胞的标记方法如下:单个细胞悬液中分别加入4 μL PMA/Ionomycin和BFA/Monensin混匀,37℃5% CO2培养箱刺激培养4 h,每1 h混匀1次。刺激后,加入CD4-PerCP抗体进行表面标记,100 μL FIX&PERM固定液避光固定,之后分别加入FITC-IFN-γ、APC-IL-4、PE-CD25和APC-FOXP3抗体,避光孵育20 min,PBS洗涤后上机检测。以淋巴细胞设门,分别记录5 000个CD4阳性细胞群内IFN-γ+细胞、IL-4+细胞和CD25+FOXP3+细胞(Treg细胞)的百分数。
1.2.4Western blot方法检测小鼠脾脏T-bet和GATA-3和FOXP3蛋白的表达水平取出各组小鼠的脾脏,按照本研究所建立的方法抽提总蛋白[5],蛋白定量检测试剂测定蛋白量,取40 μg总蛋白进行100 g·L-1SDS-PAGE电泳,然后40mA恒流条件下,4℃转移过夜; TBS/T洗膜3次后,分别加入抗小鼠的T-bet GATA-3、TOXP3抗体4℃孵育过夜,再与HRP标记的二抗作用,经充分洗涤后用ECL发光剂(Amersham)作用1 min,采用灰度扫描系统测定并分析目的蛋白条带。
1.2.5骨髓病理取小鼠双侧下肢骨,置于苦味酸-多聚甲醛固定液中固定,稀盐酸中脱钙4~6 h后,进行脱水、浸蜡、包埋、切片,HE染色后观察骨髓造血组织增生情况。
2 结果
2.1PDS-C提高再障小鼠外周血细胞计数采用放射线照射联合异基因免疫细胞输入制备再障小鼠模型,模型小鼠外周血血红蛋白(Hb)、白细胞(WBC)和血小板(PLT)计数分别为(104.2±10.3) g·L-1、(0.8±0.1)和(180.8±12.3)×109·L-1,均明显低于正常小鼠的(164.2±14.2) g·L-1、(6.62±0.3)和(762.5±46.9)×109·L-1(P均<0.01),提示建立该再障模型是成功的。
PDS-C治疗AA小鼠,7 d起效,15 d疗效明显,低剂量有效,中、高剂量组的血象3系升高更为明显,高剂量组最佳。治疗15 d,Hb、WBC和PLT计数在中剂量组分别为(131.4±13.2) g·L-1、(3.6 ±0.3)和(476.3±39.2)×109·L-1;高剂量组为(144.4±11.2) g·L-1、(4.8±0.5)和(544.2± 41.4)×109·L-1,均明显高于模型组(P分别<0.05,0.01)。阳性对照药环孢素治疗后血象3系也有不同程度地提高,但低于PDS-C中、高剂量组(P分别<0.05,0.01)。

Fig 1 PDS-C increases peripheral blood countsin aplastic anemia mice
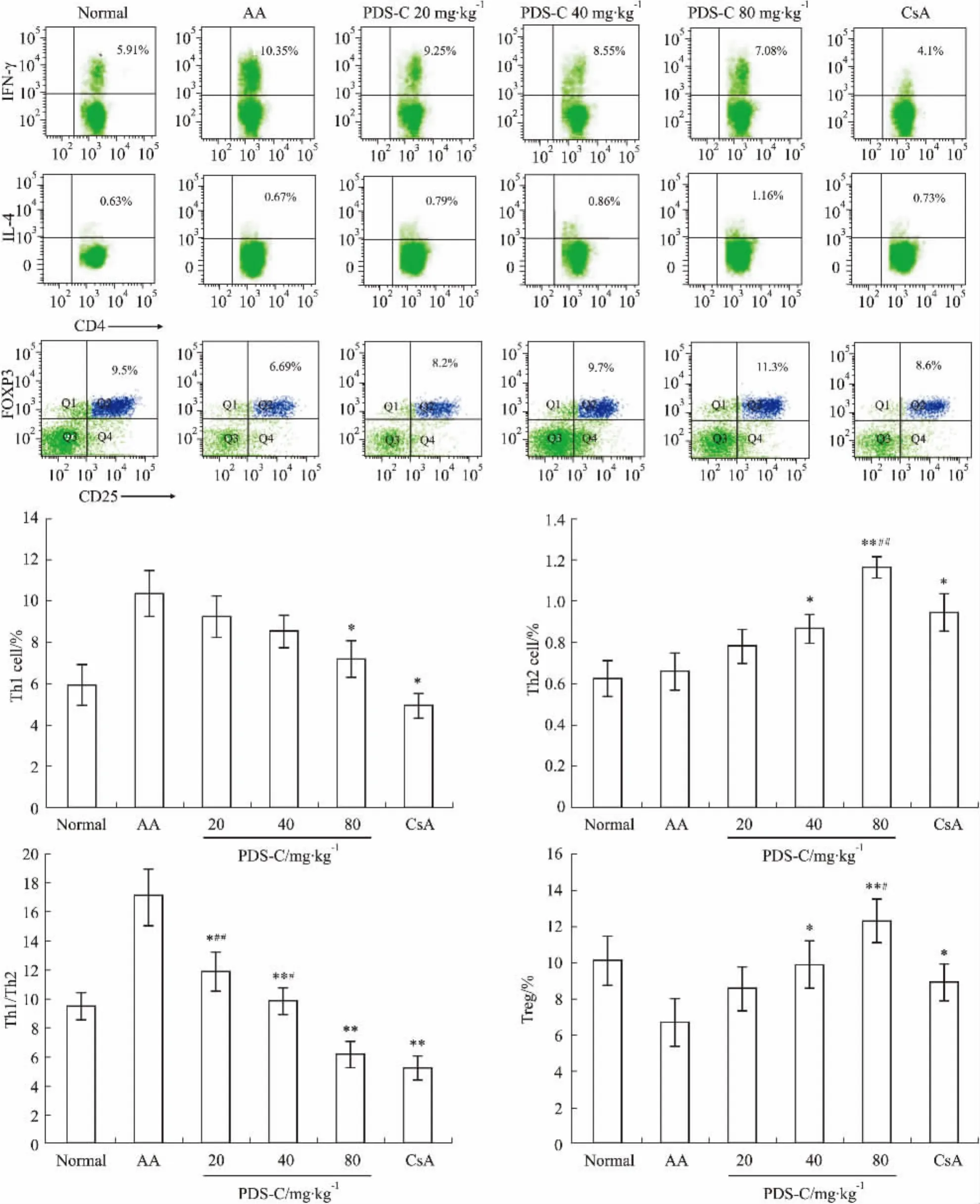
Fig 2 PDS-C regulates percentages of Th1/Th2/Treg cells in aplastic anemia mice
2.2降低再障小鼠Th1细胞比例,升高Th2和Treg细胞比例流式细胞术分析各组小鼠脾脏T细胞亚群比例,结果显示再障小鼠脾脏Th1细胞比例(10.4%±1.1%)高于正常对照组(6.0%± 1.0%),且Th1细胞/Th2细胞的比值(17.0%± 2.0%),高于正常对照组(9.49%±0.9%),而Treg细胞比例(6.7%±1.3%)低于正常对照组(10.1% ±1.2%) (P均<0.01)。

Fig 3 PDS-C regulates expression levels of T-bet,GATA-3and FOXP3 proteins in spleen of AA mice
PDS-C治疗再障小鼠15 d,高剂量组Th1细胞比例(7.2%±0.9%)低于再障模型组(P<0.05),中、高剂量组Th2细胞比例(0.87%±0.1%,1.17%± 0.1%)和Treg细胞比例(9.9%±0.9%,12.3%± 1.2%)均高于再障模型组(P分别<0.05,0.01),且低、中和高剂量组Th1细胞/Th2细胞的比值均低于再障模型组(P分别<0.05,0.01)。此外,高剂量组T细胞亚群比例与阳性药物CsA对照组类似。
2.3下调脾脏T-bet蛋白及上调GATA3和FOXP3蛋白的表达Western blot分析各组小鼠脾脏T-bet、GATA-3和FOXP3蛋白的表达水平,结果显示再障小鼠T-bet蛋白表达水平明显高于正常小鼠(P<0.01),而GATA-3和FOXP3蛋白表达量则低于正常小鼠(P均<0.05),提示再障小鼠T细胞相关蛋白表达的异常性。
PDS-C治疗再障小鼠15 d,中、高剂量组T-bet蛋白表达水平明显低于再障小鼠(P分别<0.05,0.01),而GATA-3和FOXP3蛋白表达量则高于再障小鼠(P分别<0.05,0.01)。此外,PDS-C治疗组的上述结果类似于免疫抑制剂CsA治疗组,提示PDS-C通过对T-bet、GATA-3和FOXP3蛋白的调控而发挥其治疗再障的免疫调节作用。
2.4改善再障小鼠的骨髓抑制,促进造血功能恢复Fig 4显示骨髓病理切片结果,正常小鼠组骨髓造血组织结构完整,增生活跃,造血岛着色均匀,造血细胞量丰富。再障模型小鼠骨髓增生低下,造血组织浅染,出现大量空白区,被脂肪组织代替,造血细胞量明显减少,符合再障的骨髓病理。
PDS-C各治疗组骨髓抑制状况有不同程度的改善,中、高剂量组的作用更为明显,出现造血组织结构修复现象,组织结构较紧密,空白区少,造血岛着色较均匀,造血细胞量明显较模型组丰富。此外,CsA阳性对照组的骨髓抑制也有所改善,但不如PDS-C高剂量组明显,仍可见空白区,造血细胞数量也较少。
3 讨论
再生障碍性贫血是一种自身免疫性疾病,表现为骨髓造血功能低下、全血细胞减少。大多数患者Th1型效应性T细胞异常增多,Th1/Th2比例严重失衡,异常增多的Th1细胞浸润骨髓和/或分泌大量Th1型细胞因子(IFN-γ、IL-2和TNF-α),直接和间接导致骨髓造血功能衰竭;而维持体内免疫耐受的Treg不仅数量明显减少且功能低下,提示机体免疫耐受功能受损[3],亦是造成骨髓衰竭的主要原因之一。临床研究显示免疫抑制疗法治疗再障的有效率达60%~80%,也证实T细胞免疫异常是再障发病的重要机制[6]。因此,本文观察PDS-C对免疫介导型再障小鼠的疗效,采用免疫抑制剂CsA作为阳性对照。

Fig 4 PDS-C improves myelosuppression status in AA mice (×400)
本文采用照射联合异基因免疫细胞输入法,成功地制备免疫介导型再障小鼠模型,骨髓增生极度低下,符合再障的骨髓病理。同时外周血Hb、WBC 和PLT均明显降低,Th1细胞比例明显升高,Treg细胞减少;同时T-bet蛋白表达升高,GATA-3和FOXP3蛋白则下降,表明该再障模型从细胞学、病理学、免疫表型到转录调控蛋白等多层次呈现了与临床再障患者类似的异常[1-2],适合用来客观地评价PDS-C对再障的疗效及作用机制。本文有关模型治疗的剂量和疗程,不但参考临床患者应用的剂量和疗程,而且考虑到小鼠的寿命远远短于人类,故设计PDS-C和CsA治疗再障小鼠15d,相当于临床CsA治疗再障患者10个月,符合CsA常规治疗再障患者的疗程需达到6个月以上。
PDS-C治疗再障小鼠的外周血象显示7 d起效,15 d疗效明显,低剂量有效,中、高剂量组的作用更为明显。骨髓病理检查也提示PDS-C中、高治疗组骨髓增生状况明显优于模型组。我们前期报道PDS-C在体外通过有效地刺激人、小鼠骨髓红系、粒系和巨核系造血祖细胞增殖而促进血细胞的生成,具有类似造血生长因子样的效应[3]。
临床研究发现免疫抑制疗法有效的再障患者,在骨髓恢复正常造血的同时Th1细胞比例减少,Th2细胞比例上调,Th1/Th2达到正常平衡状态,在T-bet蛋白表达明显下调的同时Treg细胞数量增加,FOXP3蛋白表达上调[7]。T-bet是Th1细胞专属的转录因子,调节Th0细胞向Th1细胞活化; GATA-3是Th2细胞专属转录因子,调节Th0细胞向Th2细胞活化[8-9],FOXP3是Treg细胞专属转录因子[10]。本文PDS-C不但有效地促进再障小鼠骨髓造血功能的恢复,明显提升外周血象,而且能够改善Th1/Th2/Treg细胞比例的失衡,下调T-bet、上调GATA-3和FOXP3蛋白的表达,提示PDS-C对T细胞的免疫调节作用与阳性对照组CsA相似。由此,推测PDS-C可通过抑制免疫介导再障小鼠T-bet的表达、上调GATA-3和TOXP3的表达水平来改善Th1/Th2/Treg细胞的失衡,从而促进造血功能的恢复和机体的免疫耐受。
综上,我们自行提取分离的中药新药PDS-C对再障小鼠具有促进造血,调节免疫的功效,本文结果为PDS-C的临床应用提供实验依据。
(致谢:本研究在浙江中医药大学动物实验研究中心和国家中医药管理局血液细胞分子生物学三级实验室完成。)
参考文献:
[1]Sheng W1,Liu C,Fu R,et al.Abnormalities of quantities and functions of linker for activations of T cells in severe aplastic anemia[J].Eur J Haematol,2014,93(3) :214-23.
[2]Ge M,Zheng Y,Li X,et al.Differential expression profile of Th1/Th17/Th2-related chemokines and their receptors in patients with acquired bone marrow failure syndromes[J].Hum Immunol,2013 Feb;74(2) :176-80.
[3]Gao Ruilan,Chong Beng Hock.Research and development of the effective components of Panaxadiol saponin as new Chinese patent medicine for treating hemocytopenia[J].Chin J Integr Med,2012,18(12) : 892
[4]Yin L M,Jiang H F,Wang X,et al.Effects of sodium copper chlorophyllin on mesenchymal stem cell function in aplastic anemia mice[J].Chinese J Integrative Med,2013,19(5) :360-6.
[5]尹利明,赵燕娜,杜文喜,等.人参总皂苷增强成骨分化的间充质干细胞促造血作用研究[J].中国药理学通报,2015,31(1) : 45-9.
[5]Yin L M,Zhao Y N,Du W X,et al.Total saponins of panax ginseng enhancing the effect of osteoblast differentiation from mesenchymal stem cell on promotion hematopoiesis[J].Chin Pharmacol Bull,2015,31(1) :45-9.
[6]Shin S H,Lee J W.The optimal immunosuppressive therapy for aplastic anemia[J].Int J Hematol,2013,97(5) :564-72.
[7]Garg R,Faderl S,Garcia-Manero G,et al.Phase II study of rabbit anti-thymocyteglobulin,cyclosporine and granulocyte colonystimulating factor in patients with aplastic anemia and myelodysplastic syndrome Immunosuppressive therapy for bone marrow failure[J].Leukemia,2009,23(7) : 1297-302.
[8]Rengarajan J,Szabo S J,Glimcher L H.Transcriptional regulation of Th1/Th2 polarization[J].Immunol Today,2000,21(10) : 479-83.
[9]Kaito K,Otsubo H,Usui N,et al.Th1/Th2 lymphocyte balance in patients with aplastic anemia[J].RinshoByori-Japanese J Cli Pathol,2004,52(7) : 569-73.
[10]Abdallah M1,Attia E A,Saad A A,et al.Serum Th1/Th2 and macrophage lineage cytokines in leprosy; correlation with circulating CD4(+ ) CD25(high) FoxP3(+ ) T-regs cells[J].Exp Dermatol,2014,23(10) :742-7.
Effects of PDS-C on immunoregulation in mice with aplastic anemia
ZHENG Zhi-yin1,YIN Li-ming1,ZHUANG Hai-feng1,CHENG Zhi2,ZHAO Yan-nan1,YU Xiao-ling1,GAO Rui-lan1
(1.Institute of Hematology,the First Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou 310006,China; 2.The Second Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou 310005,China)
Abstract:AimTo observe the effects of panaxdiol saponins component (PDS-C) extracted and isolatedbook=795,ebook=60from Chinese ginseng herb as new Chinese patent medicine on the promotion of hematopoiesis and the regulation of the immune system in treating mice models with aplastic anemia (AA).Methods For preparation of immune mediated AA models,BALB/c mice were exposed to sublethal doses of 5.0 Gy γ radiation,followed by transplanted lymphocytes from DBA/2 donor mice.The mice models were divided into six groups including normal control,AA model,PDS-C treated groups with lower,medium and higher dosages,cyclosporine (CsA) as positive drug control.Both PDSC and CsA were administered by gastrogavage for 15 days.The peripheral blood cells counts and bone marrow pathological examination were tested,the percentages of Th1/Th2/Treg cells from spleen were measured,the protein expression levels of T-bet,GATA-3 and FOXP3 transcription factors in spleen cells were detected.Results Curative effect of PDS-C on treating AA mice was satisfactory.The peripheral hemoglobin,white blood cells and platelet counts in PDS-C groups with medium and higher doses were significantly higher than those in model control.Meanwhile,PDS-C elevated the percentages of Th2 cells and Treg cells,but decreased the percentage of Th1 cells,as well as upregulated the GATA-3,FOXP3 and down-regulated the T-bet protein levels.ConclusionPDS-C possesses the activities of promoting hematopoiesis obviously.It can improve marrow myelosuppression,enhance the recovery of hematopoiestic function,and elevate the peripheral blood cells counts.PDS-C also pays its immunoregulatory efficacy though recovering from unbalanced Th1/Th2/Treg cells in treating immune mediated AA mice.
Key words:panaxdiol saponins component; aplastic anemia; immune regulation; T cell subsets; mice; experimental studies
作者简介:郑智茵(1960-),女,博士,硕士生导师,主任医师,研究方向:中西医结合防治血液病,Tel: 0571-87071625,Fax: 0571-87911040,E-mail: z05z01y08@ aliyun.com;高瑞兰(1952-),女,硕士,博士生导师,研究员,研究方向:血液病新药的研发,Tel: 0571-87071625,Fax: 0571-87911040,E-mail: gaoruilan@126.com
基金项目:国家自然科学基金资助项目(No 81373876) ;浙江省科技计划项目(No 2010C33098)
收稿日期:2015-03-23,修回日期:2015-04-17
文献标志码:A
文章编号:1001-1978(2015) 06-0790-06中国图书分类号: R-332; R284.1; R392.1; R556.502
doi:10.3969/j.issn.1001-1978.2015.06.011

