BMS-345541对急性粒细胞白血病细胞DNA损伤修复的影响
田 崛,陈显凌,庄英婷,范莹娟,许建华,吴丽贤
(1.福建医科大学药学院药理系,福建福州 350004;2.福建省天然药物药理学重点实验室,福建福州 350004; 3.福建医科大学新药研究所,福建福州 350004;4.福建医科大学附属协和医院血液科,福建福州 350001; 5.福建省血液病研究所,福建福州 350001)
BMS-345541对急性粒细胞白血病细胞DNA损伤修复的影响
田崛1,2,3,陈显凌4,5,庄英婷1,2,3,范莹娟1,2,3,许建华1,2,3,吴丽贤1,2,3
(1.福建医科大学药学院药理系,福建福州350004;2.福建省天然药物药理学重点实验室,福建福州350004; 3.福建医科大学新药研究所,福建福州350004;4.福建医科大学附属协和医院血液科,福建福州350001; 5.福建省血液病研究所,福建福州350001)
摘要:目的体外研究BMS-345541对急性粒细胞白血病(AML)细胞DNA损伤修复的影响及其可能的作用机制。方法MTT法检测VP-16作用于AML细胞,加入或不加入BMS-345541对该细胞增殖抑制的影响;流式细胞术检测BMS-345541对AML细胞DNA损伤修复、细胞周期阻滞和细胞凋亡的影响;高内涵观察不同处理组γ-H2AX、p-ATM、RAD51募集在断裂位点的焦点情况。结果联合用药组比单用VP-16组对细胞的增殖抑制作用强;流式检测加入BMS-345541组比不加入组的γ-H2AX比例高,且加入BMS-345541组能够抑制VP-16导致的AML细胞G2/M期阻滞,增加细胞的凋亡率;高内涵检测断裂位点的p-ATM及RAD51的荧光焦点,6 h后,加入BMS-345541组比修复组的焦点的平均荧光强度和平均荧光面积高。结论VP-16导致AML细胞产生DNA损伤,加入BMS-345541,能通过抑制HR通路来抑制细胞DNA损伤修复。
关键词:IKKβ; BMS-345541; DNA损伤;γ-H2AX; p-ATM; RAD51
当前临床治疗肿瘤常用的放射治疗及绝大多数抗肿瘤药物的共同作用机制是损伤DNA。损伤DNA的分子机制不尽相同,常见的DNA损伤类型有单链断裂(SSD),双链断裂(DSB),碱基损伤(base damage),群集病变(clustered lesions)。主要可以通过以下6条修复通路予以修复:同源重组(homologous recombination,HR),非同源末端连接(non-homologous end-joining,NHEJ),碱基切除修复(base excision repair,BER),核苷酸切除修复(nucleotide excision repair,NER),错配修复(mismatch repair)和跨损伤修复(direct reversal)[1]。在DNA的损伤中,双链断裂是最严重的,主要通过HR和NHEJ进行修复。DNA修复能力异常激活和增强是导致肿瘤对DNA损伤剂耐药的重要分子基础;相反,修复缺陷则使肿瘤对其高度敏感。因此,寻找DNA修复抑制剂成为抗肿瘤研究领域的一项新热点。
IKKβ是IKK复合体中的一个催化亚基,通过经典途径激活核转录因子(NF-κB),在免疫应答、炎症反应过程中发挥重要作用[2]。经典的IKK/NF-κB的激活途径是: IKK磷酸化IκBα,磷酸化的IκBα被泛素化降解,释放游离的p65,与p50结合形成p65-p50的二聚体进入核内,结合到DNA的κB序列,启动下游的基因转录,介导细胞的增殖、转移、抗凋亡。最近的有研究表明:在乳腺癌、胃癌和宫颈癌细胞中,IKKβ与DNA双链损伤修复密切相关,且是非依赖于经典的IKKβ/NF-κB途径[3-4]。随后又证实抑制IKKβ可通过抑制HR修复来抑制乳腺癌细胞的DNA双链断裂修复[5]。
本课题使用的依托泊苷(VP-16)是鬼臼毒素的半合成衍生物,可诱导白血病细胞产生DNA双链损伤,临床上广泛用于治疗急性粒细胞白血病(AML)等恶性肿瘤。BMS-345541是IKKβ的新型选择性抑制剂[6]。研究显示,BMS-345541在体外和体内模型中,均可有效地抑制IKKβ活性,减少NF-κB及其调节的炎症因子的表达。本实验旨在探讨VP-16导致AML细胞产生DNA损伤后,用BMS-345541抑制IKKβ能否抑制细胞的DNA损伤修复进而增敏VP-16对AML的疗效。
1 材料与方法
1.1材料BMS-345541购于美国Selleck Chemicals公司,溶解于ddH2O中,配成储存液20 mmol· L-1于-20℃备用,使用前解冻,用培养液稀释成所需浓度。VP-16注射液购于齐鲁制药有限公司,浓度为34 mmol·L-1,使用前用培养液稀释成所需浓度。Hyclone RPMI1640培养基和Hyclone胎牛血清均购于Thermo Scientific。MTT[3-(4,5-二甲基噻唑-2) -2,5-二苯基四氮唑溴盐]购置于美国Sigma公司,用磷酸盐缓冲液(PBS)稀释成5 g·L-1存储液,小剂量分装,-20℃避光储存。γ-H2AX单克隆抗体购置于Cell Signaling Technology公司,p-ATM,RAD51单克隆抗体均购置于Abcam公司,羊抗兔IgG-HRP二抗购于凯基生物公司。DNA损伤试剂盒购于BD公司。流式凋亡检测试剂盒均购自瑞士Roche公司。RNA酶和碘化丙啶(PI)购于美国Sigma公司。酶标仪Microplate Reader 450购于美国BIO-RAD公司; BD FACSCantoⅡ流式细胞仪购于BD公司;高内涵购于Thermo Fisher公司。
1.2方法
1.2.1细胞培养HL-60细胞和KG1a细胞采用含0.1的胎牛血清RPMI 1640,青霉素(100 000 IU ·L-1)和链霉素(50 mg·L-1),在37℃、5 %的CO2孵育箱中培养,取对数生长期细胞用于实验。
1.2.2实验分组与处理实验分组如下:对照组: RPMI 1640培养基;损伤组: VP-16处理2 h;修复组: VP-16处理细胞2 h后洗掉药物继续培养6 h;联合用药组: VP-16处理2 h后洗掉药物加入BMS-345541继续培养6 h; BMS组: BMS-345541处理组(6 h)。
1.2.3MTT法检测药物对细胞的增殖抑制作用
取对数生长期的白血病细胞HL-60和KG1a,按5× 107·L-1接种于96孔培养板中,每孔180 μL。实验组分别加入不同浓度的药物20 μL,对照组不加药物,另设背景对照,每组设3个平行孔,37℃培养24 h。加入5 g·L-1的MTT溶液,每孔20 μL,继续培养4 h后,离心弃上清,加入150 μL DMSO,微量振荡仪振荡10 min,立即用酶标仪在570 nm波长处测吸光度(OD值)。根据吸光度计算细胞生长抑制率[细胞生长抑制率/%=(对照组OD-实验组OD)/对照组OD×100%]。以药物浓度为横轴,抑制率值为纵轴绘制细胞增殖抑制量效关系曲线。
1.2.4流式检测细胞DNA损伤的情况取对数生长期HL-60细胞,按分组要求用药物处理后,收集细胞,以800 r·min-1离心5 min,弃上清,PBS洗涤,固定,破膜,DNase处理1 h,加入anti-H2AX荧光探针室温孵育20 min(按DNA损伤试剂盒说明书操作)。转入到流式管中,上机检测。
1.2.5碘化丙啶染色法检测细胞周期的步骤取对数生长期的HL-60细胞,计数,调整细胞最终浓度为4×108·L-1,每孔2 mL,接种到6孔板中,按分组要求加药处理后,收集细胞,800 r·min-1,离心5 min。用PBS洗涤细胞1次,收集细胞,用0.1 mL PBS重悬。取1 mL预冷的体积分数为0.75的乙醇,将0.1 mL的细胞液缓慢地加入其中,轻轻混匀。4℃放置冷却后,转移到-20℃冰箱中放置24 h以上。待检测时,离心弃去乙醇,用PBS洗涤1次,加入PI染色液(50 mg·L-1) 0.1 mL,加入RNA酶,使其终浓度为50 mg·L-1。室温避光染色30 min后转移入流式管中,4℃避光,冰上保存,并在流式细胞仪上检测。
1.2.6Annxin-V-FITC/PI双染法检测细胞凋亡实验步骤取对数生长期的HL-60细胞,计数,调整细胞最终浓度为4×108·L-1,每孔2 mL,接种到6孔板中,按分组要求加药处理后,收集细胞,800 r· min-1,离心5 min。用PBS洗涤细胞两次,收集细胞。加入500 mL的Binding Buffer重悬细胞。每组中加入5 μL的Annxin-V-FITC混匀后,再加入5 μL 的PI,混匀。室温避光反应15 min。转移入流式管中,4℃避光,冰上保存,流式细胞仪检测。
1.2.7高内涵检测γ-H2AX、p-ATM、RAD51在断裂位点的聚集情况取对数生长期的HL-60细胞,计数,调整细胞最终浓度为4×108·L-1,每孔8 mL,接种到大培养皿中,加药处理后,收集细胞,800 r·min-1,离心5 min。用PBS洗涤细胞两次,收集细胞,固定,破膜,封闭,一抗孵育过夜,PBS洗涤3次,二抗避光孵育30 min,PBS洗涤3次,加DAPI避光孵育15 min,洗涤后用PBS重悬,调整细胞浓度为2×108·L-1,每孔0.1 mL,接种到96孔板中,平板离心机1 000 r·min-1,离心5 min。上机检测。
2 结果
2.1联合用药组比单药组对AML细胞的增殖抑制作用强单药组:用不同浓度的VP-16处理HL-60和KG1a细胞;联合用药组:用VP-16处理细胞2 h后洗掉药物,再加入不同浓度的BMS-345541。24 h后,MTT法检测,结果采用GraphPad Prism 5软件分析,可以明显看出联合用药组的抑制率比单药组的抑制率高(Fig 1)。

Fig 1 Proliferation inhibition of HL-60 and KG1a with BMS-345541 and VP-16 treatments
2.2AML细胞产生DNA损伤后,BMS-345541可抑制其DNA损伤修复H2AX的磷酸化是DSBs发生后最早期的事件之一,损伤发生后几分钟,细胞核内就能检测到散在的γ-H2AX。目前,γ-H2AX的水平已经成为公认的DSBs发生早期的标志[7]。不同处理组处理HL-60细胞,流式检测γ-H2AX的比例(Fig 2),高内涵检测各组γ-H2AX焦点的平均荧光面积和平均荧光强度(Fig 3)。对比高内涵和流式结果可知,对照组γ-H2AX的比例极少,VP-16处理细胞2 h的损伤组含量最多,而修复6 h后,其比例下降,DNA损伤减少,联合用药组γ-H2AX的含量比修复组高,且差异有显著性(P<0.01)。提示: AML细胞产生DNA损伤后,BMS-345541可抑制其DNA损伤修复。
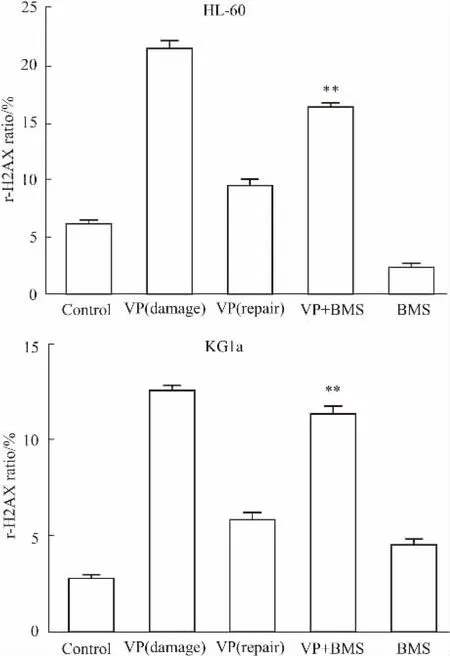
Fig 2 FCM tested effect of BMS-345541 onrepair of DNA DSBs in AML cells
2.3BMS-345541抑制DNA损伤修复与p-ATM的关系用高内涵检测断裂位点p-ATM的焦点情况,由高内涵所得数据可知(Fig 4) :联合用药组的p-ATM焦点的平均荧光面积和平均荧光强度比修复组高(P<0.01) ;由高内涵所得图片可知:联合用药组的红色荧光(p-ATM)比修复组高(P<0.01)。说明: VP-16作用于AML细胞后产生DNA损伤,BMS-345541抑制其DNA损伤修复可使断裂位点p-ATM焦点增多,使其停留在DNA损伤应答阶段。
2.4AML细胞产生DNA损伤后,BMS-345541抑制细胞G2/M期阻滞,增加细胞凋亡不同组处理HL-60细胞,PI染色流式细胞术检测细胞周期,结果显示: VP-16作用于AML细胞后会导致其产生G2/M期阻滞,加入BMS-345541后,随着其药物浓度的增加,G2/M期阻滞逐渐变弱。且呈剂量依赖性关系。PI和Annexin V-FITC双染流式细胞术检测细胞凋亡,结果提示:联合用药组与VP-16组比凋亡率高(P<0.05)。
2.5BMS-345541抑制DNA损伤修复与RAD51的关系同源重组修复是最重要的修复机制之一,主要在S期和G2后期被激活[8]。而RAD51是同源重组修复的中心分子,主要催化断裂的DNA双链与完整的同源DNA姐妹链进行链间转移置换[9]。当DNA出现双链断裂时,RAD51蛋白的表达增高,并在断裂位点募集形成多个核灶区。用高内涵检测断裂位点RAD51的焦点情况,由各组焦点的平均荧光面积和平均荧光强度可知(Fig 6) :联合用药组的RAD51焦点比修复组多(P<0.01)。说明: AML细胞产生DNA损伤后,加入BMS-345541组,RAD51焦点在断裂位点的聚集未能散去而持续存在,说明细胞停留在DNA损伤应答阶段,HR通路被抑制,从而抑制细胞DNA损伤修复。

Fig 3 HCA tested the effect of BMS-345541 on repair of DNA DSBs in AML cells

Fig 4 Relationship between p-ATM and BMS-345541 inhibited repair of DNA DSBs

Fig 5 BMS-345541 inhibite?d cell cycle G2/M phase arrest and increased apoptosis ratio
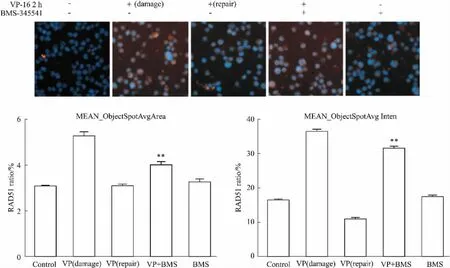
Fig 6 Relationship between RAD51 and BMS-345541 inhibited the repair of DNA DSBs
3 讨论
AML是一类造血干细胞异常的克隆性恶性疾病,其克隆中的白血病细胞失去进一步分化成熟的能力而停滞在细胞发育的不同阶段。白血病细胞在骨髓和其他造血组织中大量增生、积聚,并浸润其他器官和组织,同时使正常造血受到抑制,临床表现为出血、贫血、感染及各器官浸润症状。其临床治疗,仍然采用传统的细胞毒药物,大部分在接受化疗后病情会缓解,但停药后易复发。而DNA修复能力的异常激活和增强是导致肿瘤对DNA损伤剂耐药的重要分子基础,所以,寻找DNA损伤修复抑制剂成为抗肿瘤研究领域的一项新的热点。
本研究发现,VP-16导致AML细胞产生DNA损伤,若不加入BMS-345541,则细胞将进行自我修复,6 h后γ-H2AX、p-ATM、RAD51在断裂位点的焦点逐渐散去,修复基本完成;而加入BMS-345541抑制IKKβ后,断裂位点的γ-H2AX、p-ATM、RAD51焦点持续存在,与修复组比差异有显著性,说明DNA损伤修复被抑制。
ATM作为DNA损伤信号传导通路中最早的传感和中枢调控基因,当DNA损伤时,信号传导通路中的上游基因ATM能够感受DNA损伤信号,在每个断裂部位产生大量的p-ATM。DNA损伤修复分为两部分: DNA损伤应答和DNA损伤修复。当联合用药组p-ATM在断裂位点的焦点增多说明DNA损伤信号持续高表达,处于DNA损伤应答阶段,DNA损伤未被修复。同源重组修复是DNA双链损伤的主要修复方式,对于保持哺乳动物细胞的基因组完整性十分重要[10]。已有研究指出,与正常的细胞相比较,肿瘤细胞可以优先依赖HR通路修复DNA双链断裂[11]。RAD51是HR的中心分子,它参与DNA损伤感应和细胞周期关卡的复杂信号通路。若细胞完成修复(如修复组),RAD51在断裂位点的聚集将解散,而持续存在则说明细胞始终停留在DNA损伤的应答阶段,未进行DNA损伤修复。HR通路被抑制。
细胞在遭受DNA损伤时,会激活DNA损伤应答反应,如使损伤细胞周期发生阻滞为细胞启动DNA损伤修复提供时间。从本实验数据可以看出,VP-16作用于AML细胞产生DNA损伤后,周期阻滞在G2/M期,而当加入IKKβ抑制剂BMS-345541后,随着药物浓度的增加,G2/M期的阻滞逐渐被抑制,从而使损伤细胞没有足够的时间进行DNA损伤修复。然而,HR修复主要在S期和G2后期被激活,G2/M期阻滞抑制也使HR修复不能被激活。流式细胞术检测凋亡也显示IKKβ抑制后,能增加VP-16对AML的敏感性,使其凋亡率增高。
4 结论
VP-16导致AML细胞产生DNA损伤后,加入BMS-345541,通过抑制HR通路抑制细胞DNA损伤修复。
(致谢:本实验在福建省天然药物药理学重点实验室、福建医科大学新药研究所完成。)
参考文献:
[1]Aziz K,Nowsheen S,Pantelias G,et al.Targeting DNA damage and repair: embracing the pharmacological era for successful cancer therapy[J].Pharmacol Ther,133(3) : 334-50.
[2]王晓璐,方玉春,李静.IKKβ结构与功能及其抑制剂研究进展[J].中国药理学通报,2012,28(2) :158-61.
[2]Wang X,Fang Y,Li J.On structure and functions of IκB kinaseβ and development of its inhibitors[J].Chin Pharmacol Bull,2012,28(2) :158-61.
[3]Wu L,Shao L,An N,et al.IKKb Regulates the repair of DNA double-strand breaks induced by ionizing radiation in MCF-7 breast cancer cells[J].PLoS ONE,2011,6(4) : e18447.
[4]Sakamoto K,Hikiba Y,Nakagawa H,et al.Promotion of DNA repair by nuclear IKKb phosphorylationof ATM in response to genotoxic stimuli[J].Oncogene,(2013) 32,1854-62.
[5]Wu L,Shao L,Li M,et al.BMS-345541 sensitizes MCF-7 breast cancer cells to ionizing radiation by selective inhibition of homologous recombinational repair of DNA double-strand breaks[J].Radiat Res,2013,179(2) :160-70.
[6]Burke J R,Pattoli M A,Gregor K R,et al.BMS-345541 is a highly selective inhibitor of I kappa B kinase that binds at an allosteric site of the enzyme and blocks NF-kappa B-dependent transcription in mice[J].J Biol Chem,2003,278:1450-6.
[7]Zhang T,Tan Y,Zhao R,Liu Z.DNA damage induced by oridonin involves cell cycle arrest at G2/M phase in human MCF-7 cells [J].Wspolczesna Onkol,2013,17(38-44) :10.5114.
[8]Rothkamm K,Kruger I,Thompson L H,Lobrich M.Pathways of DNA double-strand break repair during the mammalian cell cycle [J].Mol Cell Biol,2003,23:5706-15.
[9]彭亚婷,梅金红.RAD51与肿瘤关系的研究进展[J].临床与实验病理学杂志,2011,27(1) :86-9.
[9]Peng Y T,Mei J H.Advances of the relationship between RAD51 and cancer research[J].Chin J Clin Exp Pathol,2011,27(1) :86 -9.
[10]Valerie K,Povirk L F.Regulation and mechanisms of mammalian double-strand break repair[J].Oncogene,2003,22:5792-812.
[11]Yang J,Amiri K I,Burke J R,et al.BMS-345541 targets inhibitor of kappaB kinase and induces apoptosis in melanoma: involvement of nuclear factor kappaB and mitochondria pathways[J].Clin Cancer Res,2006,12:950-60.
BMS-345541 regulates repair of DNA double-strand breaks induced by VP-16 in acute myeloid leukemia cells
TIAN Jue1,2,3,CHEN Xian-ling4,5,ZHUANG Ying-ting1,2,3,FAN Ying-juan1,2,3,XU Jian-hua1,2,3,WU Li-xian1,2,3
(1.Dept of Pharmacology,Fujian Medical University,Fuzhou 350004,China; 2.Key Laboratory of Natural Drug Pharmacology in Fujian Province,Fuzhou 350004,China; 3.Institute of Material Medica,Fujian Medical University,Fuzhou 350004,China;4.Dept of Hematology,Fujian Medical University Union Hospital,Fuzhou 350001,China;5.Institute of Hematology in Fujian Province,Fuzhou 350001,China)
Abstract:AimTo investigate the effect of BMS-345541 on the repair of DNA DSBs induced by VP-16 in AML cells and its possible mechanism.Methods The effects of BMS-345541 on the sensitivity of AML cells to VP-16 were determined by MTT.Flow cytometry (FCM) was applied to test the level of DNA damage,cell cycle progression and apoptosis in AML cells.High content analysis (HCA) was used to verify the amount of γ-H2AX,p-ATM,RAD51 in AML cells.ResultsBMS-345541 could significantly inhibit the proliferation of AML cells induced by VP-16.BMS-345541increased the amount of RAD51 foci and p-ATM foci in AML cells treated with VP-16 after 6 hours,which led to increased numbers of cells in the G2/M phases of the cell cycle,then induced apoptotic cell death.Conclusion BMS-345541 sensitizes AML cells to VP-16 via selective inhibition of homologous recombinational repair of DNA double-strand breaks.
Key words:IKKβ; BMS-345541; DNA damage;γ-H2AX; p-ATM; RAD51
作者简介:田崛(1990-),女,硕士生,研究方向:肿瘤药理学,E-mail: amyjue628@163.com;陈显凌(1980-),男,博士,主治医师,研究方向:血液学,共同第一作者,E-mail:315561399@ qq.com;吴丽贤(1975-),女,博士,副教授,博士生导师,研究方向:肿瘤药理学,通讯作者,E-mail: 18259000966 @ 126.com
基金项目:国家自然科学基金资助项目(No 30901824,81173096,81273541) ;福建省自然科学基金杰出青年项目(No 2011J06013) ;福建省高校跨世纪优秀人才项目(No JA11101)
收稿日期:2015-01-30,修回日期:2015-03-10
文献标志码:A
文章编号:1001-1978(2015) 06-0763-07中国图书分类号: R329.24; R329.25; R329.28; R342.3; R733.720.22
doi:10.3969/j.issn.1001-1978.2015.06.006

