稳定期慢性阻塞性肺疾病患者认知功能的相关因素研究
杨莉蓉,李贱,魏慧梅
(峨眉山市人民医院,四川 峨眉山614200)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以不完全可逆的气流受限为特征的慢性呼吸道疾病,常呈进行性发展,可分为急性加重期和稳定期。随着环境污染的加重以及人口老龄化,我国COPD的发病率呈逐年上升的趋势。随着对COPD的研究不断深入,目前认为COPD不仅累及呼吸系统,引起肺功能降低,还累及中枢神经系统,影响患者的认知功能、心理健康等[1]。既往研究[2]证实COPD急性期可合并肺性脑病,引起精神障碍,但较少研究关注稳定期COPD患者的认知功能损害及其相关因素,对其机制也不完全明确。本研究通过蒙特利尔认知评估量表(montreal cognitiveassessment,MoCA)评价稳定期COPD患者的认知功能,并分析MoCA评分与其各临床指标的关系,旨在探讨影响患者认知功能的相关因素,为临床早期诊治提供参考依据。现将结果报道如下:
1 资料与方法
1.1 一般资料
选取2013年1月-2014年11月期间峨眉山市人民医院收治的128例稳定期COPD患者为病例组。纳入标准:①根据患者的临床表现、肺功能、血气分析及影响学结果确诊为COPD,符合其诊断标准;②处于COPD稳定期,距离上次急性加重时间≥3个月;③文化程度为小学及以上,意识清楚,视听功能正常,能配合完成神经心理测试;④同意纳入本研究,并签署知情同意书。排除标准:①既往有阿尔茨海默病(AD)、脑卒中、脑肿瘤、一氧化碳中毒等其他引起脑功能的疾病;②服药不稳定、滥用药物或吸毒者;③合并有严重的心、肝、肾功能不全或恶性肿瘤者;④合并有肺炎、哮喘、阻塞性睡眠呼吸暂停综合征等其他呼吸系统疾病;⑤合并糖尿病,并出现血管并发症;⑥与调查者交流障碍者。病例组128例,其中,男78例,女50例,年龄42~75岁,平均(62.3±7.6)岁,体重指数(BMI)为(22.5±2.0)kg/m2,受教育时间(9.2±3.3)年,吸烟指数(610±130)支/年。并选取同期来该院进行体检的75名健康成人为对照组。纳入标准:①肺功能、胸部X线片检查均正常;②能配合完成神经心理测试;③同意入组,并签署知情同意书。排除标准同病例组。对照组75例,其中男42例,女33例,年龄40~73岁,平均(60.9±6.8)岁,体重指数(BMI)为(22.2±1.8)kg/m2,受教育时间(9.7±3.0)年,吸烟指数(590±120)支/年。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 问卷调查 采用本研究自拟的一般情况调查表调查所有患者的性别、年龄、吸烟史、身高、体重、临床症状、体征、病程等一般情况,并计算BMI及标准体重,BMI=体重(Kg)/身高2(m2),然后据此分成2个亚组(>22 kg/m2及≤22 kg/m2)。采用MoCA量表中文版进行评价所有受试者的认知功能,MoCA量表包括视空间、执行功能、命名等8个认知领域,总分30分,若受教育年限≤12年则需在得分上加1分,≥26分视为正常[3]。并全程进行质量控制,调查前对调查员进行培训,使其熟练掌握问卷内容,明确调查的目的及意义;调查员在每次调查结束后都要核对签字并将问卷交给研究人员,研究人员对每份问卷都要进行检查,对明显逻辑不合理以及内容有缺漏的问卷要及时纠正,对调查对象重新进行核实;调查后,由双人对问卷进行数据录入,如果有问题应及时返回查找原因,确定数据输入无误。
1.2.2 辅助检查 在进行MoCA评分的当日对所有受试者进行肺功能检测,测定其FEV1、FVC,然后进行支气管舒张试验,让受试者吸入硫酸沙丁胺醇400μg,休息20min后再次检测肺功能。根据第1秒用力呼气量(FEV1)/用力肺活量(FVC)是否<70%诊断COPD,然后根据FEV1/预计值进行COPD严重程度分级,分为GOLDⅠ级(FEV1≥80%预计值)、GOLDⅡ级(50%≤FEV1<80%预计值)、GOLDⅢ级(30%≤FEV1<50%预计值)、Ⅳ级(FEV1<30%预计值)。对稳定期COPD患者在未吸氧的情况下,经桡动脉取血后采用罗氏Cobasb123血气分析仪进行血气分析,检测动脉血PaO2、Pa-CO2、SO2。采用焦虑自评量表(SAS)、抑郁自评量表(SDS)分别评价患者的焦虑、抑郁状况,两个量表均有20个条目(1~4分),总分乘以1.25后取整为标准分,正常人的标准分应≤50分,>50分的表示有焦虑和抑郁倾向,分数越高,倾向越重。
1.3 统计学处理
采用SPSS 17.0统计软件进行处理,定性资料采用χ2检验,定量资料以均数±标准差(±s)表示,两组比较采用t检验,多组比较先采用方差分析,然后采用SNK q检验进行两两比较,采用简单线性相关和多重线性回归探讨25(OH)D降低的危险因素及其与IR的关系,以P<0.05视为差异具有统计学意义。
2 结果
2.1 病例组和对照组的MoCA评分比较
病例组与对照组的MoCA评分分别为(23.7±4.7)分、(26.8±3.8)分,病例组的评分明显低于对照组,差异有统计学意义(t=4.856,P<0.05)。
2.2 病例组中各亚组的MoCA评分比较结果
年龄、吸烟指数、受教育时间、COPD严重程度、病程、PaO2、PaCO2、SO2、SAS及SDS评分的各亚组的MoCA评分比较,差异有统计学意义(P<0.05)。在COPD严重程度方面,GOLDⅠ级的MoCA评分与GOLDⅡ级相比,差异无统计学意义(P>0.05),GOLDⅡ级的MoCA评分显著高于GOLDⅢ级,Ⅲ级的MoCA评分显著高于GOLDⅣ级,差异有统计学意义(P<0.05)。详见表1。
表1 病例组中各亚组的MoCA评分比较结果 (±s)
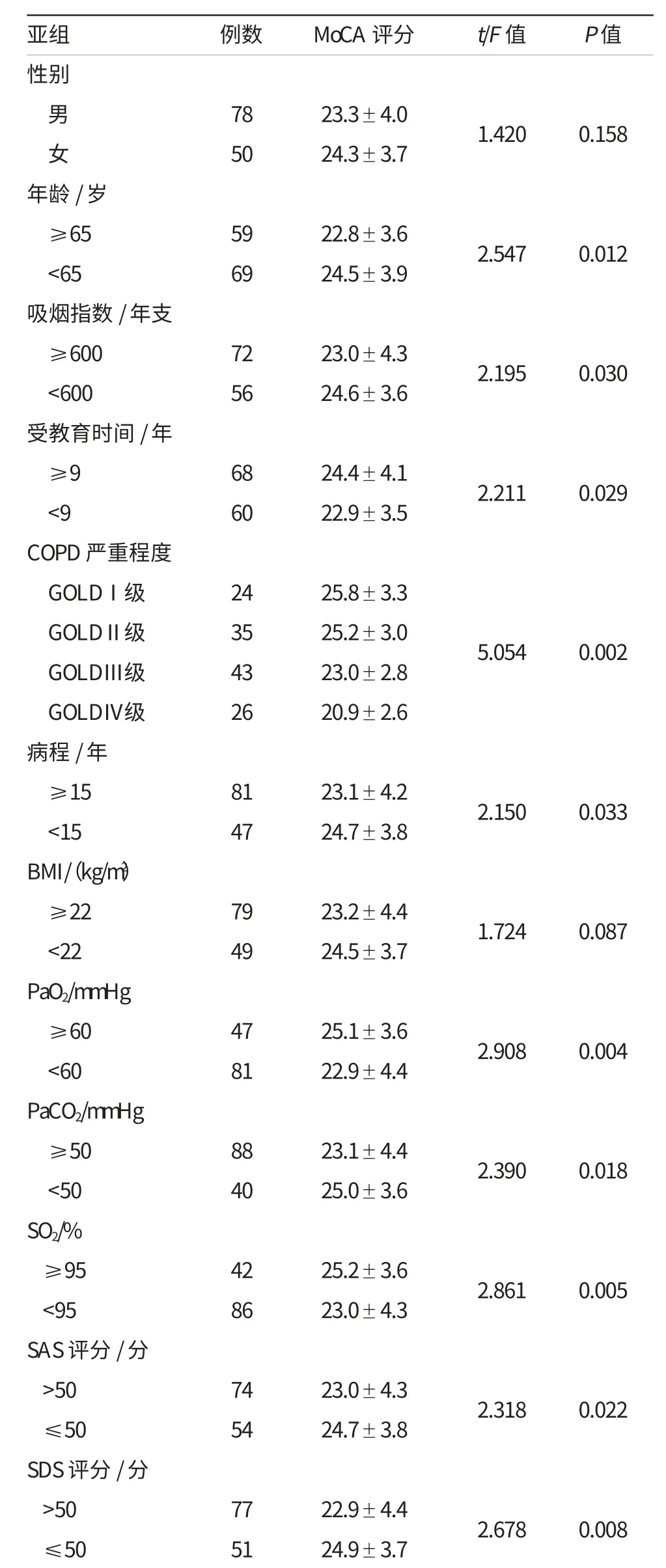
表1 病例组中各亚组的MoCA评分比较结果 (±s)
亚组 例数 MoCA评分 t/F值 P值性别男78 23.3±4.0 1.420 0.158女50 24.3±3.7年龄/岁≥65 59 22.8±3.6 2.547 0.012<65 69 24.5±3.9吸烟指数/年支≥600 72 23.0±4.3 2.195 0.030<600 56 24.6±3.6受教育时间/年≥9 68 24.4±4.1 2.211 0.029<9 60 22.9±3.5 COPD严重程度GOLDⅠ级 24 25.8±3.3 GOLDⅡ级 35 25.2±3.0 GOLDⅢ级 43 23.0±2.8 GOLDⅣ级 26 20.9±2.6病程/年≥15 81 23.1±4.2 2.150 0.033<15 47 24.7±3.8 BMI/(kg/m2)≥22 79 23.2±4.4 1.724 0.087<22 49 24.5±3.7 PaO2/mmHg≥60 47 25.1±3.6 2.908 0.004<60 81 22.9±4.4 PaCO2/mmHg≥50 88 23.1±4.4 2.390 0.018<50 40 25.0±3.6 SO2/%≥95 42 25.2±3.6 2.861 0.005<95 86 23.0±4.3 SAS评分/分>50 74 23.0±4.3 2.318 0.022≤50 54 24.7±3.8 SDS评分/分>50 77 22.9±4.4 2.678 0.008≤50 51 24.9±3.7 5.054 0.002
2.3 病例组中MoCA评分与各因素的简单线性相关分析结果
将男性=0,女性=1进行赋值,GOLDⅠ级、GOLDⅡ级、GOLDⅢ级、GOLDⅣ级分别赋值为1、2、3、4分,进行简单线性相关分析。结果表明,MoCA评分与患者的受教育时间、PaO2、SO2成正相关,与年龄、吸烟指数、COPD严重程度、病程、PaCO2、SAS及SDS分成负相关(P<0.05)。详见表2。
2.4 病例组中MoCA评分与各因素的多重线性回归结果
采用逐步回归法进行多重线性回归,结果表明,年龄、COPD严重程度、PaO2、SO2及SDS评分最终进入模型,与MoCA评分有线性回归关系,其中MoCA评分与PaO2、SO2成正相关,与年龄、COPD严重程度、SDS评分负相关(P<0.05)。详见表3。
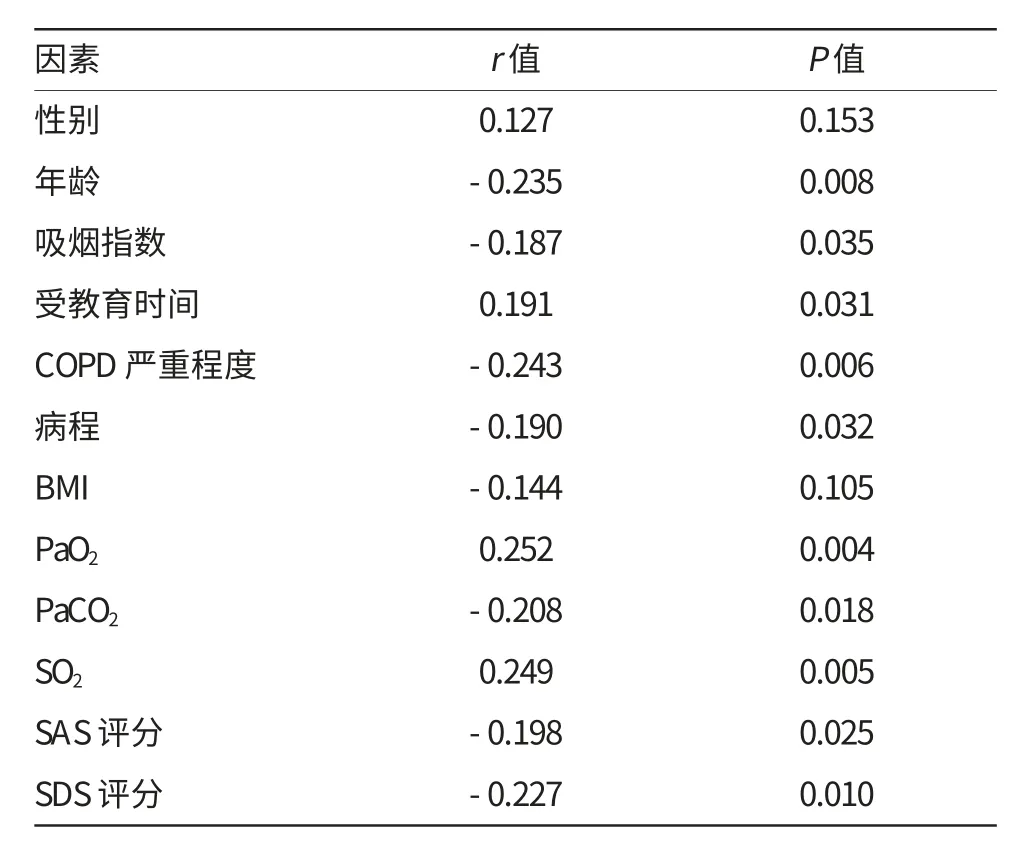
表2 病例组中MoCA评分与各因素的简单线性相关分析结果
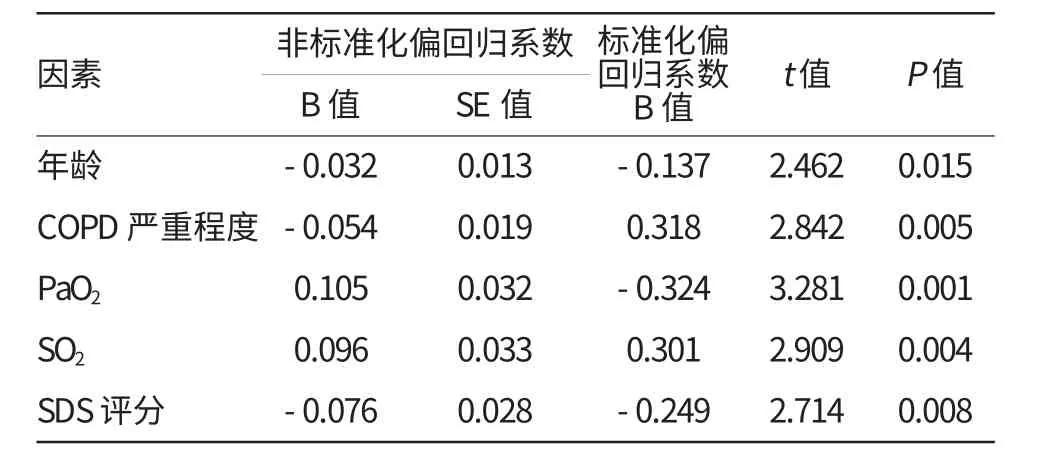
表3 病例组中MoCA评分与各因素的多重线性回归结果
3 讨论
近年来的多个研究均证实COPD不仅是呼吸系统疾病,也是能累及中枢神经系统的疾病,既往已有研究证实COPD急性加重期可导致严重缺氧和CO2潴留,引起肺性脑病,造成精神障碍,甚至危及生命。稳定期COPD同样可造成脑功能损害,引起认知功能降低,包括感知、记忆力、学习、运动、注意力、执行功能等方面的异常。目前机制尚不完全清楚,可能与下列因素有关:①COPD常因影响肺功能而引起低氧血症,慢性缺氧可降低脑血流灌注,常导致前额叶和顶叶的低血流灌注[4],国内有研究[5]报道COPD合并认知功能障碍患者的海马体积显著降低,海马结构的萎缩可能是引起认知受损的原因之一;②慢性缺氧可引起神经元损伤,影响神经递质合成中重要的氧依赖酶,降低了乙酰胆碱等神经递质的合成,从而影响了脑功能;③COPD患者的气道中IL-6、IL-8、TNF-α 等炎症介质进入血液循环中,引起全身的炎症反应,长期的炎症刺激可引起患者认知功能和精神情绪的变化[6-7]。由于稳定期COPD可导致患者出现轻度认知功能障碍(MCI),部分患者甚至发展为AD,严重影响患者的生活质量,故有必要研究COPD患者发生认知功能障碍的影响因素,对高危患者进行认知功能测试,早期发现MCI,并进行积极的诊治,改善其预后。
本研究采用MoCA量表评估稳定期COPD患者的认知功能,MoCA量表是加拿大NASREDDINE等学者参考简易精神智能评定量表(MMSE)的认知测评项目,并结合临床经验制定的,该量表较全面覆盖了执行功能、记忆、注意、计算力等多个认知领域,总分30分,<26分者视为异常,分数越低提示认知功能越差,并且该量表仅需10min左右即可完成测试,可对认知功能异常进行快速筛查,临床实用性较高。本研究选取了128例稳定COPD患者为病例组,并选择同期75例健康成人为对照组,两组一般资料方面差异无统计学意义(P>0.05),神经测试结果表明,病例组的MoCA评分为(23.7±4.7)分,高于钱红玉等人[8]报道的(20.6±2.3)分,这可能与本研究所纳入患者的年龄较低、COPD严重程度较低有关,本研究中病例组的MoCA评分明显低于对照组的评分(26.8±3.8),差异有统计学意义(P<0.05),与以往的研究结果一致[8]。故稳定期COPD患者的认知功能存在不同程度的降低。多元线性回归分析结果表明,年龄、COPD严重程度、PaO2、SO2及SDS评分与稳定期COPD患者MoCA评分密切相关(P<0.05)。
本研究根据年龄分为≥65岁和<65岁两个亚组,测试结果提示老年(≥65岁)患者的MoCA评分显著低于<65岁患者(P<0.05),MoCA评分与年龄成负相关(P<0.05),因此,年龄越大,患者的MoCA评分越低,认知功能损害越重。这可能是由于与中年患者相比,老年患者的心、肺、脑等各系统的功能均出现不同程度的降低,机体慢性缺氧的时间更长,而大脑的耐受性较差,疾病的损害更重。故临床上对老年COPD患者应重视其认知功能的评价,早期诊治MCI。本研究根据肺功能判断COPD严重程度,将患者分为GOLDⅠ~Ⅳ级,多重线性回归分析结果表明MoCA评分与COPD严重程度成负相关(P<0.05),故COPD患者的肺功能损伤越重,认知功能越差。因此,临床上可采用肺功能预测患者认知功能,对重度或极重度COPD患者应进行神经心理测试。但DODD等[9]的荟萃分析结果表明,肺功能不是一个预测COPD患者认知功能障碍的理想指标,可能是由于该研究较少包括中重度的COPD患者。本研究中GOLDⅠ级患者的MoCA评分与GOLDⅡ级相当,而GOLDⅡ级患者的评分高于GOLDⅢ级,而GOLDⅢ级患者的评分高于GOLDⅣ级,故与轻中度患者相比,重度、极重度患者的肺功能与认知功能的关联性可能更强,认知功能障碍更严重,建议临床上对重度和极重度患者进行神经心理学测试,早期诊治认知功能障碍。
本研究还对患者的血气分析结果及MoCA评分的关联性进行分析,结果表明,MoCA评分与PaO2、SO2成正相关(P<0.05),PaO2、SO2越小,认知功能损害越重,故低氧血症是影响稳定期COPD患者认知功能的重要指标,PaO2与SO2是预测其认知功能的理想指标,与以往的研究结果一致[10]。这可能是由于低氧血症引起脑部低血流灌注和神经元损伤,抑制乙酰胆碱的合成。虽然PaCO2≥50mmHg患者的MoCA评分明显低于<50mmHg患者,但PaCO2未进入多重线性回归的模型中,与以往研究[8]中结果不一致,PAREKH等[11]研究结果表明,PaCO2越低,患者的执行功能、记忆、注意力等功能越好。因此,PaCO2与认知功能的关系尚不完全清楚,不推荐临床作为COPD患者的认知功能的预测指标。此外,本研究中患者的MoCA评分与SDS评分成负相关(P<0.05),患者的抑郁表现越重,认知功能损伤越重。既往研究[12]证实抑郁是认知功能损害的独立危险因素及前驱症状,这可能是由于长期的抑郁情绪会严重抑制患者的精神活动,思维联想和决断较困难,出现不同程度的认知功能损害,甚至出现痴呆,并且抑郁情绪会显著减少患者与外界的沟通交流,使患者出现社会交流的功能障碍,与社会出现隔离,从而也可能影响其认知功能。因此,临床上对COPD患者除了进行常规的肺功能和血气分析检查外,还应该仔细采集病史,对存在抑郁表现的患者应进行认知功能的检测及干预。
综上所述,稳定期COPD患者存在不同程度的认知功能障碍,高龄、肺功能显著降低、低氧血症、抑郁表现是患者发生认知功能障碍的高危因素,应进行积极的早期诊治。但是本研究仍然存在不足之处,首先,虽然MoCA量表的可信度和实用性均较高,但单独采用一个量表不能完全、准确地判断患者的认知功能状况。其次,本研究为单中心研究,样本量较少,更可信的结果有待大样本、多中心的研究证实。
[1]王丽君,曾冬新,栾秀丽,等.慢性阻塞性肺疾病患者心理健康状况及其影响因素的分析研究[J].中国现代医学杂志,2014,24(29):62-66.
[2]顾新南,蒋建中.无创正压通气联合呼吸兴奋剂治疗慢性阻塞性肺疾病急性加重期合并轻中度肺性脑病的疗效分析[J].江苏医药,2012,38(21):2599-2600.
[3]DALRYMPLE-ALFORD JC,MACASKILL MR,NAKAS CT,et al.The MoCA:well-suited screen for cognitive impairment in Parkinson disease[J].Neurology,2010,75(19):1717-1725.
[4]KLEIN M,GAUGGEL S,SACHS G,et al.Impact of chronic obstructive pulmonary disease(COPD)on attention functions[J].Respir Med,2010,104(1):52-60.
[5]李静.慢性阻塞性肺疾病患者的认知功能评价及相关影响因素分析[D].安徽医科大学,2013.
[6]KERSUL AL,IGLESIAS A,RIOS A,et al.Molecular mechanisms of inflammation during exacerbations of chronic obstructive pulmonary disease[J].Arch Bronconeumol,2011,47(4):176-183.
[7]BARNES PJ,CELLI BR.Systemic manifestations and comorbidities of COPD[J].Eur Respir J,2009,33(5):1165-1185.
[8]钱红玉,林红英,李毅.稳定期慢性阻塞性肺疾病患者的认知功能评价及其影响因素[J].中华结核和呼吸杂志,2014,37(10):769-773.
[9]DODD JW,GETOV SV,JONES PW.Cognitive function in COPD[J].Eur Respir J,2010,35(4):913-922.
[10]THAKUR N,BLANC PD,JULIAN LJ,et al.COPD and cognitive impairment:the role of hypoxemia and oxygen therapy[J].Int J Chron Obstruct Pulmon Dis,2010,5:263-269.
[11]PAREKH PI,BLUMENTHAL JA,Babyak MA,et al.Gas exchange and exercise capacity affect neurocognitive performance in patients with lung disease[J].Psychosom Med,2005,67(3):425-432.
[12]HASSELBALCH BJ,KNORR U,HASSELBALCH SG,et al.The cumulative load of depressive illness is associated with cognitive function in the remitted state of unipolar depressive disorder[J].Eur Psychiatry,2013,28(6):349-355.

