我院药品不良反应监测与上报工作管理体系建立实践
沈冬梅,代晶
江西省九江市第一人民医院药学部,332000
为加强药品的上市后监管,规范药品不良反应报告和监测,及时、有效控制药品风险,保障公众用药安全,我国实行药品不良反应报告和监测管理[1]。随着我国医改政策的不断深人,医疗安全问题逐步得到社会的关注,患者用药安全问题已成为医疗机构持续改进的重点[2],医疗机构是用药主体,建立医疗机构药品不良反应监测与报告(ADR)体系是药品安全监管、促进合理用药、保护公众用药安全的重要保障。我院在药品不良反应监测与上报工作方面完善并实践了管理体系建设,本文就取得的经验和成效总结分析,以对医疗机构在药品不良反应监测与上报管理工作上提供参考。
1 药品不良反应监测与上报工作管理体系的建立
1.1 领导重视,设立专门机构院领导对药品不良反应监测与上报工作高度重视,在以院长为主任委员的药事管理与药物治疗学委员会下设立“不良反应管理小组”,组长是分管药学部的分管领导,副组长由医务处、药学部、护理部、院感组成,临床各科室负责人与各科室护长为组员,并设立全院不良反应专职人员,成立不良反应监测技术小组。
1.2 建立健全不良反应报告制度 加强我院药物不良反应监测与上报管理,推动我院药品不良反应(ADR)报告和监测工作的深入开展,提高我院药品不良反应报告和监测水平和ADR报表的数量和质量,切实加强各部门、科室药品安全性监测与上报工作,确保临床用药安全,我院下发了红头文《药物不良反应报告制度与程序》,明确了药品不良反应的定义:是指合格药品在正常用法用量下出现的与用药目的无关的或意外的有害反应。要求各药品使用相关科室设立药品不良反应监测联络员,负责本科室不良反应监测。明确药学部指定专人承办临床上报的药品不良反应报告表的分析鉴别与汇总工作,并定期做好季度和年度总结分析,负责向国家药品不良反应监测中心上报。药学部内设药品不良反应监测技术小组。强调医师、药师、护士相互配合对患者用药情况进行监测,重点监测非预期(新发现)的、严重的药物不良反应,有原始记录。发生严重药品不良反应或药害事件,要积极进行救治,做好医疗记录,保存好相关药品、物品的留样,并对事件进行及时的调查、分析,按规定上报卫生行政部门和药品监督管理部门。必须将患者发生的药品不良反应如实记入病历中[3]。
1.3 建立药品不良反应报告及处理流程 依照制度要求,我院制定了《药物不良反应报告及处理流程》,明确了各环节各部门的责任及任务,具体流程:发现患者发生疑似药品不良反应,责任护士或当班护士必须立即停止怀疑药品给药,报告给医生处置,同时在病区“药品不良反应登记本”上进行简要登记;医生在接到患者发生疑似药品不良反应报告后,必须停止怀疑药品给药并对症处理,积极进行临床救治,并将患者发生的药品不良反应、处置如实记入病历中;若为死亡病例、群体性事件,必须保存好相关药品、物品留样,并立即报告药学部不良反应监测技术小组。药学部及时向医院不良反应管理小组汇报,必要时及时报告给卫生行政部门和药品监督管理部门。医生在处置完患者后必须在内网电子病历系统中点击药物不良反应上报系统,及时填报“药品不良反应/事件报告”电子表,必填项不得缺项,关联性评价无法判断的,可电话联系责任区临床药师协助分析判断。药品不良反应专职监测员每天汇总信息系统中全院药品不良反应上报表,并认真核查原始病历,做出必要的分析评价后上报国家药品不良反应监测中心。
1.4 细化考核指标,建立奖惩制度 我院各部门对 ADR监测与上报工作高度重视,为调动临床各部门工作积极性, 制定了考核细则,将考核细化到医疗主诊组, 并且要求在注重数量的同时,又注重质量 。把考核结果与绩效挂钩,实行奖惩, 切实调动医务人员的积极性。明确绩效挂钩,奖惩到位的同时,每月进行全院通报。弄虚作假者,一经查实,加重处罚,并与年终评先评优挂钩。无故不参加全院药品不良反应知识培训的科室,处罚科室责任人。每月由医务处和药学部组成专家组对病历进行抽查,对出现药物不良反应未做病程记录中记录或未进行不良反应上报,依照制度执行奖惩。
1.5 纳入医疗质控体系 药学部每季度将不良反应上报表及该季度全院不良反应上报过程出现的典型问题汇总分析,并将本季度和上一季度、本季度和上一年同期的数据进行比对,拿出数据分析图并写出总结报告,上报给医院质量管理委员会,纳入全院医疗质控体系。
2 采取有效措施,落实ADR报告与监测
2.1 加强培训与宣教,强化依法监测上报意识,提高用药风险与责任意识。
对医务工作者来说,认为药品质量只要符合药品质量标准规定,政府允许生产企业上市流通的药品,政府部门集中招标采购的药品质量信任度高,对可能存在的从原料、生产、 储 存、运输、 使用等环节的安全风险欠缺考虑,对药品上市后的安全性监测还不能完全理解,不能准确把握ADR监测的重大意义,不清楚监测与上报药品不良反应是法律规定的职责,在医疗过程中缺失风险管理意识。医务处、药学部将法规要求,重大药物不良事件、三甲综合医院评审标准要求、ADR工作技术要求、院内规定列入全院药品不良反应系列培训课程,反复培训宣教。将药品不良反应知识列入新入院的员工药事管理培训内容。提高了全院医务工作者的用药风险与责任意识,提升了全院医务人员ADR监测上报综合水平。
2.2 创新管理,在电子病历中建立并完善了HIS系统同步的药品不良反应直报系统 临床医务工作任务重,患者出现药品不良反应时,医护人员常常因为找药品不良反应纸质报表、内容填写需调电子病历等原因上报主动性缺乏,为优化上报流程,便捷临床,药学部协调信息处,从医院电子病历管理软件改进着手,进行软件功能拓展,嵌入药品不良反应上报工作模块。当患者出现药品不良反应时,医生处置完患者后,在电子病程中记录不良反应后,即可在当前界面,点开“药品不良反应监测上报系统”,填报“药品不良反应、事件报告表”,患者姓名、性别,出生日期或年龄,民族、体重、联系方式、原患疾病、病历号等基础数据系统自动生成,不需要医生填写,解决了临床药品不良反应监测后,上报脱节的问题,增加了临床医护人员的依从性,实现了药品不良反应监测上报与诊疗活动的同步,实现了药品不良反应监测上报与实际发生数的同步,实现了药品不良反应监测报告与规范要求的同步。
2.3 临床药师分片区管理,责任到人 因临床药师人数制约,药学部将临床科室分片区管理,责任到人。临床药师每周必须深入责任科室,了解ADR情况,协助临床预防严重ADR病例的发生,参与ADR救治处置。负责本责任区的ADR报告因果关联性评定分析,对责任科室电子报表存在的问题及时沟通提醒。
2.4 建立并完善了多部门协作机制 ADR整体工作运行过程中,多部门协作非常重要,药学部负责ADR收集、汇总分析、评价、上报等具体事务与技术支持、培训,医务科牵头协调,统一指挥,负责抽调临床专家与药学专家组成质量评定专家组对病历进行抽查,负责对通报、处罚的科室进行谈话,负责执行公示、处罚决议。护士通常是临床药品不良反应发生的第一发现人,护理部负责临床护士对出现的药品不良反应监测,一旦出现必须立即汇报给医生,并做好记录。院感部门参与疑似药品不良反应出现时的关联性评价,以区分院内感染不良事件。
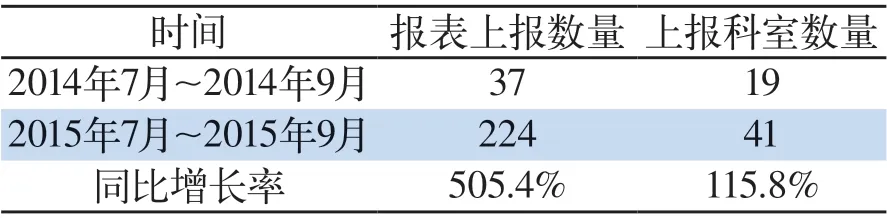
表 1 药品不良反应报告情况比对Tab 1 Reports of adverse drug reactions in comparison
3 成效
3.1 ADR报告数量与质量大幅提升 我院药品不良反应监测与上报管理体系的建立,及配套措施的落实,为我院不良反应监测报告工作奠定了扎实的基础,我院不良反应监测报告数量与质量均得到大幅提升,我院药品不良反应监测与报告管理体系自2015年7月正式运行,建立后至今(2015年7月~2015年9月)共上报不良反应报告224例,共41个科室上报,管理体系建立前的同期时间(2014年7月~2014年9月)共上报药品不良反应报告37例,共19个临床科室上报。数据显示上报表同比增长达505.4%,具体见药品不良反应报告情况比对(表1)。管理体系的建立,电子病历嵌入的药品不良反应直报系统的运行,显著提升了医务人员的上报意识,上报数量显著提升。电子病历嵌入的药品不良反应直报系统的运行,使得基础数据系统可以自动提取,避免了错误或空项。必填项系统设置了不得空项提醒,整体使药品不良反应报告质量得以提升,改观了原来报表缺项严重,未能很好的记录不良反应发生情况等质量问题。
3.2 院内药品风险意识、应对风险能力提升 我院药品不良反应监测与上报工作管理体系的建立,健全了医院应急管理体系。全体医务人员加强了药品风险意识,和药品使用过程中发现风险和处置风险的能力,药品风险信号可及时监测并分析警示。建立了《突发事件药事管理应急预案》,加强了应急培训与指导,提升应急处置能力。为减少或避免药害事件的发生,提高快捷高效地处理用药风险的能力,我院还制订了《药品召回管理制度及处置流程》,规定临床科室发现所用药品出现严重不良反应后,应及时上报,药学部应及时指派责任临床药师和药库工作人员前往相关临床科室现场查看情况,临床药师对药品不良反应进行分析、评价;必要时可暂停使用并封存。
4 总结
以保障人民群众用药安全有效为目的,以提高监测评价能力为重点,全面加强药品不良反应监测体系建设,保证公众用药安全,是我国政府为落实医药卫生体制改革相关要求,进一步完善药品不良反应报告和监测体系建设的指导思想[4]。医疗机构是药品不良反应报告和监测体系建设的重要基石,我院就如何构建医疗机构药品不良反应监测上报管理体系,优化工作流程,便捷医务人员上报工作,开展管理体系实践后,全院依规上报意识增强,ADR上报的及时性得以纠正,上报的数量与质量大幅度提升,药品安全风险预警和应急处置能力得以提升。但也存在诸多不足,比如新的、严重的药品不良反应报告数量占比较少,门诊患者药品不良反应监测方法的优化探索,监测数据分析评价能力及重点药物的重点监测等,还需进一步完善。医院药品不良反应报告和监测体系的建设是一个涉及全院多个部门的系统工程,需不断自我完善、自我提高,建立更加科学、高效的报告和监测体系。
[1] 卫生部.《药品不良反应报告和监测管理办法》卫生部令第81号. 2011.
[2] 熊代琴, 李东锋, 张茂慧, 等. 我院药品不良反应监测上报管理体系建设探讨[J].《新疆中医药》, 2015,33(2): 86-89.
[3] 卫生部.《三级综合医院评审标准(2011年版)》(卫医管发[2011]33号). 2011
[4] 国家食品药品监督管理局.《关于加强药品不良反应监测体系建设的指导意见》国食药监安[2011]466号. 2011.

