晚期非小细胞肺癌患者血清癌胚抗原水平和全身转移能力的风险评估*
李捷 李付广 常保萍 焦江琴
在我国肺癌是最常见的恶性肿瘤之一,可分为小细胞肺癌和非小细胞肺癌(Non-small cell lung cancer,NSCLC),其中非小细胞肺癌占80%以上,且其恶性程度高、预后差[1-2]。随着肺癌流行病学的变化,非鳞状细胞癌在相对年轻人群和不吸烟妇女中持续增加[3-4]。肺癌绝大部分是局部晚期或高级类型,但是其相关转移及进展的机制尚未阐明。近年来,有关肺癌肿瘤标志物的研究取得了一些进展,不仅对部分胸部影像和病理等检查难以确诊的可疑肺癌的诊断有一定帮助,而且对判断肺癌的治疗效果、预后及复发等情况也具有一定价值。研究表明,NSCLC患者的血清肿瘤标志物水平可以提供预后信息,在现有可利用的肿瘤标志物中,CEA是一个明确的和长期的肿瘤标志物,一直被广泛地用于临床实践中,有研究发现其与NSCLC患者的预后存在一定的相关性[5-6]。之前的研究对血清CEA在肺癌的临床有效性进行了重要探索,阐明了血清CEA用于诊断或治疗的作用[7-9]。确定了高血清CEA水平与IV期非小细胞肺癌脑转移的诊断时限显著相关[10]。但CEA在预测NSCLC患者全身转移能力的价值仍不十分明确,本研究旨在阐明晚期非小细胞肺癌患者血清癌胚抗原水平和全身转移能力的关系,为临床早期诊断和治疗提供参考。
1 资料与方法
1.1 一般资料 选取于2012年3月-2014年1月来本院治疗的初治IV期NSCLC患者160例为研究对象,诊断依据参照肺癌的诊断标准和第7版肺癌TNM分期诊断标准[11-12]。其中男86例,女74例,平均年龄(59.31±12.71)岁。研究指标包括年龄、身高、体重、性别、组织学分类、肿瘤分化、CEA水平、吸烟状况、骨转移、淋巴结转移、胸膜/积液转移、颈部转移、软组织转移、脑转移、全身转移得分及LN-调整全身转移得分。根据患者CEA水平将入组患者分为两组,正常组(CEA水平<5 ng/mL)和高水平组(CEA水平≥5 ng/mL)。完全告知患者这项研究的性质,所有入组患者均签署了知情同意书。
1.2 纳入标准 术后组织学或细胞学证实为IV期NSCLC;有详细的患者治疗前后血清CEA信息;进行全身代谢显像检查。
1.3 排除标准 术后组织学或细胞学证实为小细胞肺癌及继发性肺癌;术后组织学或细胞学证实为非IV期NSCLC;无患者治疗前后血清CEA信息;无全身转移性疾病;严重肝肾功能异常。
1.4 方法 所有患者均抽取清晨空腹血3 mL,离心分离血清,实验仪器为德国西门子CP全自动免疫化学发光仪,试剂选用德国西门子公司生产的原装配套试剂。经全自动免疫化学发光仪器自动检测,获得结果。全身代谢显像检查全身转移程度,包括整个胸腹CT检查或磁共振成像(MRI)、脑CT检查。对中枢神经系统转移的检测,优先进行大脑的核磁共振成像。脊柱MRI以精确地确定骨转移的区域。符合临床指征时进行胸腔或心包积液细胞学检查。对于反应性的区别或炎症的转移变化鉴别较难,因此,由经验丰富的核医学医师和放射科医师进行成像报告的解读。本研究参考Lee等[10]的方法对患者全身转移情况进行评估,包括全身转移得分及LN-调整全身转移得分,全身转移得分从1~6分,LN-调整全身转移得分从1~7分。
1.5 统计学处理 采用统计学软件SPSS 17.0进行分析,计量资料用(±s)表示,采用t检验,计数资料采用 字2检验或Fisher精确检验,采用单因素和多因素Logistic回归分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 入组患者的人口数据和肿瘤特征 患者年龄<65岁86例,≥65岁74例;身高(169.47±13.58)cm;体重(63.37±10.24)kg;男86例,女74例;组织学分类,腺癌114例,鳞状细胞癌32例,大细胞癌7例,其他7例;肿瘤高分化13例,中分化82例,低分化65例;CEA水平<5 ng/mL 72例,≥5 ng/mL 88例;吸烟53例;骨转移84例;淋巴结转移90例;胸膜/积液转移74例;颈部转移88例;软组织转移3例;脑转移48例;全身转移得分1分40例,2分47例,3分43例,4分21例,5分8例,6分1例;LN-调整全身转移得分1分8例,2分37例,3分48例,4分41例,5分17例,6分8例,7分1例。
2.2 不同CEA水平患者的临床参数和病理特征比较 不同CEA水平患者的性别、组织学分类、骨转移、淋巴结转移和脑转移比较差异具有统计学意义(P<0.05);而年龄、肿瘤分化、吸烟状况、胸膜/积液转移、颈部转移和软组织转移比较差异无统计学意义(P>0.05),见表1。

表1 不同CEA水平患者的临床参数和病理特征比较 例
2.3 高CEA水平组患者的多因素分析 将单因素分析中P<0.05的变量纳入多因素Logistic回归分析,结果表明组织学分类、骨转移和脑转移是影响患者高CEA水平的独立危险因素,见表2。
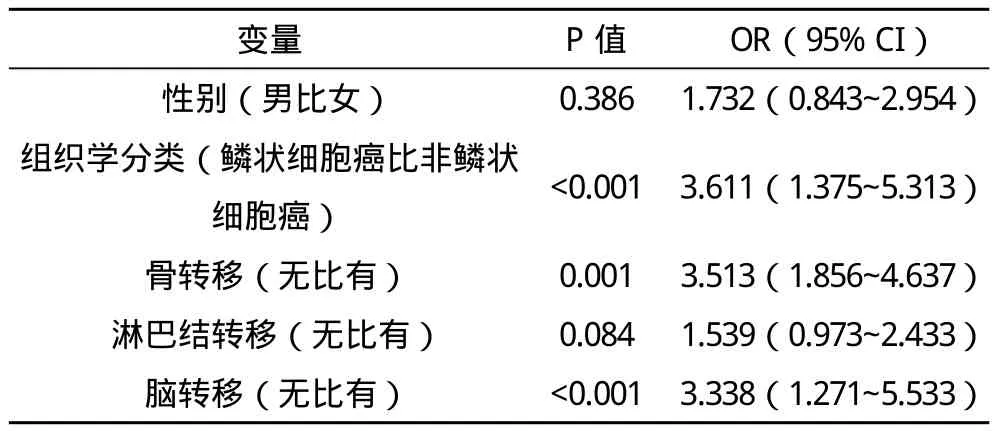
表2 高CEA水平患者多因素分析

表3 根据LN-调整全身转移得分的CEA水平比较 ng/mL
2.4 根据LN-调整全身转移得分的CEA水平比较 血清CEA水平从LN-调整全身转移得分1分中的2.7 ng/mL上升至LN-调整全身转移得分7分中的374.1 ng/mL(P=0.003)。低LN-调整全身转移得分(评分1~3分)与高LN-调整全身转移得分(评分4~7分)比较表现出CEA水平显著降低(P<0.001),见表3。
2.5 不同CEA水平组患者全身转移得分和LN调整全身转移得分的比较 血清高CEA水平的比例从全身转移得分1中占37.5%(15/40)上升至全身转移得分6中的100%(3/3)(P<0.001)。血清高 CEA水平的比例从LN-调整全身转移得分1中占25.0%(2/8)上升至LN-调整全身转移得分7中的100%(1/1)(P<0.001),见表4。
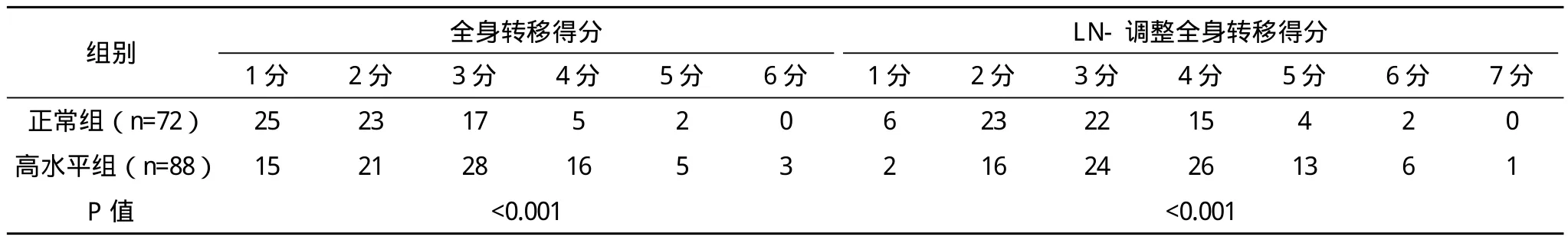
表4 两组不同CEA水平患者得分比较 例
3 讨论
肺癌为最常见恶性肿瘤之一,就诊时多为晚期,目前临床上常将肺癌分为NSCLC、小细胞肺癌(SCLC)两大类,其中以前者最为常见[13-14]。目前,诊断研究已成为研究热点。本研究表明,高血清CEA水平可能在非小细胞肺癌四阶段成为增加全身转移潜能的更好的替代标记。研究探讨了增加转移潜能的可能性与异常血清CEA水平的关系[15-16]。然而,尚无临床研究证实是否晚期非小细胞肺癌患者全身转移潜能与异常血清CEA水平相关。鉴于CEA的特征,癌症转移可以与增加的血清CEA水平有关,CEA的功能可能是作为一种黏附因子和趋化因子[17]。研究表明,CEA可以激活Kupffer细胞并刺激白介素-1、白细胞介素-6和肿瘤坏死因子-α,从而促进肿瘤细胞血管内皮细胞黏附诱导入侵的黏附分子,还可以促进肿瘤的转移[15-17]。目前的研究表明异常血清CEA水平增加肿瘤的转移潜能。
肿瘤转移程度分类是依据全身转移区域和转移总面积得分为基础,结果表明,不同CEA水平患者的性别、组织学分类、骨转移、淋巴结转移和脑转移比较差异具有统计学意义;而年龄、肿瘤分化、吸烟状况、胸膜/积液转移、颈部转移和软组织转移比较无统计学差异。血清CEA水平从LN-调整全身转移得分1分中的2.7 ng/mL上升至LN-调整全身转移得分7分中的374.1 ng/mL。低LN-调整全身转移得分(评分1~3分)与高LN-调整全身转移得分(评分4~7分)比较表现出CEA水平显著降低。血清高CEA水平的比例从全身转移得分1分中占37.5%上升至全身转移得分6中的100%。血清高CEA水平的比例从LN-调整全身转移得分1分中占25.0%上升至LN-调整全身转移得分7分中的100%。单因素分析结果表明,性别、组织学分类、骨转移、淋巴结转移和脑转移是影响患者高CEA水平的危险因素;多因素Logistic回归分析表明,组织学分类、骨转移和脑转移是影响患者高CEA水平的独立危险因素。
虽然有关血清CEA的预后和预测价值已有多项研究报道,几乎未见转移模式与血清CEA水平有关的研究。本研究的主要结论是高血清CEA水平可能在IV期非小细胞肺癌增加全身转移潜能,最初诊断作为可靠的指示性标志物。此外,对转移性淋巴结状态进行了评价,血清高CEA水平与骨转移、脑转移、淋巴结转移和肺转移显著相关。大量的最近研制的CEA肿瘤疫苗现在处于不同的发展阶段,需要进一步的研究,以确定这些疫苗在癌症治疗中的最终角色[6]。
综上,血清高CEA与晚期非小细胞肺癌全身转移潜能增加密切相关。升高的血清CEA水平更加频繁地在骨、脑、淋巴结和肺转移患者中发现。研究晚期非小细胞肺癌转移分布的流行病学具有重要价值,未来需进一步探讨血清CEA水平诊断肿瘤转移的安全性和有效性。
[1]许崇安,李琳,邢丽丽,等.血清癌胚抗原和cYFRA21-1预测晚期非小细胞肺癌患者化疗疗效及预后的价值研究[J].中国全科医学,2012,15(24):412-414.
[2]夏春伟,陈文萍,徐玲,等.血清CEA、CYFRA21-1与非小细胞肺癌化疗疗效及预后的临床研究[J].临床肺科杂志,2011,16(12):1900-1901.
[3] Janssen-Heijnen M L,Coebergh J W.The changing epidemiology of lung cancer in Europe[J].Lung Cancer,2003,41(3):245-258.
[4] Travis W D,Lubin J,Ries L,Devesa S.United States lung carcinoma incidence trends: declining for most histologic types among males, increasing among females[J].Cancer,1996,77(12):2464-2470.
[5] Trape J,Buxo J,Perez D,et al.Tumormarkers as prognostic factors in treated non-small cell lung cancer[J].Anticancer Res,2003,23(5b):4277-4281.
[6] Gameiro S R,Jammeh M L,Hodge J W.Cancer vaccines targeting carcinoem-bryonic antigen: state-of-the-art and future promise[J].Expert Rev Vaccines,2013,12(5):617-629.
[7] Arrieta Rodriguez O G,Villarreal-Garza C, Martinez-Barrera L,et al.Useful-ness of Serum Carcinoembryonic Antigen (CEA) in evaluating response to chemotherapy in patients with advanced non small-cell lung cancer: a prospective cohort study[J].BMC Cancer,2013,13(6):254.
[8] Lee S,Lee C Y,Kim D J,et al.Pathologic correlation of serum carcinoembryonic antigen and cytokeratin 19 fragment in resected nonsmall cell lung cancer[J].Korean J Thorac Cardiovasc Surg,2013,46(3):192-196.
[9] Horinouchi H,Sekine I,Sumi M,et al.Brain metastases after definitive concurrent chemoradiotherapy in patients with stage III lung adenocarcinoma:carcinoembryonic antigen as a potential predictive factor[J].Cancer Sci,2012,103(4):756-759.
[10] Lee D S,Kim Y S,Jung S L,et al.The relevance of serum carcinoembryonic antigen as an indicator of brain metastasis detection in advanced non-small cell lung cancer[J].Tumour Biol,2012,33(4):1065-1073.
[11]黄受方.国际肺癌研究协会/美国胸科学会/欧洲呼吸学会国际多学科肺腺癌分类(2011年版)解读[J].中华病理学杂志,2011,40(12):793-796.
[12]杨桂芬,朱虹.第7版肺癌TNM分期及影像学在其评估中的价值[J].放射学实践,2012,27(7):803-806.
[13]江峰,吕赛平,黄秀珍,等.非小细胞肺癌组织表达FOXM1与患者临床特征及术后辅助化疗疗效的关系研究[J].中国医学创新,2014,11(30):1-3.
[14]李真斌,陈轩,易向军.培美曲塞二钠或吉西他滨联合奈达铂治疗80例晚期非小细胞肺癌的临床比较研究[J].中国医学创新,2014,11(30):112-114.
[15] Beauchemin N,Arabzadeh A.Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis[J].Cancer Metastasis Rev,2013,32(3-4):643-671.
[16] Kuespert K,Pils S,Hauck C R.CEACAMs: their role in physiology and pathophysiology[J].Curr Opin Cell Biol,2006,18(5):565-71.
[17] Blumenthal R D,Hansen H J,Goldenberg D M.Inhibition of adhesion, invasion, and metastasis by antibodies targeting CEACAM6 (NCA-90) and CEACAM5 (Carcinoembryonic Antigen)[J].Cancer Res,2005,65(19):8809-8817.

