新型含吡唑基1,2,4-三唑衍生物的合成*
郑玉国, 郭晴晴, 王清河, 文 青, 周 莉, 张国义(兴义民族师范学院 绿色化学合成技术研究所 民族药用生物资源研究与开发实验室,贵州 兴义 562400)
·快递论文·
新型含吡唑基1,2,4-三唑衍生物的合成*
郑玉国, 郭晴晴, 王清河, 文 青, 周 莉, 张国义
(兴义民族师范学院 绿色化学合成技术研究所 民族药用生物资源研究与开发实验室,贵州 兴义 562400)
以1-苯基-3-甲基-5-吡唑啉酮为起始原料,经氯甲酰化、氧化、酯化、肼解、成盐及闭环反应制得4-氨基-5-(1-苯基-3-甲基-5-氯吡唑)-1,2,4-三唑-3-硫酮(6); 6与苯甲醛经缩合反应制得4-苯甲亚胺基-5-(5-氯-3-甲基-1-苯基)吡唑-4H-1,2,4-三唑-3-硫酮(7); 7与对硝基苄氯反应合成了2个新型含吡唑基1,2,4-三唑化合物,其结构经1H NMR, IR和元素分析表征。
吡唑啉酮; 1,2,4-三唑衍生物; 合成
1,2,4-三唑是易降解、毒性低、杀菌、杀虫、抗病毒和除草的农药活性基团,在农药领域具有良好的开发前景[1-8]。目前已开发出了三唑酮、氨唑草酮和三唑磷等数十个高效低毒的1,2,4-三唑农药品种。吡唑杂环化合物在植物体内具有良好的内吸传导性能,结构多样易于修饰。该类化合物显示出良好的生物活性,如具有止痛、抗炎、抗菌、抗肿瘤、调节植物生长、杀虫和抗病毒等药理活性[9-13]。目前已有呋吡菌胺、吡噻菌胺和吡虫酰胺等几十个吡唑药物已商品化。
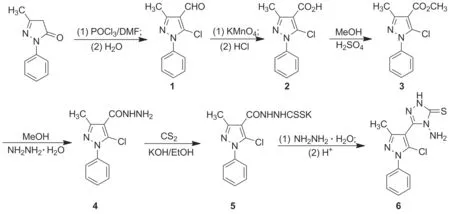

Scheme 1
本课题组[14-15]曾报道1,2,4-三唑类衍生物的合成,并对其生物活性进行了初步研究,取得了一定成果。在此基础上,本文以1-苯基-3-甲基-5-吡唑啉酮为起始原料,经氯甲酰化、氧化、酯化、肼解、成盐和闭环反应制得4-氨基-5-(1-苯基-3-甲基-5-氯吡唑)-1,2,4-三唑-3-硫酮(6); 6与苯甲醛经缩合反应制得4-苯甲亚胺基-5-(5-氯-3-甲基-1-苯基)吡唑-4H-1,2,4-三唑-3-硫酮(7); 7与对硝基苄氯反应合成了2个新型的含吡唑基1,2,4-三唑化合物——3-(4-硝基苯甲硫基)-N-苯次甲基-5-(5-氯-2-甲基-4-苯基吡唑)-4H-1,2,4-三唑-4-胺(8)和3-(5-氯-2-甲基-4-苯基吡唑)-6-苯基-7-(4-硝基苯基)-5H-1,2,4-三唑[3,4-b][1,3,4]噻二嗪(9)(Scheme 1),其结构经1H NMR, IR和元素分析表征。
1 实验部分
1.1 仪器与试剂
X-5型熔点仪(温度未校正);JEOL-ECX 400 Hz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);IR Prestige-21型红外光谱仪(KBr压片);Elementar Vario-Ⅲ型元素分析仪。
所用试剂均为分析纯。
1.2 合成
(1) 1的合成
在反应瓶中加入DMF 27 mL,搅拌下于0 ℃缓慢滴加POCl3153 g(1.0 mol ),滴毕,缓慢加入1-苯基-3-甲基-5-吡唑啉酮20.9 g(0.12 mol),加毕,于80 ℃反应5 h[TLC监测,展开剂:A=V(石油醚) ∶V(乙酸乙酯)=1 ∶1]。冷却至室温,缓慢倒入100 mL冰水中,静置2 h;抽滤,滤饼干燥,用无水乙醇重结晶得淡黄色固体3-甲基-1-苯基-5-氯-4-甲醛基吡唑(1),收率82%, m.p.142 ℃~144 ℃。
(2) 2的合成
在反应瓶中加入1 11.1 g(0.05 mol)和水100 mL,搅拌下于室温反应5 min;缓慢滴入KMnO411.85 g(0.075 mol)水(200 mL)溶液,滴毕,于70 ℃反应8 h(TLC检测,展开剂:A=1 ∶1)。冷却,用10%KOH溶液调至pH 10,过滤,滤液用浓盐酸酸化,抽滤,滤饼干燥,用甲醇重结晶得白色粉末3-甲基-1-苯基-5-氯-4-吡唑甲酸(2),收率93%, m.p.240 ℃~242 ℃。
(3) 3的合成
在反应瓶中加入2 118.5 g(0.5 mol)和无水甲醇250 mL,搅拌下于室温反应5 min;缓慢滴入浓硫酸10 mL,滴毕,回流反应8 h(TLC检测,展开剂:A=1 ∶1)。冷却,旋蒸脱溶,用饱和NaHCO3溶液洗涤(有白色固体析出),抽滤,滤饼用无水乙醇重结晶得白色针状晶体1-苯基-3-甲基-5-氯-4-吡唑甲酸甲酯(3),收率65.7%, m.p.179 ℃~180 ℃。
(4) 4的合成
在反应瓶中依次加入3 12.5 g(0.05 mol),无水甲醇10 mL和80%水合肼20 mL,搅拌下回流反应5 h(TLC检测,展开剂:A=1 ∶1)。冷却,抽滤得白色片状固体1-苯基-3-甲基-5-氯-4-吡唑酰肼(4),收率74.2%, m.p.164 ℃~166 ℃。
(5) 5的合成
在反应瓶中依次加入4 6.28 g(0.025 mol),无水乙醇200 mL和氢氧化钾1.4 g(0.025 mol),搅拌下于室温反应5 min;缓慢滴加二硫化碳2.28 g(0.030 mol),滴毕,反应12 h。抽滤,滤饼用无水乙醇洗涤,干燥得白色固体N-(1-苯基-3-甲基-5-氯)吡唑甲酰肼基二硫代甲酸钾(5),收率75.2%, m.p.>250 ℃。
(6) 6的合成
在反应瓶中加入5 3.65 g(0.010 mol)和80%水合肼30 mL,搅拌下回流反应2 h(TLC检测,展开剂:A=3 ∶1)。自然冷却至室温,过滤,滤液用10%盐酸调至中性(析出固体),抽滤,滤饼用水洗涤,干燥后用无水乙醇重结晶得白色粉末6,收率65.8%, m.p.266 ℃~268 ℃;1H NMRδ: 14.01(s, 1H, NH), 7.62~7.53(m, 5H, PhH), 5.65(s, 2H, NH2), 2.29(s, 3H, CH3); IRν: 3 436, 3 253, 3 064, 1 632, 1 596, 1 453, 1 363 cm-1; MSm/z: 307.18{[M+H]+}; Anal.calcd for C12H11N6SCl: C 46.98, H 3.61, N 27.39; found C 47.12, H 3.83, N 27.66。
(7) 7的合成
在反应瓶中依次加入无水乙醇30 mL, 6 3.07 g(0.010 mol)和苯甲醛1.27 g(0.012 mol),搅拌使其溶解;加入冰醋酸5滴,于65 ℃反应5 h(TLC检测,展开剂:A=5 ∶1)。冷却,抽滤,滤饼用水洗涤,干燥后用无水乙醇重结晶得白色片状固体7,收率72%, m.p. 215 ℃~217 ℃;1H NMRδ: 14.39(s, 1H, NH), 9.99(s, 1H, NCH), 7.86~7.50(m, 10H, PhH), 2.30(s, 3H, CH3); IRν: 3 108, 2 950, 2 550, 1 614, 1 601, 1 590, 1 560, 1 470, 1 372, 1 279, 822 cm-1; MSm/z: 395.22{[M+H]+}; Anal.calcd for C19H15N6SCl: C 57.79, H 3.83, N 21.28; found C 57.83, H 3.97, N 21.42。
(8) 8的合成
在反应瓶中依次加入DMF 2 mL和7 0.40 g(0.001 mol),搅拌使其溶解;依次加入蒸馏水30 mL和3%氢氧化钠水溶液10 mL,加毕,于室温反应10 min;加入对硝基氯化苄0.21 g(1.2 mmol),反应24 h(TLC检测,展开剂:A=1 ∶1)。分液,水相用乙酸乙酯(4×30 mL)萃取,合并萃取液,用无水MgSO4干燥,浓缩后经硅胶柱层析(洗脱剂:A=3 ∶1)纯化得白色粉末8,收率60.3%, m.p.172 ℃~174 ℃;1H NMRδ: 8.79(s, 1H, N=CH), 8.14(d,J=8.8 Hz, 2H, PhH), 7.76(d,J=8.8 Hz, 2H, PhH), 7.65~7.50(m, 10H, PhH), 4.56(s, 2H, SCH2), 2.27(s, 3H, CH3); IRν: 3 010, 2 931, 1 616, 1 589, 1 456, 1 436, 660 cm-1; Anal.calcd for C26H20N7O2SCl: C 58.92, H 3.80, N 18.50; found C 59.13, H 3.94, N 18.67。
(9) 9的合成
在反应瓶中依次加入7 0.40 g(1 mmol), DMF 50 mL和K2CO30.1 g(1 mmol),搅拌下加入对硝基氯化苄0.21 g(1.2 mmol),于100 ℃反应3 h(TLC检测,展开剂:A=1 ∶1)。过滤,滤液减压蒸馏,残余物经硅胶柱层析(洗脱剂:A=3 ∶1)纯化得白色片状固体9,收率67.2%, m.p.206 ℃~208 ℃;1H NMRδ: 8.10(d,J=8.8 Hz, 2H, PhH), 7.74(d,J=8.8 Hz, 2H, PhH), 7.57~7.23(m, 11H, PhH, NH), 5.25(d,J=10.4 Hz, 1H, SCH), 4.99(t,J=10.4 Hz, 1H, NCH), 2.27(s, 3H, CH3); IRν: 3 159, 3 004, 2 950, 1 590, 1 524, 1 483, 669 cm-1; Anal.calcd for C26H20N7O2SCl: C 58.92, H 3.80, N 18.50; found C 59.21, H 3.99, N 18.77。
2 结果与讨论
2.1 合成
1的合成通过Vilsmeier-Haack氯甲酰化反应引入醛基,POCl3既作为溶剂又作反应试剂。
在2的合成中,需缓慢逐滴滴加KMnO4水溶液,以防止反应放热温度急剧升高。
在4的合成中,需逐滴滴入80%水合肼,防止吡唑环5-Cl被NH2NH2取代,引起副反应发生。
在5的合成中,CS2需缓慢滴入,防止反应剧烈将吡唑苯甲酰肼包夹从而导致反应不完全。
在7的合成中,加入冰乙酸作为催化剂,提供适宜的H+,生成羰基盐正离子,更容易发生亲核加成反应。
7在NaOH水溶液中转化为亲核性更强的硫负离子,DMF作助溶剂,经亲核取代反应合成8。
以K2CO3为缚酸剂,DMF为溶剂,7与对硝基氯化苄发生亲核取代加成反应合成9。
8中NO2的强吸电子作用使得CH2变活泼,推测其在加热条件和K2CO3催化下,可与C=N双键发生分子内加成闭环转化为9。
2.2 表征
1H NMR分析表明,6转变为7后,NH2吸收峰消失,在低场(δ9.99)出现亚胺质子吸收峰。 7转变为8后,NH吸收峰消失,在δ4.56出现SCH2吸收峰;7转变为9后, N=CH吸收峰消失,在δ5.25处出现SCH质子吸收峰,其受N-CH偶合裂分为二重峰, 耦合常数为10.4 Hz;在δ4.99处出现N-CH质子吸收峰,与NH及SCH偶合表现为三重峰, 耦合常数10.4 Hz。
IR分析表明,6转变为7后,NH2伸缩振动吸收峰消失,出现C=N(1 614 cm-1)吸收峰。7转化为8和9后,新出现C-S-C伸缩振动强吸收峰。8中由于吡唑及三唑环的共轭效应,通过链传递致使C=N的电子云密度降低,因而向高场移动,在1 616 cm-1出现C=N特征峰,在660 cm-1处新出现C-S-C伸缩振动强吸收峰。9中,在669 cm-1处新出现C-S-C伸缩振动强吸收峰,N-H伸缩振动吸收峰出现在3 159 cm-1。
[1] 魏学,郑玉国,薛伟,等. 新型1,2,4-三唑并[3,4-b]-1,3,4-噻二唑类衍生物合成及抗病毒活性[J].合成化学,2010,18(5):595-598.
[2] 陈文彬,金桂玉.α-[(1H-1,2,4-三唑-1-基)甲基]-β-芳基-β-芳硫基取代苯丙醇的合成及生物活性研究[J].应用化学,2002,19(6):527-530.
[3] 鲍小平,熊启中,邹林波,等. 2-苄硫基-5-甲基-1,2,4-三唑并[1,5-a]嘧啶-7-氧乙酰腙类衍生物的合成及其抑菌活性[J].合成化学,2013,21(1):53-57.
[4] Li F L, Dai B, Song H B,etal. Synthesis,structure,and fungicidal activity of triorganotin (4H-1,2,4-triazol-4-yl)benzoates[J].Heteroat Chem,2009,20(7):411-417.
[5] Wang B L, Shi Y X, Ma Y,etal. Synthesis and biological activity of some novel trifluoromethyl-substituted 1,2,4-triazole and bis(1,2,4-triazole) Mannich bases containing piperazine rings[J].J Agric Food Chem,2010,58(23):5515-5522.
[6] Wang M H, Zhu R Z, Fan Z J,etal. Bitriazolyl acyclonucleosides synthesized via Huisgen reaction using internal alkynes show antiviral activity against tobacco mosaic virus[J].Bioorg Med Chem Lett,2011,21(1):354-357.
[7] 杜婕,杜海棠,桑维钧,等. 新型3-(3,4,5-三甲氧基苯基)-4-氨基-5-取代苄砜基-1,2,4-三唑的合成及其抑菌活性[J].合成化学,2014,22(4):485-488.
[8] 于赛男,李智超,胡英芝,等. 含三氟甲基和双希夫碱化合物的合成与表征[J].合成化学,2010,18(2):226-228.
[9] 杨金凤,陶晶,李炳奇,等. 芳基吡唑腙及其双杂环化合物的合成与抗菌活性[J].合成化学,2009,17(2):151-154.
[10] 刘新华,白林山,王世范,等. 5-(2-羟基苯基)-3-甲基吡唑酰胺衍生物的合成与杀菌活性[J].合成化学,2006,14(2):147-149.
[11] 闫启东,徐俊,徐峰,等. 1-[6-(3,5-二甲基-1H-吡唑-1-基)-1,2,4,5-四嗪-3-基]酰肼及其衍生物的合成与表征[J].合成化学,2011,19(6):709-713.
[12] 廖国辉,张阳,魏宁宁,等. 1-甲基-3-二氟甲基-4-吡唑酰胺类衍生物的合成及其抑菌活性[J].合成化学,2011,19(1):19-23.
[13] 王京,张磊,姚其正. 新型含1,3,4-噁二唑的吡唑类化合物的合成及其抗肿瘤活性[J].合成化学,2014,22(6):730-733.
[14] 郑玉国,魏学,郭晴晴,等. 双三唑席夫碱哒嗪酮衍生物合成及其生物活性[J].应用化学,2011,28(9):1028-1034.
[15] 郑玉国,薛伟,郭晴晴,等. 三唑席夫碱苯并吡喃酮衍生物合成及其抗病毒活性[J].合成化学,2012,20(3):316-319.
Synthesis of Novel 1,2,4-Triazolo Derivatives Containing Pyrazole Unit
ZHENG Yu-guo, GUO Qing-qing, WANG Qing-he, WEN Qing, ZHOU Li, ZHANG GUO-yi
(Institute of Green Chemistry-Synthesis Technology, Key Laboratory of Research and Development of Ethnomedicinal Biological Resources, Xingyi Normal University for Nationalities, Xingyi 562400, China)
4-Amino-5-(5-chloro-3-methyl-1-phenyl-1H-pyrazol-4-yl)-2H-1,2,4-triazole-3(4H)-thione(6) was afforded in six steps including chloromethylation, oxidation, esterification, hydrazidation, salt formation and cyclization from 3-methyl-1-phenyl-1H-pyrazol-5(4H)-one. 4-Benzylideneamino-5-(5-chloro-3-methyl-1-phenyl-1H-pyrazol-4-yl)-2H-1,2,4-triazole-3(4H)-thione(7) was then synthesized by condensation reaction of 6 with benzaldehyde. Two novel 1,2,4-triazolo derivatives containing pyrazole unit were synthesized by reaction of 7 with 1-(chloromethyl)-4-nitrobenzene. The structures were characterized by1H NMR, IR and elemental analysis.
pyrazolone; 1,2,4-triazolo derivative; synthesis
2015-02-09
贵州省教育厅自然科学研究项目(黔教科2010090); 贵州省高等学校教学质量与教学改革工程资助项目(黔教高发[2012]426号和[2013]446号); 黔西南州科技计划项目(2013-6)
郑玉国(1982-),男,汉族,山东寿光人,副教授,主要从事新农药的创制研究。 Tel.0859-3568054, E-mail: yuguobaolong@163.com
O621.3; O626
A
10.15952/j.cnki.cjsc.1005-1511.2015.08.0729

