基于ITS序列的梅花草属Parnassia L.系统发育初步研究
柏梦焱,李亚茹,朱琼洁,叶成超,刘硕然
(大理大学农学与生物科学学院,云南大理 671003)
梅花草属ParnassiaLinnaeus,1753根据P.palustris建立,是一类多年生草本植物,分布于北温带,主要分布于东亚和北美,极少数分布到欧洲及其他地区〔1-3〕。根据谷粹芝〔2〕、Gu和 Hultgård〔4〕的研究,中国分布有63种,其中49种为特有种,且集中分布于我国的西南部山区,该区是梅花草属的现代分布中心和分化中心。
梅花草属建立至今已有200多年的研究历史。长期以来该属的分类地位及其分类系统一直处于争议状态。根据形态学的研究,梅花草属处于一个难以确定的系统位置,系统分类差异大,或作为虎耳草科Saxifragaceae的一个亚科,即梅花草亚科Parnassioideae;或独立成一科,即梅花草科Parnassiaceae〔1,5-8〕。近几年来随着现代分子生物学的迅速发展,特别是PCR技术的运用及DNA测序方法的改进,大量分子序列数据的不断累积,越来越多的基因片段被获得并应用于系统发育的研究。特别是被子植物大系统的建立,关于梅花草属的系统位置的观点也趋于一致。Soltis等基于rbcL序列对广义虎耳草科Saxifragaceae的研究表明梅花草属与伯力木属Brexia关系密切〔9〕;Savolainen等基于atpB-rbcL序列片段的研究认为梅花草属与卫矛科Celastraceae、翅子藤科Hippocrateaceae和伯力木属构成姊妹群〔10〕。APG的研究表明梅花草科包括梅花草属和微型草属Lepuropetalon两属,本科的系统关系与虎耳草科相距甚远,而与卫矛科构成姊妹群,同属于卫矛目〔11-12〕。显然,分子系统学研究与以往主要根据形态学研究的结果有很大的差异。《中国植物志》以及西藏、四川、内蒙古、青海、秦岭等各地方植物志的完成,使该属及属下分类单元的划分和系统演化更为清晰。2005年吴丁对梅花草属的分类系统学进行了详细的研究,并提出了一个将梅花草属植物划分为12组的系统框架〔13〕,但是其在分类过程中,并不是所有的梅花草属植物都运用了分子分析的手段。
在属下、种间等系统学研究中,由于ITS片段具有引物通用、片段长短适中等特点,因此已得到广泛应用〔14-15〕,同时Yang等〔16〕在2011年利用DNA条码技术鉴别梅花草属物种的研究中,表明在单序列分析中ITS片段具有最高的准确性,达86.7%;在多序列组合分析中,ITS+trnH-psbA序列片段具有最高准确性,达90%;因此,本研究将利用梅花草属植物的ITS序列,通过三种不同的方法对所构建的发育树之间的差异进行比较分析,并结合吴丁所创建的梅花草属植物的现代属下分类系统,补充分析未采用分子手段进行分类的几个物种,使这个分类系统更具权威性,种间关系更加清晰,为梅花草属植物系统进化及相关研究提供参考。
1 材料与方法
1.1 研究材料来源 研究所用的梅花草属rDNAITS序列片段来源于NCBI网站(National Center for Biotechnology Information)。共收集到30条,包括ITS1、5.8S和ITS2,片段总长度661 bp,由于微型草Lepuropetalon spathulatum与内类群趋异率较小,且与其他外群相比具有最好的同源性,因此选择微型草作为外群。
1.2 序列编辑及分析 首先序列矩阵上传至MUSCLE(Multiple Sequence Comparison by Log-Expectation)进行排序〔17〕,再运用Bioedit7.0.9.0将排序后的矩阵手动完善序列〔18〕。
1.2.1 邻接法 序列分析采用软件MEGA5.1,依据最大复合可能性原则,分枝的可靠性评价使用Bootstrap分析启发性搜索,1 000次重复取样,各序列矩阵中的空位和缺失作删除处理〔19〕。
1.2.2 最大似然法 序列分析上传至ATGC:Phy-ML生物信息学在线平台,选用GTR为替代模型,选用SPR&NNI来提高树形的稳定性,“靴带”分析设置为100次循环,各序列矩阵中的空位和缺失作删除处理〔20〕。
1.2.3 贝叶斯推理法 序列分析采用Mrbayes-3.1.2软件,设置进行1 000 000次取样,每10代抽取一棵树,共得到100 000棵树,前25 000棵树舍弃,剩余树经估算得到的50%主要规则一致树及后验概率,取得0.004 4的分散频率的平均方差,达到了小于0.01的标准。
2 结果
基于上述3种构树方法,所得NJ树、ML树和BI树如图1、2、3所示。

图1 根据ITS序列构建的NJ树
结果表明,NJ树和ML树的分枝的靴带支持率整体不高,其中NJ树少数分枝支持率达到100;ML树少数分枝支持率达到100,最低为4,系统树的中下部分枝支持率偏低。

图2 根据ITS序列构建的ML树

图3 根据ITS序列构建的BI树
扁平三裂组Sect.nectarotrilobos的凹瓣梅花草P.mysorensis、近凹瓣梅花草P.submysorensis、高山梅花草P.cacuminum、中国梅花草P.chinensis、无斑梅花草P.epunctulata、妖媚梅花草P.venusta、康定梅花草P.kangdingensis、类三脉梅花草P.pusilla和柱形组Sect.saxifragastrum的云南梅花草P.yunnanensis8个种均位于树的顶端,在BI树的靴带支持率均在96%以上,而在NJ树和ML树上的分枝支持率不高。
扁平五裂组Sect.allolobos的宽叶梅花草P.dilatata、厚叶梅花草P.perciliata、鸡肫梅花草P.wightiana、桂林梅花草P.guilinensis4个种和长药隔组Sect.xiphosandra的突隔梅花草P.delavayi、细裂梅花草P.leptophylla、短柱梅花草P.brevistyla3种构成姐妹群,且在BI树的靴带支持率达100%,但在NJ树和ML树上的分枝支持率不高。
外群微型草均处于系统树的基部,长叶组Sect.longiloba的长枝梅花草P.grandifolia、灰梅花草P.glanca、细辛叶梅花草P.asarifola3个种均处于系统树的亚基部,在BI树的靴带支持率达99%,但在NJ树和ML树上的分枝支持率不高。
现代梅花草属植物的分类系统由吴丁在2005年建立,在建立此分类系统的过程中,采用了分子分析的手段,但是并没将所有的物种囊括其中,在本文研究的30个梅花草物种中,有11个物种不在其梅花草属属下分类系统时所构建的系统发育树中,如表1所示。基于3种不同构树方法的比较研究,BI树的拓扑结构较好的表现出了梅花草属植物的亲缘关系,因此本文依据此11个物种在BI树的拓扑结构(如图3)所处位置和现代分类系统所处位置进行比较分析。
从BI树的拓扑结构来看,长叶组的云梅花草和无叶组的黄花梅花草构成一支,但是靴带支持率低于50%。齿裂组的格德梅花草、长爪梅花草和柱形组的长瓣梅花草构成一个单系类群,支持率为99%,其中齿裂组的长爪梅花草和柱形组的长瓣梅花草形成一个小分枝,支持率为100%。

表1 通过系统发育学研究其分类地位的11个物种及其所属组
由BI树的拓扑结构可知,长枝组的长枝梅花草、灰梅花草、细辛叶梅花草处于系统树的基部,构成一个单系类群,靴带支持率为99%,其中长枝梅花草和灰梅花草关系更为密切,形成一小分枝,支持率为100%;梅花草组的克氏梅花草和梅花草构成一支,形成一个单系类群,支持率为100%;长药隔组的细裂梅花草和突隔梅花草、短柱梅花草构成单系类群,支持率为90%,其中细裂梅花草和突隔梅花草关系更加密切,形成一小分枝,支持率为100%;扁平五裂组的宽叶梅花草和鸡肫梅花草、厚叶梅花草、桂林梅花草构成一个单系类群,支持率为99%,其中宽叶梅花草和厚叶梅花草形成一小分枝,支持率为100%。
3 讨论
3.1 3种不同构树方法的比较分析 由邻接法、最大似然法、贝叶斯推理法分析得到的系统发育树在拓扑结构上保持较高的一致性,仅在部分端、部分枝表现出差异。NJ树和ML树的靴带支持率不高,说明NJ树和ML树上各组的系统关系可信度较低。而BI树分枝的后验概率较高,大多数为100%,且基本都在95%以上,说明BI树上各组的系统关系可信度较高。关于上述3种方法的适用性,基于本研究的数据贝叶斯推理法所得的系统发育树获得了最高的后验概率,即拓扑结构表现出较高的稳定性。
对比上述三棵系统发育树可以看出,在三棵树中物种分布基本一致。但是其中有几组的梅花草属植物网结在一起,形成多个单枝,根据吴丁〔13〕提出的该属可能的演化路线图,唇形组的龙场梅花草更靠近基部;长叶组的云梅花草和无叶组的黄花梅花草关系密切;齿裂组、柱形组与扁平三裂组、扁平五裂组具有较近的亲缘关系,对比三棵系统发育树,BI树的拓扑结构较好地表现出了梅花草属植物的亲缘关系。
3.2 分子手段对现代梅花草属植物分类系统的论证从结果中可分析得出:齿裂组的长爪梅花草和柱形组的长瓣梅花草形成一个小分枝,支持率为100%,同时结合长瓣梅花的形态特征,其退化雄蕊不具备齿裂组的退化雄蕊扁平,低倒梯形,顶端具5~7齿的特点,而符合柱形组的退化雄蕊特点,因此长瓣梅花草仍属于柱形组。而其他10种梅花草在BI树上表现出来的拓扑结构均与梅花草属现代分类系统一致。
3.3 梅花草属植物的系统关系
3.3.1 三脉梅花草与绿花梅花草亲缘关系分析在Yang等〔16〕的利用DNA条码技术鉴定梅花草属一文中,试图推断三脉梅花草可能是绿花梅花草的祖先,并通过两者在进化树上的位置进行说明,但是其样本数量较小且树枝稳定性不高,并未作出明确结论。本文通过Genbank搜集绿花梅花草和三脉梅花草的ITS片段,从其所构成的BI系统发育树来看,绿花梅花草和三脉梅花草两者同属一枝,枝长相近,且支持率达到100%,拓扑结构稳定。此外,本文还选取了二者ITS序列片段进行同源性计算分析,两者的同源性高达99.1%,ITS片段基本一致。因此通过本文采用的分子手段的分析,可以推断三脉梅花草可能是绿花梅花草的祖先,但在形态学分类尚未作出改变前,我们仍需要更大的种群样本进行分析以得到更稳定可靠的分子数据,进一步确定两者的亲缘关系。
3.3.2 类三脉梅花草与中国梅花草亲缘关系分析在1941年“中国的梅花草”一文中类三脉梅花草被处理为中国梅花草的异名,但在现代梅花草属下分类系统中将类三脉梅花草和中国梅花草同分在扁平三裂组〔13〕,以此本文试图通过分子学手段推断类三脉梅花草是否应处理为中国梅花草的异名。由于在Genbank中没有找到类三脉梅花草的ITS序列,而在2008年康定梅花草归并入类三脉梅花草〔21〕,则用康定梅花草的ITS序列代替类三脉梅花草的ITS序列与中国梅花草的ITS片段构建BI树进行分析。但在树中发现两者并没有处于一枝,但通过中国梅花草和康定梅花草的ITS片段同源性分析结果来看,相似性达到96.7%,两者ITS片段非常相似,两个结果相矛盾,结合康定梅花草被归并入类三脉梅花草时是认为其子房位置存在连续性变异这一理由,所以只能推断类三脉梅花草和中国梅花草具有非常相近的亲缘关系,并不能证明为一个种,但本研究没有到模式产地进行调查和核对模式标本,只能从分子角度得以论证。
3.3.3 高山梅花草与中国梅花草亲缘关系分析观察本研究所构建的BI树可以发现,中国梅花草和高山梅花草同属一枝,支持率为100%,且枝长基本相等;并且二者ITS片段同源性相似性达到99.06%,从分子角度分析二者具有非常近的亲缘关系,笔者认为从分子学角度考虑,高山梅花草可以归并入中国梅花草。
同时对二者的外观形态进行了比较,形态特征极近似,二者仅有的区别在中国梅花草花瓣呈倒卵形,瓣片近圆形,基部有密集长流苏状毛,退化雄蕊裂片等长;而高山梅花草花瓣呈匙形,先端圆,基部有少许短流苏状毛,退化雄蕊裂片不等长。
对二者地理分布进行分析可知,中国梅花草分布于云南西北部、西藏东南部、四川、尼泊尔、不丹和缅甸;高山梅花草分布于我国青海东南部和四川西部和云南,而尚未查阅到其在国外有分布。通过在地图上分析发现,两者在国内分布范围基本一致而中国梅花草在国外也有分布,如图4。结合吴丁在2005年对梅花草属植物地理分布的研究,可以推断二者分化中心位于喜马拉雅-横断山脉,二者可能拥有共同的祖先,且分化程度不高。
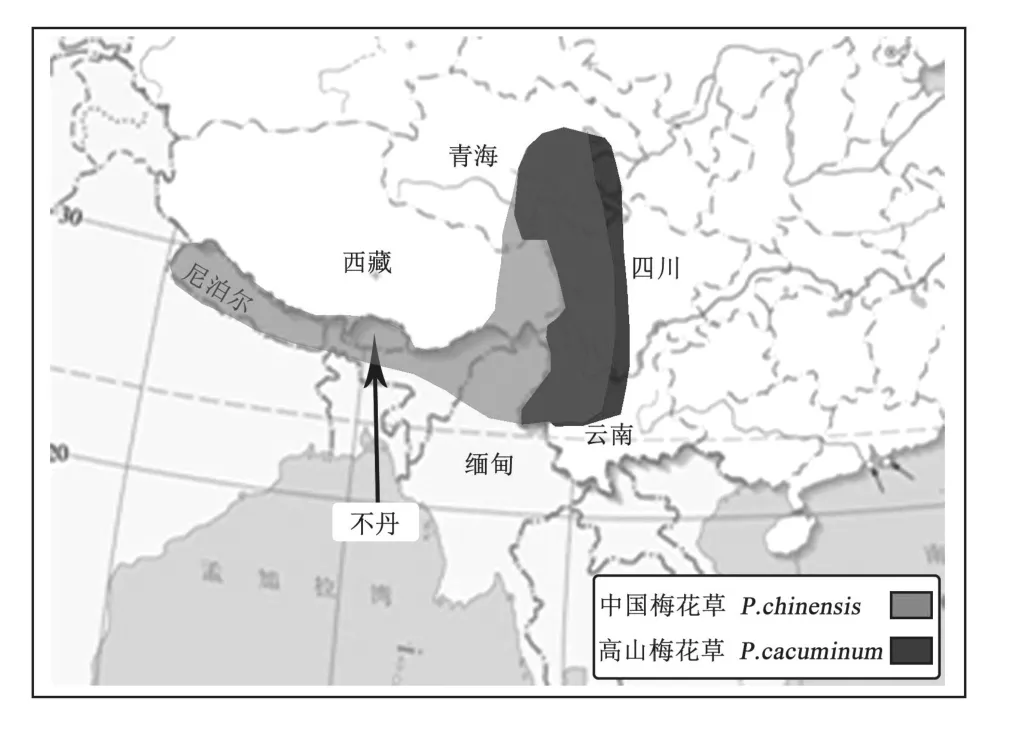
图4 中国梅花草与高山梅花草的地理分布区域图
综合上述分子序列、形态和地理分布对二者亲缘关系的分析,可以得出二者外观形态可能存在连续性变异,可能为一个种,需要更多其他分子片段的序列分析进一步证实高山梅花草与中国梅花草的亲缘关系。
〔1〕吴征镒,路安民,汤彦承,等.中国被子植物科属综论〔M〕.北京:科学出版社,2003:357-385.
〔2〕谷粹芝.中国梅花草属校订〔J〕.植物研究,1987,7(1):1-61.
〔3〕 KORTA J.Anatomical analysis ofParnassia palustrisL.〔J〕.Acta Biologica Cracoviensia Series Botanica,1972,15(1):31-37.
〔4〕谷粹芝,李振宇,黄蜀琼.中国植物志:52卷:第1分册〔M〕.北京:科学出版社,2000:126-269.
〔5〕ARBER A.On the structure of the androecium inParnassiaand its bearing on the affinities of the genus〔J〕.Annals of Botany,1913,27(107):491-510.
〔6〕ARBER A.The anatomy of the stamens in certain Indian species ofParnassia〔J〕.Annals of Botany,1915,29(113):159-160.
〔7〕BENSEL C R,PALSER B F.Floral anatomy in the Saxifragaceae sensu lato.I.Introduction,Parnassioideae and Brexioideae〔J〕.American Journal of Botany,1975,62(7):661-675.
〔8〕谷粹芝,陆玲娣,黄淑美,等.中国植物志〔M〕.北京:科学出版社,1995:1-66.
〔9〕SOLTIS D E,PAMELA S S,MICHAEL T C,et al.rbcL sequence divergence and phylogenetic relationships in Saxifragaceae sensu lato〔J〕.Proceedings of the National Academy of Sciences,1990,87(12):4640-4644.
〔10〕SAVOLAINEN V,SPICHIGER R,MANEN J F.Polyphyletism of Celastrales deduced from a chloroplast noncoding DNA region 〔J〕.Molecular Phylogenetics and Evolution,1997,7(2):145-157.
〔11〕The Angiosperm Phylogeny Group.An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants:APG II〔J〕.Botanical Journal of the Linnean Society,2003,141(4):399-436.
〔12〕The Angiosperm Phylogeny Group.An ordinal classification for the families of flowering plants〔J〕.Annals of the Missouri Botanical Garden,1998,85(4):531-553.
〔13〕吴丁.梅花草属植物的系统演化与生物地理〔D〕.昆明:中国科学院昆明植物研究所,2005.
〔14〕TABERLET P,GIELLY L,PAUTOU G,et al.Universal primers for amplification of three non-coding regions of chloroplast DNA〔J〕.Plant Molecular Biology,1991,17(5):1105-1109.
〔15〕田欣,李德铢.DNA序列在植物系统学研究中的应用〔J〕.云南植物研究,2002,24(2):170-184.
〔16〕YANG J B,WANG Y P,MOELLER M,et al.Applying plant DNA barcodes to identify species of Parnassia(Parnassiaceae)〔J〕.Molecular Ecology Resources,2012,12(2):267-275.
〔17〕Birney Research Group.Multiple Sequence Comparisonby LogEpecttion〔EB/OL〕.〔2005-08-26〕.http://www.ebi.ac.uk/Tools/msa/muscle.
〔18〕HALL T A.BioEdit:a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT〔R〕.Nucleic acids symposium series,1999,41:95-98.
〔19〕TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:Molecular Evolutionary Genetics Analysis using Maximum Likelihood,Evolutionary Distance,and Maximum Parsimony Methods〔J〕.Molecular Biology and Evolution,2011,28(10):2731-2739.
〔20〕GUINDON S,DUFAYARD J F,LEFORT V,et al.New Algorithms and Methods to Estimate Maximum-Likelihood Phylogenies:Assessing the Performance of PhyML 3.0〔J〕.Systematic Biology,2010,59(3):7-21.
〔21〕吴丁,卢金梅,王红.中国梅花草属(梅花草科)一些种类的订正〔J〕.云南植物研究,2008,30(6):657-661.

