DNA损伤在去分化源性表皮干细胞安全性评价中的作用及相关机制的研究
潘 宇 余细勇 吴漫茵 付小兵 蔡 飒
(1.广东省人民医院,广东省医学科学院医学研究中心, 广东 广州 510080;2.深圳大学医学部,广东 深圳 518060;3.解放军总医院第一附属医院全军创伤修复与组织再生重点实验室暨皮肤损伤修复与组织再生北京市重点实验室, 北京 100048)
·论 著·
DNA损伤在去分化源性表皮干细胞安全性评价中的作用及相关机制的研究
潘 宇1余细勇1吴漫茵2付小兵3蔡 飒2
(1.广东省人民医院,广东省医学科学院医学研究中心, 广东 广州 510080;2.深圳大学医学部,广东 深圳 518060;3.解放军总医院第一附属医院全军创伤修复与组织再生重点实验室暨皮肤损伤修复与组织再生北京市重点实验室, 北京 100048)
目的:从分子、细胞及在体水平评估DNA损伤和非DNA损伤因素诱导所得去分化源性表皮干细胞的安全性,探讨DNA损伤及其应答分子对其安全性评估的意义与机制。方法:分别采用紫外线(UV)照射和bFGF处理诱导方案诱导表皮细胞去分化。采用MTT法比较正常培养和血清培养条件下的两组去分化源性表皮干细胞的增殖能力;流式细胞术检测凋亡情况;Western blotting检测各组去分化过程中DNA损伤应答分子γ-H2AX、激活型caspase、p53、p21表达的变化;在雌性BALB/c裸小鼠右侧腋窝皮下注射人黑色素瘤细胞及两种去分化源性表皮干细胞,同时设生理盐水注射对照,30 d后取瘤块称重,评估两种去分化源性干细胞的成瘤性。结果:①两种去分化源性表皮干细胞均表现出较强的增殖能力,UV照射所得干细胞具有较强的血清耐受性;②UV照射可导致表皮细胞DNA损伤和细胞凋亡,影响表皮细胞中p53和p21水平,而bFGF处理组无此作用;③两种去分化源性表皮干细胞均无体内成瘤性。结论:去分化过程中细胞DNA损伤与否是评价去分化源性干细胞安全性的较敏感的关键指标,因此bFGF处理诱导与UV照射所得的表皮干细胞相比更为安全可靠。
表皮干细胞 去分化 DNA损伤 安全性评价
表皮干细胞是皮肤及其附属器发生及修复的源泉。通过诱导表皮细胞去分化获得表皮干细胞对临床治疗大面积深度烧伤等皮肤损伤的患者具有重要临床意义[1-4]。目前研究表明,包括表皮细胞、成纤维细胞及汗腺细胞在内的多种皮肤细胞可在相应诱导条件下发生去分化,从而获得从表皮干细胞到诱导性多能干细胞(iPSCs)等的具有不同分化潜能的干细胞类型[3-6]。其中,报道显示表皮细胞可被成纤维细胞生长因子(bFGF)与热损伤及紫外线(ultraviolet,UV)照射等因素诱导去分化为表皮干细胞,使已分化的表皮细胞重新获得表皮干细胞表面标志物并表现出干细胞相关功能[2-3, 5, 7-8]。尽管如此,由于不同因素引发去分化过程的机制及作用差异尚未阐明,因此如何从这些去分化诱导方案中选择一种可高效安全的获得表皮干细胞的方法亦尚无定论。
随着近年关于iPSCs及成体细胞重编程研究的深入,去分化过程与肿瘤发生的密切关系也日益受到关注[8]。目前对于干细胞致瘤性评价方法主要是动物致瘤性实验,此方法成本高、耗时长且敏感性受动物和细胞状态影响大。本研究通过比较DNA损伤和非DNA损伤因素诱导的表皮细胞去分化模型在去分化过程中细胞生物学表现的差异,从DNA损伤及相关分子的变化机制等方面进行评价,与传统的动物致瘤性实验比较,为去分化源性干细胞的安全性评价,以及为进一步寻找决定细胞进入去分化过程或肿瘤化过程的关键因素提供实验依据。
1 材料与方法
1.1 表皮细胞培养 实验所用成人包皮来自外科包皮环切术患者,患者均签署知情同意书。无菌工作台中将包皮剪成小块,中性蛋白酶消化24 h。去除真皮层,将保留的表皮层用胰酶消化,筛网滤除组织碎片。将过滤的细胞悬液接种至包被Ⅳ型胶原的培养板中,用含2% 角质细胞生长补充液(HKGS)的EpiLife培养基(Cascade Biologics公司),于37 ℃、5%CO2培养箱内培养,细胞融合度达80%时传代。
1.2 表皮细胞去分化 采用本课题组已报道的方法,分别用bFGF和UV照射方案处理表皮细胞[5]。bFGF组:将培养的表皮细胞传代至35 mm2培养皿中,去除培养基,PBS洗3次,细胞置于43 ℃水浴1 h,用EpiLife培养基洗涤2次,加入bFGF(100 ng/m1)作用24 h,加入表皮细胞培养基继续培养14 d。UV组[9]:采用Sigma便携式UVC灯(波长254 nm,剂量8 J/m2)照射细胞10 min,每日1次,连续照射3 d,之后同前述方法培养细胞。
1.3 细胞增殖实验 MTT法检测细胞生长情况。将去分化诱导后的两组细胞按103个/孔分别接种至96孔板。常规培养48 h后,去除培养基,每孔加入 20 μl MTT溶液,置于37 ℃细胞培养箱内继续孵育 4~5 h。每孔加入100 μl Formanzan溶解液,培养箱中孵育3 h。使用酶联免疫检测仪(Model3550,Bio-Rad)在570 nm处测定吸光度值(A值)。1.4 血清耐受性实验 将去分化诱导后的两组细胞分别接种至96孔板,用含10%胎牛血清(FBS)的EpiLife培养基培养细胞,48 h后进行细胞增殖实验。1.5 流式细胞术检测细胞凋亡 具体方法按照Biovision公司(CA, USA)Annexin V/PI双染试剂盒说明书进行。大致步骤为:将对数生长期细胞消化为单细胞悬液,用PBS洗3次;用200 μl的结合缓冲液重悬细胞,室温孵育10~15 min;加入10 μl Annexin V-FITC和5 μl PI,轻轻混匀,室温避光反应15 min,用流式细胞仪检测细胞凋亡情况。
1.6 Western Blotting检测DNA损伤标志物γ-H2AX、凋亡相关基因激活型 caspase3及肿瘤相关或抑癌基因p53、p21的蛋白表达水平 用细胞裂解液裂解细胞,提取细胞总蛋白,按Bradford法测蛋白浓度;将定量后的蛋白标本行SDS-PAGE电泳;转膜后孵育抗体,一抗室温孵育2 h、相应的二抗孵育1 h。洗膜后按照试剂说明用Santa Cruz Biotechnology公司化学发光增强剂显影。所用一抗包括兔抗鼠γ-H2AX (Ser139,CST公司)、鼠抗鼠p53(BD Pharmingen公司)、兔抗鼠p21(Abcam公司)、兔抗鼠激活型 caspase3(Abcam公司)及鼠抗鼠β-actin(Abcam公司),HRP-羊抗兔及HRP-羊抗鼠等二抗购自Santa Cruz Biotechnology公司。1.7 动物成瘤性实验 将5周龄雌性BALB/c裸小鼠随机分为5组,每组6只,分别为:阴性对照组、人黑色素瘤细胞(HMCBs,本室传代保存)对照组、表皮细胞(原代分离培养)对照组、bFGF处理组和UV照射组。各组细胞分别用生理盐水以5×106个/200 μl重悬,在动物右侧腋窝行皮下注射,阴性对照组注射200 μl生理盐水,观察肿瘤的生长情况,30 d后于接种部位取出肿块称重。
2 结 果
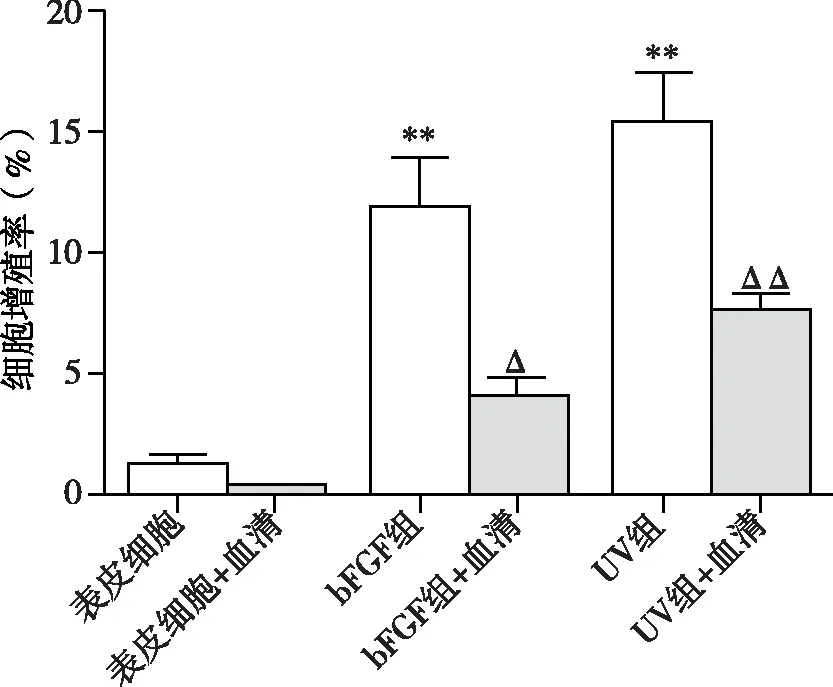
注:与表皮细胞组比较:**P<0.01;与表皮细胞+血清组比较:ΔP<0.05,ΔΔP<0.01
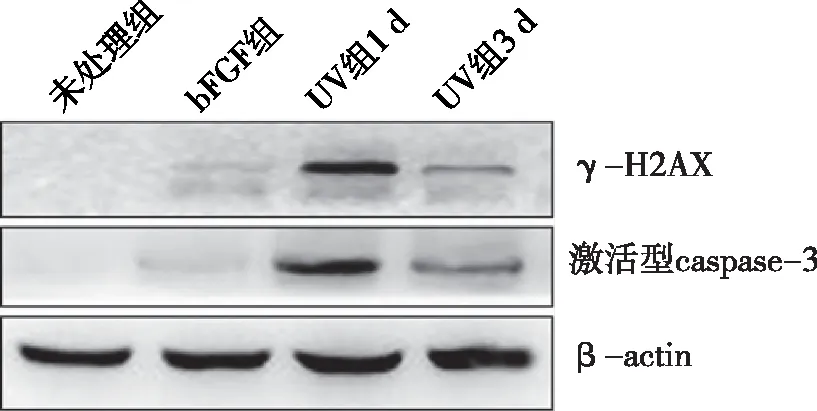
图2 不同去分化诱导方法诱导的表皮干细胞γ-H2AX和激活型caspase3水平的Western blotting检测结果

图3 不同去分化诱导方法对去分化源性表皮干细胞γ -H2AX(A)和激活型caspase3(B)蛋白表达水平的影响
注:与未处理组比较:*P<0.05
2.1 两种方案诱导去分化所得表皮干细胞增殖能力及血清耐受性的差异 bFGF组和UV组所得的去分化细胞均表现出较强细胞增殖能力。根据表皮干细胞不能耐受血清、而肿瘤细胞适应血清环境的特点,我们同时检测不同去分化源性细胞对于血清的耐受性差异,结果显示UV组血清耐受性更强。见图1。2.2 两种诱导方案对细胞DNA损伤及细胞凋亡的影响 Western blotting结果显示,bFGF诱导去分化并不导致DNA损伤标志物γ-H2AX水平升高,即无DNA损伤作用,通过检测Annexin V/PI双染细胞数和细胞中激活型caspase3水平显示无明显细胞凋亡表现;而UV照射方案则会引起γ-H2AX升高和细胞凋亡,其水平在照射后3 d逐渐下降。见图2~5。2.3 DNA损伤应答通路在不同方式诱导去分化过程中的作用差异 对两种方法诱导的表皮干细胞中p53和p21表达水平的测定结果显示,bFGF处理对这两种蛋白水平无显著影响,说明bFGF诱导细胞去分化过程与p53和p21水平无关。而UV照射可增强细胞中p53和p21表达水平,这与前述细胞DNA损伤及凋亡结果相符,证实UV照射诱导的DNA损伤是通过p53/p21这条通路诱导凋亡,从而修复或清除DNA损伤的细胞。见图6和图7。2.4 动物成瘤性实验 接种细胞后第10天,HMCBs组已出现明显瘤块,第30天时瘤块重(1.796 ± 0.636)g;而其他各组始终未出现瘤块。
3 讨 论
去分化,即逆行性分化,是指终末分化的成体细胞在诱导因素作用下发生细胞重编程而重新获得增殖及分化潜能等祖细胞或干细胞特性的过程。自从2007年日本科学家通过诱导皮肤成纤维细胞重编程获得具有胚胎干细胞特性的iPSCs以来,因其在干细胞治疗、疾病模型建立、组织器官重建等应用领域的重大意义,成体细胞去分化及其相关细胞生物学机制的研究引起空前关注。本课题组成员曾经通过UV照射、生长因子、胚胎提取液诱导等方式成功建立多个表皮细胞去分化的诱导模型。然而,用于诱导重编程获得iPSCs的相关转录因子(Oct4、Sox2、Myc、Klf4)及促发因素多与肿瘤发生有密切关系[10]。去分化与肿瘤发生在分子机制上的相似性也引发人们对去分化源性细胞安全性的忧虑。

图4 不同去分化诱导方法诱导的去分化源性表皮干细胞凋亡的流式细胞术检测结果

注:与未处理组比较:*P<0.05
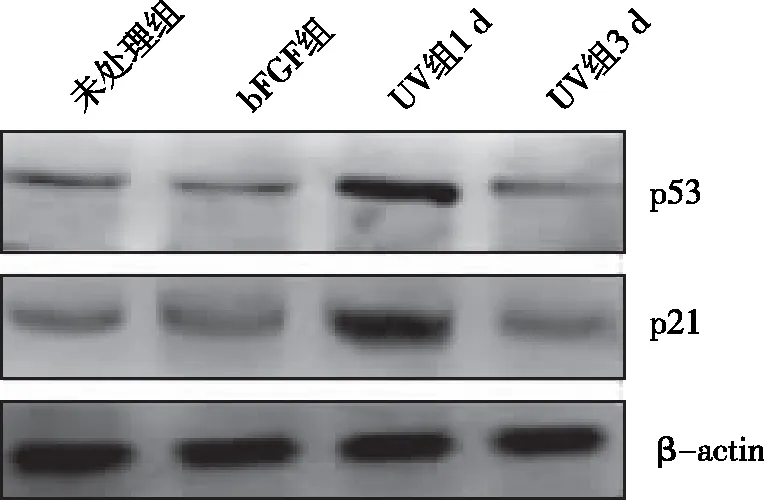
图6 不同去分化诱导方法对去分化源性表皮干细胞p53和p21表达影响的Western blotting检测结果

注:与未处理组比较:*P<0.05
本研究中,bFGF处理和UV照射诱导的去分化源性表皮干细胞均有较强的增殖能力。同时,利用表皮干细胞无法耐受动物血清培养环境的特性,我们进一步比较了两种去分化来源细胞对动物血清的耐受性,虽然结果显示两种去分化来源的表皮干细胞均不能耐受动物血清培养环境,但相比之下UV照射诱导所获得的表皮干细胞对血清的耐受性要强于bFGF诱导的细胞,提示UV照射在促进表皮细胞增殖的同时,还使细胞发生转化从而获得能在含血清培养基中持续生存的能力,说明其可能具有发生恶性转化的潜能。
UV照射和bFGF处理的最大差异在于前者可引起细胞DNA损伤,而DNA损伤的累积是肿瘤发生的主要原因。因此我们认为DNA是否发生损伤是决定细胞去分化过程中是否发生恶性转化的主要因素,也是决定表皮细胞去分化过程是否稳定安全的关键,可作为去分化源性表皮干细胞安全性评价的重要指标[10]。H2AX是组蛋白H2A家族成员,可应答于UV等诱导的DNA损伤而发生Ser139位点磷酸化,即γ-H2AX。γ-H2AX 可迅速聚集于细胞核DNA损伤部位,且其磷酸化水平可反应DNA损伤程度。本研究中,UV照射可引起γ-H2AX水平的增加,表明细胞出现DNA损伤并引发细胞凋亡,而bFGF诱导的表皮干细胞γ-H2AX水平没有明显变化,说明bFGF诱导对DNA稳定性不产生影响,是较为安全的诱导方式。DNA损伤与细胞耐受性评价结果均提示bFGF诱导方案是更为安全的诱导方式。
p53和p21信号通路是细胞应答DNA损伤的主要调控机制,可通过诱导细胞周期阻滞、细胞凋亡和衰老等方式清除损伤细胞,从而保证DNA稳定性以防止细胞恶变的发生[9,11-13]。因此,癌前细胞在最终完成恶性转化前,往往要选择性地诱导p53通路等DNA损伤应答机制失调。此外,多个研究表明p53具有促进干细胞分化和抑制细胞去分化的作用[10, 14-15]。本研究中,尽管bFGF处理组中有通过热损伤刺激细胞的步骤,但细胞中p53和p21水平始终未发生变化;而UV照射可显著增加p53及p21水平,直至UV照射撤除之后第3天其水平才显著下降。以上结果提示在损伤因素撤除后,细胞才能发生去分化,这种损伤因素的刺激对于去分化的发生具有重要作用。DNA损伤因素刺激导致细胞中p53相关因子的活化对去分化过程中细胞DNA稳定性提供了保障。
动物成瘤性实验是检测干细胞安全性及肿瘤细胞成瘤能力的常用方法。但细胞成瘤性受动物及细胞状态影响较大,即便是肿瘤组织中分出的原代恶性细胞悬液也往往表现不出成瘤性,也就是说成瘤性并不能完全反应恶性潜能。虽然本研究中去分化源性表皮干细胞的动物成瘤性实验结果为阴性,但由于UV照射诱导过程中出现了DNA损伤、p53及p21等肿瘤相关基因的变化,所以成瘤性实验的阴性结果也并不能敏感的排除恶性潜能细胞的存在。
总之,本研究采用DNA损伤和非DNA损伤因素诱导表皮细胞去分化模型,从分子、细胞及在体三个层次对不同来源的去分化源性干细胞进行安全性评价。结果提示,与成瘤性实验的结果相比,DNA损伤及相关应答分子的变化可更为敏感地反应诱导所得干细胞的安全性。通过比较bFGF处理和UV照射两种方案诱导所得干细胞的稳定性,bFGF处理方案显得更为可靠。
[1] 张翠萍, 付小兵, 陈鹏, 包晓霞, 孙同柱. 去分化表皮干细胞的来源鉴定和分析[J]. 感染、炎症、修复, 2009, 10(4): 205-207.
[2] Cai S, Fu X, Sheng Z. Dedifferentiation: a new approach in stem cell research[J]. Bioscience, 2007, 57(8): 8.
[3] 付小兵. 从去分化途径来制造干细胞:新的机遇和挑战[J]. 感染、炎症、修复, 2008, 9(3): 131-133.
[4] 孙晓艳, 付小兵, 刘惠玲. 去分化来源表皮干细胞与在体表皮干细胞之间的差异分析[J]. 感染、炎症、修复, 2010, 11(1): 17-20.
[5] Zhang C, Fu X, Chen P, Bao X, Li F, Sun X, Lei Y, Cai S, Sun T, Sheng Z. Dedifferentiation derived cells exhibit phenotypic and functional characteristics of epidermal stem cells[J]. J Cell Mol Med, 2009, 14(5): 1135-1145.
[6] Fu X, Sun X, Li X, Sheng Z. Dedifferentiation of epidermal cells to stem cells in vivo[J]. Lancet, 2001, 358(9287): 1067-1068.
[7] Sun X, Fu X, Han W, Zhao Y, Liu H, Sheng Z. Dedifferentiation of human terminally differentiating keratinocytes into their precursor cells induced by basic fibroblast growth factor[J]. Biol Pharm Bull, 2011, 34(7): 1037-1045.
[8] Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell, 2007, 131(5): 861-872.
[9] 李海红, 付小兵, 王君, 郭永峰, 孙同柱. 表皮细胞去分化的初步实验研究[J]. 感染、炎症、修复, 2006, 7(3): 131-134.[10] Cai S, Pan Y, Fu X, Lei Y, Sun T, Wang J, Sheng Z. Dedifferentiation of human epidermal keratinocytes induced by UV in vitro[J]. J Health Sci, 2009, 55(5): 11.
[11] Cai S, Fu X, Sheng Z. Dedifferentiation: a new approach in stem cell research[J]. Bioscience, 2007, 57(8): 655-662.
[12] Cai S, Pan Y, Sun X, Zhang C, Fu X. Dedifferentiation: a new approach for skin regeneration[J]. Science, 2012, 336 (suppl Regenerative Medicine in China):S58-S59.
[13] Pan Y, Cai S, Fu X, Zhao A. p53: The Barrier or Guardian for Cell Dedifferentiation?[J]. Bioscience, 2014, 64(10): 883-892.
[14] Xu Y. Induction of genetic instability by gain-of-function p53 cancer mutants[J]. Oncogene, 2008, 27(25): 3501-3507.
[15] Meek DW. Tumour suppression by p53: a role for the DNA damage response?[J]. Nat Rev Cancer, 2009, 9(10): 714-723.
Safety evaluation of dedifferentiation-derived epidermal stem cells after damage to DNA and investigation of related molecular mechanisms
Pan Yu*, Yu Xiyong, Wu Manyin, Fu Xiaobing, Cai Sa.*
Medical Research Center of Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, Guangdong, China
Cai Sa(E-mail:cai_sa@sina.com)
Objective:To evaluate the safety of the dedifferentiation-derived epidermal stem cells generated either by damage to DNA or non-DNA-damage with protocols of molecular, cellular andinvivostudy, and to investigate the mechanisms of DNA-damage responsers in the process of epidermal cells dedifferentiation.Methods:Two types of dedifferentiation-derived epidermal stem cell were generated individually using the ultraviolet (UV) radiation or basic fibroblast growth factor (bFGF) treatment protocol. The proliferation ability and serum tolerance of different dedifferentiation-derived epidermal stem cells were compared by MTT assay. Apoptosis of dedifferentiated cells was detected by flow cytometry. The changes in occurrence of DNA damage and related molecular elements (phospho-histone γ-H2AX,cleaved caspase, p53, p21) were detected by Western blotting. Different epidermal stem cells, human melanoma cells, or normal saline were injected subcutaneously into right armpits of female nude mice, and their tumorigenic potential was assessed.Results:①The proliferation of dedifferentiation-derived epidermal stem cells were increased in either UV radiation or bFGF-treated group, while cells from UV radiation group appeared to be more tolerant to serum than those from bFGF-treated group.② UV radiation, but not bFGF treatment, caused DNA damage and apoptosis in epidermal cells and the levels of p53 and p21 were increased. ③ No tumor formation was found in dedifferentiation-derived epidermal stem cells of UV radiation nor bFGF-treated group.Conclusions:The occurrence of DNA damage in the process of dedifferentiation is sensitive and crucial in evaluating the safety of dedifferentiation-derived epidermal stem cells. The induced epidermal stem cells from bFGF-treated group are more reliable than those from UV radiation group.
Epidermal stem cells Dedifferentiation DNA damage Safety evaluation
10.3969/j.issn.1672-8521.2015.01.006
国家自然科学基金资助项目(81000011,81272080,81000835);深圳市科技研发资金基础研究计划(JC201005280429A,JCYJ20120613101917373)
蔡飒,副教授(E-mail:cai_sa@sina.com)
2015-02-03)

