肠道益生菌联合温生理盐水灌肠改善早产儿喂养不耐受疗效分析
曾旦丹,史婧奕,陈一欢,李 娜,冯琪君,黄绮薇
(上海市儿童医院上海交通大学附属儿童医院新生儿科,上海 200040)
肠道益生菌联合温生理盐水灌肠改善早产儿喂养不耐受疗效分析
曾旦丹,史婧奕,陈一欢,李 娜,冯琪君,黄绮薇
(上海市儿童医院上海交通大学附属儿童医院新生儿科,上海 200040)
目的 评估补充肠道益生菌联合温生理盐水灌肠改善早产儿喂养不耐受的效果。方法将2014年1~12月收治入院且符合纳入标准的早产儿133例,随机分为A组(对照组,不干预,33例)、B组(温生理盐水灌肠,34例)、C组(口服培菲康,35例)和D组(温生理盐水灌肠联合口服培菲康,31例)。记录各组早产儿胎粪排尽时间、黄疸消退时间、恢复至出生体重时间、经肠道内喂养每日摄入热卡100 kCal/kg的时间,以评估早产儿是否发生喂养不耐受,并统计各组发生的并发症。结果在胎粪排尽时间、黄疸消退时间和经肠道内喂养每日摄入热卡100 kCal/kg的时间方面,D组早产儿均低于其他3组,差异均具有显著统计学意义(P<0.05)。结论补充肠道益生菌联合温生理盐水灌肠通便的干预方法安全有效,能显著减少早产儿喂养不耐受的发生。
喂养不耐受;灌肠;益生菌;早产儿
随着新生儿急救技术的发展,低出生体重早产儿的存活率有了较大的提高[1]。不过,早产儿喂养不耐受(Feeding intolerance,FI)的发生却越来越引起新生儿科医生及家长的重视,其主要表现为经胃肠道喂养后出现反复胃潴留、腹胀、呕吐和体重增长缓慢等临床症状,部分严重早产儿甚至死亡。采取积极有效的措施,尽快改善早产儿喂养不耐受的状况已经成为早产儿出生后必须跨越的障碍之一,并对早产儿今后的生长发育有着重大的影响[2]。本文旨在探讨早产儿实施早期补充肠道益生菌联合温生理盐水灌肠通便对改善其喂养不耐受的临床疗效。
1 资料与方法
1.1 一般资料 2014年1~12月本院新生儿科共收治早产儿152例,按以下标准选择:胎龄≥30周且<34周,排除先天性出生缺陷、坏死性小肠结肠炎、入院时日龄>3 d、外科手术;且未使用促胃肠动力药物,均能住院接受治疗至恢复出生体重时。最终入组133例,其中男性72例,女性61例;出生体重(2 163.15±380.83)g,胎龄(34.37±1.87)周。
1.2 分组与治疗方法 入组的133个早产儿均接受常规喂养:使用早产儿专用配方奶粉,喂养起始总量10 ml/(kg·d),加奶量≤20 ml/(kg·d)。根据入院时间的顺序随机分成4组,分别给予不同的干预措施:A组33例为对照组,按照常规喂养,不采取其他任何干预措施;B组34例为温生理盐水灌肠组,入院当天即通过一次性灌肠肛管往直肠注入37°C生理盐水10 ml,顺时针按摩腹部2 min,灌肠通便,以后每日上午7时重复进行,直至胎粪排尽日;C组35例为培菲康组,入院当天即予口服双歧杆菌三联活菌散(上海信谊药厂生产,培菲康散剂,0.5 g/次,2次/d)协助尽快建立肠道正常菌群,直至胎粪排尽日;D组31例为温生理盐水灌肠联合培菲康组,同时采取B组和C组的干预措施。各组早产儿均同时接受抗感染、呼吸、循环支持等基础治疗。
1.3 观察指标与评价方法 各组早产儿每日上午7时30分接受称体重,精确到1 g;每日上午8时接受经皮胆红素值测定,精确到1 μmol/L;记录每日大便次数及性状,以确定胎粪排尽的最终时间;监测奶量变化及每日热卡摄入情况,以确定患儿最终通过肠道喂养可以获得100 kCal/(kg·d)的时间点。胆红素水平测定值下降到或低于80 μmol/L的时间认定为黄疸消退的时间;排出的粪便由墨绿色转变为黄色,视为胎粪排尽;经肠道喂养的量达到100 kCal/(kg·d)而不出现呕吐、腹胀、胃潴留,表明早产儿达到全肠道喂养,无喂养不耐受。住院治疗期间,统计各组出现FI、坏死性小肠结肠炎(Necrotizing enterocolitis,NEC)和败血症的例数。
1.4 统计学方法 应用SPSS13.0统计学软件进行数据分析,计量数据以均数±标准差(±s)表示,四组间的计量数据比较采用单因素方差分析,组间两两比较采用Tukey检验方法(Tukey's test);四组间的并发症比较,根据数据样本大小分别选用2×C列表Pearson卡方、校正卡方检验或Fisher's精确概率法,均以P<0.05为差异具有统计学意义。
2 结果
2.1 四组早产儿一般资料比较 各组早产儿的一般资料相近,差异均无统计学意义(P>0.05),见表1。
表1 四组早产儿的一般资料比较(±s)
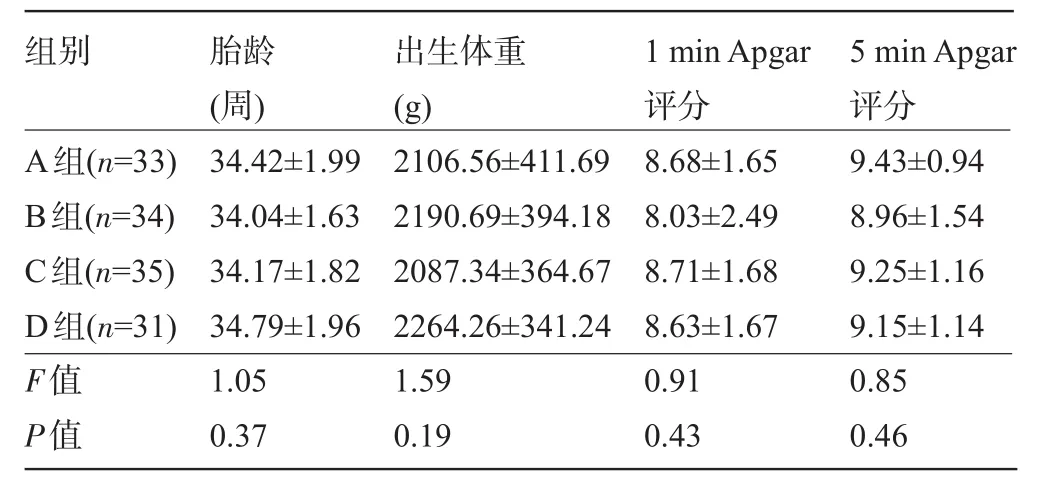
表1 四组早产儿的一般资料比较(±s)
F值P值1.05 0.37 1.59 0.19 0.91 0.43 0.85 0.46
2.2 四组早产儿恢复情况比较 经治疗后,在早产儿的黄疸消退、胎粪排尽、全肠道喂养和恢复至出生体重的时间方面,B组、C组和D组均低于A组,且差异均有统计学意义(P<0.05);B组和C组之间上述指标比较差异均无统计学意义(P>0.05);D组低于B组和C组,差异均具有统计学意义(P<0.05),见表2。
表2 四组早产儿恢复情况比较(±s,d)

表2 四组早产儿恢复情况比较(±s,d)
注:a与A组比较,P<0.05;b与B组比较,P<0.05;c与C组比较,P<0.05。
A组(n=33) B组(n=34) C组(n=35) D组(n=31)F值P值11.38±4.91 9.70±3.76a8.53±3.24a7.58±2.68abc6.48<0.01 8.34±4.83 4.89±2.73a4.90±1.92a4.47±2.06abc11.31<0.01 12.81±7.73 10.59±2.49a12.09±6.07a10.26±3.33abc4.61<0.01 8.62±4.13 6.59±2.89a6.28±2.67a6.05±2.82abc1.58 0.04
2.3 四组早产儿的严重并发症比较 四组早产儿都有FI、NEC及败血症发生,虽然B组、C组和D组的FI和NEC的例数低于A组,但四组之间差异无统计学意义(P>0.05);在败血症的发生率方面,四组之间差异也无统计学意义(P>0.05),见表3。
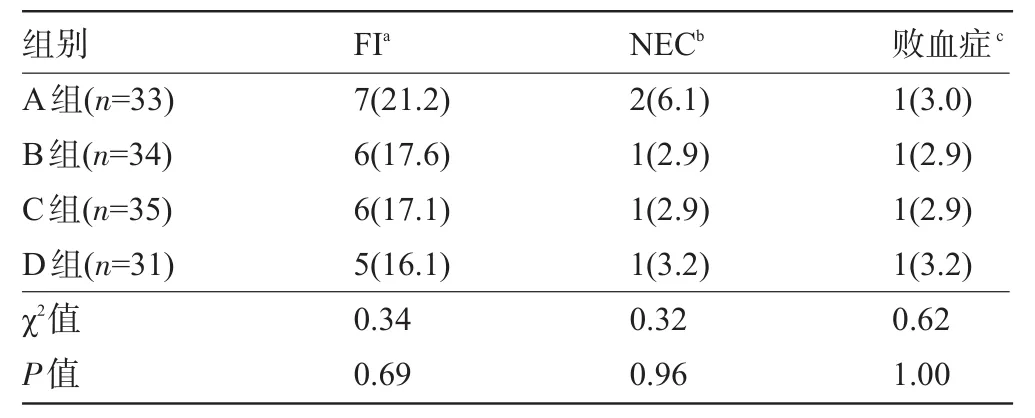
表3 四组早产儿的严重并发症比较[例(%)]
3 讨论
胎儿肠道的消化吸收功能在妊娠后期己相对完善,但胃肠动力的发育相对迟缓[3]。在胎龄<31周的早产儿,小肠仅呈低幅而无规律的收缩,几乎没有推进性活动,容易发生喂养不耐受,可能导致坏死性小肠结肠炎、胆汁淤积,容易并发重症感染,延长住院时间,使其矫正年龄2岁时心理发育落后,重症可危及早产儿生命[4]。目前,临床上早产儿喂养不耐受的治疗旨在改善胃肠动力和调节肠道菌群[5-6]。
早产儿结肠动力不成熟,首次胎粪排出往往延迟。仅37%的早产儿出生后24 h内首次排胎粪,出生体重不足1 000 g的早产儿,首次排便时间平均在生后3 d。排出时间延迟使胎粪积聚在乙状结肠及直肠内,阻塞肠腔,加重喂养不耐受[7]。所以,要想使早产儿尽早达到经肠道喂养,就得设法改善其胃肠动力。文献报告用静脉小剂量红霉素防治早产儿喂养不耐受,但其有效性和安全性有待于通过大样本高质量的随机对照试验和系统评价予以证实[8];西沙必利曾被用于治疗早产儿喂养不耐受,因疗效不明确以及严重的不良反应(致死性心律失常)[9-10],已经停止生产并不再应用于临床[11]。因此,寻求安全有效改善早产儿胃肠动力的方法就显得尤为重要。
Shim等[12]使用甘油灌肠促进胎粪早期排出,结果使极低出生体重儿达到全肠道内营养的时间明显提前,喂养耐受性改善,并且减少脓毒症的发生。也有研究证实人工通便可促进胃泌素分泌[13]。本研究使用温生理盐水灌肠对早产儿进行干预,操作简便、安全,既能稀释粘稠胎粪,又可促进肠道蠕动,加速胎粪排出,改善胃肠动力,减少胆红素的肠肝循环,降低早产儿喂养不耐受的发生率。与对照组比较,温生理盐水灌肠组早产儿达到全肠道喂养的时间显著缩短(P=0.018)。
近年来,微生态制剂在儿科领域广泛应用,补充益生菌能够促进早产儿肠道生理性有益菌的生长发育,间接抑制有害菌的生长,降低内毒素水平,有利于重建微生态平衡。Sari等[14]使用乳酸杆菌治疗早产儿喂养不耐受取得良好疗效。本研究给早产儿口服双歧杆菌三联活菌散(培菲康),利用其所含的粪链球菌、嗜酸乳杆菌和双歧杆菌分别定植于肠道上、中、下部位,在全肠道形成屏障,帮助早产儿早期建立肠道菌群,通过调节肠内免疫细胞活性促进早产儿肠道上皮细胞生长发育。与对照组比较,口服培菲康组早产儿达到全肠道喂养的时间也明显缩短(P<0.05)。
本研究把上述两个有效的治疗措施结合起来,即温生理盐水灌肠通便加上口服培菲康,对早产儿进行干预,结果显示,本组早产儿黄疸消退较对照组早产儿更迅速(P=0.000 4),有效降低高胆红素血症对早产儿的危害,达到全肠道喂养的时间也明显缩短(P<0.01);与单独用温生理盐水灌肠通便或口服培菲康组比较,在黄疸消退时间和达到全肠道喂养的时间也有所缩短,差异有统计学意义(P<0.05)。
本研究结果显示,温生理盐水灌肠通便联合早期补充肠道益生菌的干预方法安全实用,可尽快使早产儿达到全肠道内营养,显著降低早产儿喂养不耐受的发生率,有利于实现早产儿的生后追赶性生长,治疗方法简便、效果很好,值得临床推广。
[1]超未成熟儿与超低出生体重儿研究协作组,吴 繁,崔其亮.广东省新生儿科超未成熟儿与超低出生体重儿存活情况分析[J].中华儿科杂志,2014,52(10):729-735.
[2]张志群,朱建幸.早产儿喂养不耐受治疗进展[J].临床儿科杂志, 2009,27(6):592-596.
[3]Berseth CL.Gastrointestinal motility in the neonate[J].Clin Perinatol,1996,23(2):179-190.
[4]Morris BH,Miller-Loncar CL,Landry SH,et al.Feeding medical factors and developmental outcome in premature infants[J].Clin Pediatr(Phila),1999,38(8):451-457.
[5]Dang S,Shook L,Garlitz K,et al.Nutritional outcomes with implementation of probiotics in preterm infants[J].J Perinatol,2015,35 (6):447-450.
[6]黄华飞,杨戎威,钟文华,等.红霉素联合清洁灌肠治疗极低出生体质量儿喂养不耐受65例分析[J].浙江中西医结合杂志,2015, 25(3):273-274.
[7]Mihatsch WA,Franz AR,Lindner W,et al.Meconium passage in extremely low birthweight infants and its relation to very early enteral nutrition[J].Acta Paediatr,2001,90(4):409-411.
[8]张志群,李惠萍,朱建幸.静脉小剂量红霉素防治早产儿喂养不耐受的meta分析[J].中国循证儿科杂志,2009,4(3):280-288.
[9]Reddy PS,Deorari AK,Bal CS,et al.A double-blind placebo controlled study on prophylactic use of cisapride on feed intolerance and gastric emptying in preterm neonates[J].Indian Pediatr,2000, 37(8):837-844.
[10]Kohl M,Wuerdemann I,Clemen J,et al.Cisapride may improve feeding tolerance of preterm infants:a randomized placebo-controlled trial[J].Biol Neonate,2005,88(4):270-275.
[11]Shulman RJ,Boyle JJ,Colletti RB,et al.An updated medical position statement of the NorthAmerican Society for Pediatric Gastroenterology and Nutritian[J].J Pediatr Gastroenterol Nutr,2000,31 (3):1232-1233.
[12]Shim SY,Kim HS,Kim DH,et al.Induction of early meconium evacuation promotes feeding tolerance in very low birth weight infants[J].Neonatology,2007,92(1):67-72.
[13]孙鸿燕,董文斌,张连玉,等.人工通便对早产儿喂养不耐受及血清胃泌素水平的影响[J/CD].中华妇幼临床医学杂志(电子版), 2010,6(3):192-194.
[14]Sari FN,Dizdar EA,Oguz S,et al.Oral probiotics:Lactobacillus sporogenes for prevention of necrotizing enterocolitis in very low-birth weight infants:a randomized,controlled trial[J].Eur J Clin Nutr,2011,65(4):434-439.
Effect of probiotics supplementation combined with warm saline enema on the improvement of feeding intolerance in premature infants.
ZENG Dan-dan,SHI Jing-yi,CHEN Yi-huan,LI Na,FENG Qi-jun,HUANG Qi-wei.Department of Neonatology,Children's Hospital of Shanghai,Children's Hospital Affiliated to Shanghai Jiao Tong University,Shanghai 200040,CHINA
ObjectiveTo investigate the effect of probiotics supplementation combined with warm saline enema on the improvement of feeding intolerance in premature infants.MethodsOne hundred and thirty-three premature infants,admitted from the January,2014 to December,2014,were randomly divided into four groups:group A (the control group,without intervention,33 cases),group B(warm saline enema,34 cases),group C(probiotics supplementation,35 cases),and group D(warm saline enema combined with probiotics supplementation,31 cases).The times for meconium emptying,jaundice disappearance,regaining birth weight,and reaching 100 kcal/kg daily through enteral feeding were recorded in the four groups to evaluate the improvement in feeding tolerance.The complications in every group were calculated.ResultsThe times for meconium emptying,jaundice disappearance,regaining birth weight,and reaching 100 kcal/kg daily through enteral feeding in group D were shorter than those in the other 3 groups,with statistically significant differences(P<0.05).ConclusionIntervention by probiotics supplementation combined with saline enema can reduce significantly the incidence of feeding intolerance in premature infants,which is safe and effective.
Feeding intolerance;Enema;Probiotics;Premature infants
R723
A
1003—6350(2015)24—3634—03
10.3969/j.issn.1003-6350.2015.24.1311
2015-07-23)
黄绮薇。E-mail:huangqw@shchildren.com.cn

