青藏高原东部橐吾属植物的花性分配和雌全同株系统
谢田朋,杜国祯,卜海燕
(兰州大学草地农业生态系统国家重点实验室,甘肃 兰州 730020)
青藏高原东部橐吾属植物的花性分配和雌全同株系统
谢田朋,杜国祯*,卜海燕
(兰州大学草地农业生态系统国家重点实验室,甘肃 兰州 730020)
雌全同株是指同一植株内同时拥有雌花和两性花的性系统,至今对该性系统的适应性研究较少。本文以青藏高原东部常见的3种橐吾属植物为材料,调查植株内头状花序的位置,植株高度和个体叶片去除对花性分配的影响。结果表明,3种橐吾均自交不亲和,并且花部特征存在显著的花序轴内变异,无论总状花序基向式发育还是顶向式发育,均表现出早期花有较大的花展示和偏雌的性分配,晚期花拥有较多胚珠和偏雄的性分配。较高的个体拥有较大的花展示,并在雌性功能上投入更多;被去除叶片的个体的花展示和雌花生物量投入均明显下降。然而,植株高度和叶片去除并不会改变花特征在花序内的变异。分析认为橐吾属植株的雌全同株系统的进化意义为资源的灵活分配和吸引传粉者,但无法排除减少雌雄功能冲突的可能。
舌状花;雌全同株;橐吾属;性分配;性系统
自然界中,有花植物的性系统种类繁多,尽管植物性系统的多样性和进化受到广泛关注,但至今为止,关于雌全同株性系统的相关报道相对较少[1-3]。根据Yampolsky 和 Yampolsky[4]对121492种被子植物调查的数据,80%以上的植物种都是雌雄联合的单态性系统,其中,雌全同株物种仅仅约占2.8%,且局限在少数几个科内,而菊科中雌全同株最为常见[5]。雌全同株性系统的花部特征为,两性的盘状花被雌性的边缘花所包围,形成一个完整的头状花序,每朵小花均有一个胚珠,而整个头状花序在功能上相当于一朵大花[6],可以作为一个授粉单位[7]。
由于同一个体内可以产生两种类型的花(雌花和两性花),因而可以推测,植株能根据内因(植株大小,高度,花序部位等)和外因(水分,养分,光照条件等)的不同而适应性调节内部资源两个花性别的比例,尽管这种现象已经在雌雄同株异花和雄全同株系统中有所发现[8-9],但在雌全同株的紫菀属(Aster)[1]和一枝黄花属(Solidago)[2]的野外调查和温室实验中,并没有发现资源可以随内因或外因的改变而灵活分配到两种花类型中,这似乎暗示了雌全同株系统的选择优势并非资源分配的灵活机动性。因此,关于雌全同株的选择优势,前人提出了其他一些观点,如提高异交率,避免雌雄功能冲突,昆虫捕食作用和吸引传粉者等[1-2]。然而,关于雌全同株的研究数据相对较少,尚待深入研究。
基于资源在植物繁殖分配中的复杂性,在性单态系统中,人们常常关注于雌雄同体植物的雄性[10-12]和雌性[13-18]功能在个体内或花序内空间结构上的变异。目前已经发现花序内花之间的地位是不平等的,存在位置效应,那些在时间水平和空间结构上占有优势的花(开花较早或靠近母体资源库的花)获得的资源量相对较多,表现出较大的花展示[10,15],较长的花期[16,19],较高的坐果率、结实率和种子重[14-15,17-18,20-21]。这种差异常被解释为不同优势部位对花粉输出和果实成熟的反应。
关于花特征以及繁殖成功的花序内变异的研究,多数都是在雌雄同体和雄全同株植物中进行[20,22-24],例如在雄全同株的茄属植物中,两性花在近营养端较多,而雄花在末梢部位更多[23]。然而以雌全同株植物为研究对象的报道较少,目前在紫菀属[1]和一枝黄花属[2]中没有发现花序部位对花性比例的影响,或影响甚微。而Zhang等[3]对总状花序自上而下发展的黄帚橐吾(Ligulariavirgaurea)的研究发现,其头状花序内花性比例存在显著的位置效应,顶部头状花序具有较多雌花,而基部头状花序两性花较多。
基于以上分析,本研究拟通过对青藏高原东部常见的3种橐吾属植物的研究,来更好地认识雌全同株系统的进化意义。通过2010年的野外随机调查和2011年的野外控制实验,调查植株高度,营养体叶片去除,以及花序轴部位对橐吾属植物花部特征的影响。本文拟解决的问题为:1)花展示,胚珠数,雌花的比例和生物量是否会在总状花序内不同头状花序部位间变化。2)植株高度和营养体叶片去除是否影响花展示,胚珠数,雌花的比例和生物量。3)橐吾属雌全同株系统的选择优势,特别探讨资源的灵活分配,提高异交率,避免雌雄功能冲突和吸引传粉者的可能性。
1 材料与方法
1.1 实验地概况
青藏高原高寒草甸分布区域广阔,区域气候与人类活动干扰差异较大[25-27]。本实验地点位于甘肃省甘南藏族自治州合作市的兰州大学高寒草地生态系统定位研究站(102°53′ E, 34°55′ N, 海拔2900 m),该地区年均气温2.0℃, 全年在12,1和2月气温最低, 平均气温-8.9℃, 在6,7和8月气温最高, 平均气温11.5℃。年均降雨量550 mm。为典型的高寒草甸植被类型。
1.2 实验材料
本研究中涉及到的3种橐吾均分布于甘南地区,属于菊科橐吾属草本植物。其中掌叶橐吾(Ligulariaprzewalskii)生长在海拔1700~3200 m的林缘、林下,为一年生物种,只进行有性繁殖,其总状花序为自下而上的顶向式发育;箭叶橐吾(Ligulariasagitta)生长在海拔2500~3700 m的退化草场、路边、地埂、河沟等临时生境,为多年生物种,除了有性繁殖外,还可以通过克隆生长进行繁殖,其总状花序为自下而上的顶向式发育;黄帚橐吾大量分布于海拔2700~3800 m的草地、坡地和退化草场,为多年生物种,除了有性繁殖外,也可以进行克隆生长(表1)。3种橐吾属植物在营养生长期间,植物体由发达的根系和生于短根茎上的数片簇生叶构成;有性生殖时由簇生叶中抽出单一的地上茎[28]。3种橐吾的花序轴是由几个至数十个头状花序沿总状花序轴辐射状排列而成的总状花序顶生, 每个头状花序由若干个管状两性花和外沿一圈舌状雌花组成, 每个小花均产生1个胚珠,其中舌状花的舌片为狭长带状,黄色艳丽。3种橐吾均属于虫媒传粉植物,蜂类、蝇类、蝶类、蛾类均可以进行传粉。本实验中的样本均取自实验站内随机播撒的种子形成的样地,实验时间为2010年7-8月和2011年7-8月。

表1 3种橐吾有性繁殖特征
平均值±SE,所用数据为2011年实验数据。Mean±SE, the data from the experiments in 2011.
1.3 实验方法
为调查花部特征在花序轴内的变异,本研究在2010年7月的盛花期,对3种橐吾进行随机调查,每个物种调查30株。根据总状花序上头状花序的数目,按比例等分成3个长度段,然后在每个部位采集2朵完全开放的头状花序进行测定。采用游标卡尺记录每个头状花序的舌状花长度,舌状花数目,管状花数目,小花总数,然后将舌状花和管状花分别在80℃烘箱内烘干24 h后,用1/10000电子天平进行称量。小花总数=舌状花数+管状花数,舌状花数目比例=舌状花数目/小花总数×100%,舌状花生物量比例=舌状花生物量/(舌状花生物量+管状花生物量)×100%。
为了进一步研究植株高度、营养体叶片去除对3种橐吾花特征的影响,在2011年6月底(即花期到来之前),在相同样地对3种橐吾进行处理。每个物种选择30组即将开花的个体,每组在个体高度和头状花序数目上非常相近,其中1株用剪刀去除所有叶片(由于掌叶橐吾只进行有性繁殖,为了保证繁殖体正常开花,对每个叶片去除一半),另1株作为对照。选择个体时特意将高低个体各选择一半,根据所有组的个体高度,将其划分为高个体和低个体,其中黄帚橐吾株高≥40 cm为高个体,<35 cm为低个体;箭叶橐吾株高≥65 cm为高个体,<60 cm为低个体;掌叶橐吾株高≥55 cm为高个体,<50 cm为低个体。待盛花期到来,对每个植株的每个部位采集2朵完全盛开的头状花序进行测定,词的指标和计算方法与2010年一致。
为了调查3种橐吾自交是否亲和,在相同样地对每种橐吾随机选取10株进入蕾期的个体,然后用白色透明透气尼龙布袋将整个总状花序套住,并从下面用细绳封住,确保传粉者不会接触到任何头状花序。待花期到来,用毛笔蘸上同株不同头状花序的花粉对每个头状花序中的小花柱头进行人工授粉,然后再套袋,直到花期结束。8月底-9月初的果期到来时,收集每株所有的头状花序并装入信封,带回实验室调查是否结实。
1.4 统计方法
采用SPSS 16.0(SPSS Inc., Chicago, IL)进行统计分析。2010年的数据采用One-way ANOVA 分析方法检测3种橐吾的花序部位对舌状花长度、小花数、舌状花比例、舌状花生物量比例的影响。2011年的数据采用其中Three-way ANOVA分析方法检测3种橐吾的花序部位、植株高度、营养体叶片去除对舌状花长度、小花数、舌状花比例、舌状花生物量比例的影响。采用Tukey’s检验分析平均值之间的差异性。
2 结果与分析
2.1 自交是否亲和
由于3种橐吾的果实均属于瘦果,是否形成果实只需要用手指轻捏果实中央,如果产生果实,则手感坚实饱满,如果败育,则瘪陷下去。通过对3种橐吾的套袋实验后的果实鉴别,发现个体花序轴内的头状花序间的相互授粉并不能使其在果期形成果实,因此,3种橐吾均属于自交不亲和物种。
2.2 花序内花特征的位置效应
从表2得知,3种橐吾的花部特征在总状花序内不同部位头状花序间存在规律性变化。无论是花序轴基向式发育的黄帚橐吾,还是顶向式发育的箭叶橐吾和掌叶橐吾,舌状花花瓣长度均表现为早期花>晚期花的变化趋势,且差异显著(P<0.05)。单位头状花序内的小花总数表现为晚期花>早期花的变化趋势,且在箭叶橐吾中差异显著(P<0.05),说明开花较晚的头状花序会产生较多的胚珠;单位头状花序内舌状花比例呈早期花>晚期花的变化趋势,且差异显著(P<0.05),舌状花生物量比例也呈早期花>晚期花的变化趋势,且在黄帚橐吾和掌叶橐吾中差异显著(P<0.05)。由此可知,3种橐吾在花序轴内存在显著的位置效应,较早开花的头状花序拥有较大的花展示,并且有偏雌的性分配;而较晚开花的头状花序拥有较多的胚珠,有偏雄的性分配。

表2 3种橐吾的花部特征在花序内不同部位头状花序间的变化
根据Tukey’s检验,小写字母不同表示差异显著(P<0.05)。The different letters mean significantly different (P<0.05) according to Tukey’s tests.
2.3 株高和叶片去除对花特征的影响
植株高度对黄帚橐吾的舌状花长度(F=20.095,P<0.0001)、舌状花比例(F=5.117,P=0.024)、舌状花生物量比例(F=5.156,P=0.021)均有显著影响(图1);对箭叶橐吾的单位头状花序内小花数(F=34.733,P<0.0001)和舌状花比例(F=9.712,P=0.002)有显著影响(图2);对掌叶橐吾的单位头状花序小花数(F=7.105,P=0.008)和舌状花比例(F=4.386,P=0.037)有显著影响(图3)。除了箭叶橐吾的舌状花比例有低个体大于高个体的变化趋势外(图2),其余指标均表现为高个体大于低个体的变化趋势(图1~3),说明较高的个体会有更大的花展示(较长的舌状花舌片),产生更多的雌花和更大的雌花生物量投入。
尽管叶片去除对箭叶橐吾的任何指标均无显著影响(P>0.05),但对黄帚橐吾的舌状花生物量比例(F=12.925,P<0.0001)影响显著,对掌叶橐吾的舌状花长度(F=10.550,P=0.001)和舌状花生物量比例(F=14.441,P<0.0001)有显著影响。表现为叶片去除个体小于对照个体的变化趋势(图1,图3),说明被去除叶片的个体的花展示和雌花生物量投入均明显下降,尤其是对只能通过有性繁殖繁育后代的橐吾物种。

图1 不同因素下黄帚橐吾花部特征的变化Fig.1 Variation in flower traits of L. virgaurea under different factors根据Tukey’s检验,小写字母不同表示差异显著(P<0.05)。Bars sharing the different letter are significantly different (P<0.05) according to Tukey’s tests.1:高个体+叶片去除 Taller individuals+leaves removal;2:高个体对照 Taller individuals CK;3:低个体+叶片去除 Lower individuals+leaves removal;4:低个体对照 Lower individuals CK.下同The same below.
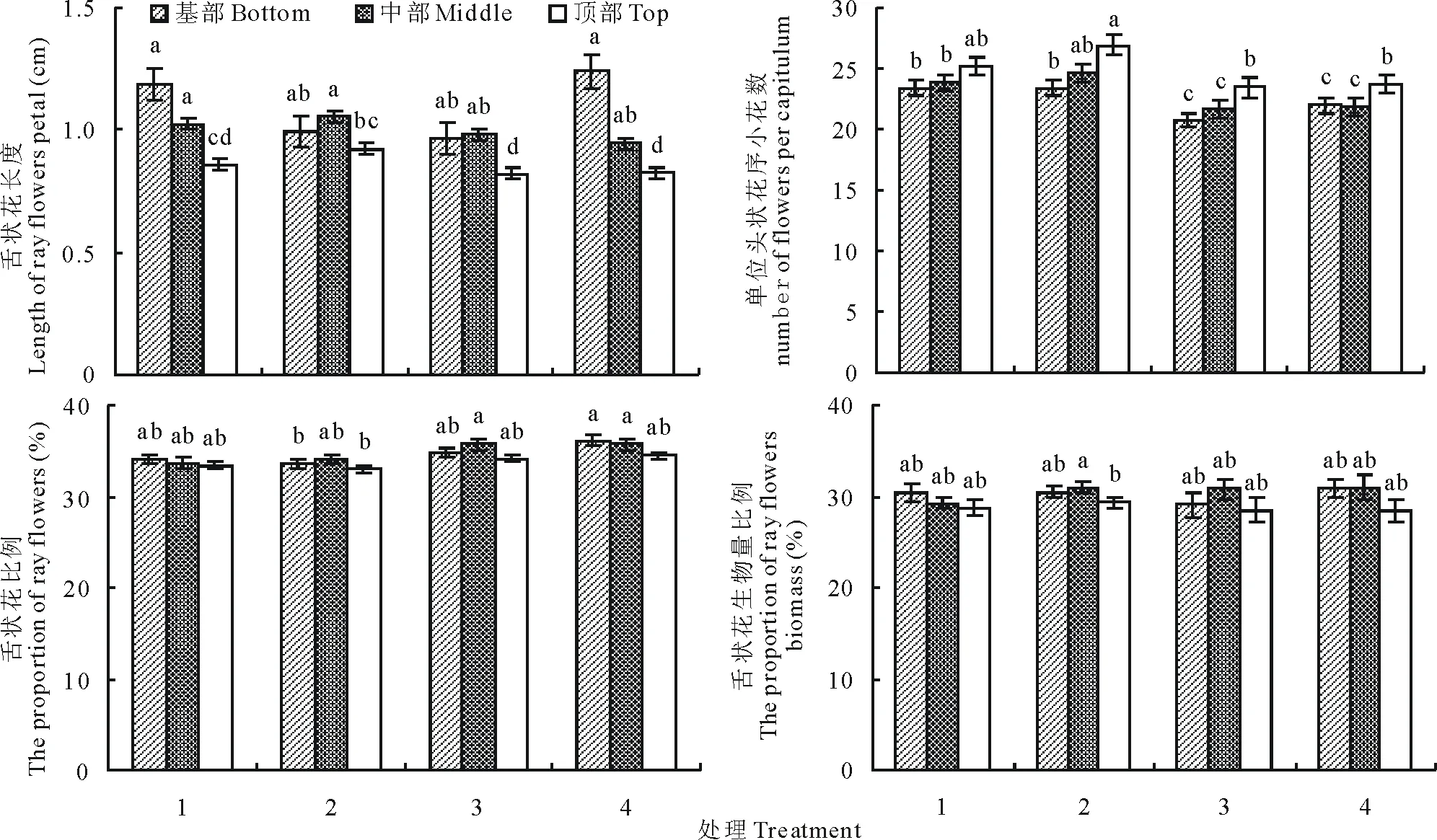
图2 不同因素下箭叶橐吾花部特征的变化Fig.2 Variation in flower traits of L. sagitta under different factors

图3 不同因素下掌叶橐吾花部特征的变化Fig.3 Variation in flower traits of L. przewalskii under different factors
尽管植株高度和营养体的叶片去除会影响3种橐吾的花部特征,但是并不能改变3种橐吾的花特征在花序轴内的变异,与2010年的随机调查结果一样(表2),头状花序部位对黄帚橐吾的舌状花长度(F=4.860,P=0.008)、舌状花比例(F=8.073,P<0.0001)、舌状花生物量比例(F=7.332,P=0.001)具有显著影响;对箭叶橐吾的舌状花长度(F=5.791,P=0.003)、小花数(F=13.932,P<0.0001)、舌状花生物量比例(F=3.392,P=0.035)有显著影响;对掌叶橐吾的舌状花长度(F=63.093,P<0.0001)、小花数(F=13.231,P<0.0001)、舌状花比例(F=16.060,P<0.0001)、舌状花生物量比例(F=35.842,P<0.0001)均有显著影响。无论花序轴是基向发育还是顶向发育,小花数均表现为晚期花大于早期花的变化趋势(图2,3),而舌状花长度,舌状花比例,舌状花生物量比例均表现出早期花大于晚期花的变化趋势(图1~3),说明较早开花的头状花序拥有较大的花展示,并且有偏雌的性分配;而较晚开花的头状花序拥有较多的胚珠,有偏雄的性分配。
3 讨论
3.1 花特征的花序内变异
本结果表明,3种橐吾的花部特征存在显著的花序内变异,由于无论是花序轴自上而下发展的黄帚橐吾,还是自下而上发展的箭叶橐吾和掌叶橐吾,较早开花的头状花序总是表现出较大的花展示和偏雌的性分配,而较晚开花的头状花序则拥有较多的胚珠数和偏雄的性分配,这说明头状花序的开花时间比其所在的花序轴部位更能解释花特征的花序内变异,这可能是因为开花较早的花比开花较晚的花有更高的光合产物利用率[29]。尽管对于雌全同株的16种紫菀属物种[1]和6种一枝黄花属物种[2]的野外调查和温室实验中,并没有发现花序内花性分配较大或较一致性的变异,这可能是因为雌花的外围位置影响了它的数量。由于两属的植物都不能随环境变化而改变花性比例,因此头状花序内的变异也受到一定限制。但是,这可能是某些属植物的特性。例如与橐吾属同样为菊科千里光族款冬亚族的款冬属物种Tussilagofarfar中也发现了雌花在花序内显著的变异[30]。
关于花序内变异的假说主要有资源竞争[17,20-21],结构效应[15,31]和花粉限制[32-33]三种。Zhang等[3]通过对黄帚橐吾顶部头状花序的去除实验,证明资源竞争是影响其花序内坐果率与结实率变化的主要因素。本实验中发现植株大小(株高)和营养体限制(叶片去除)并没有改变3种橐吾花特征的花序内变异,一方面可能是因为这些处理并没有直接改变繁殖结构,植株水平上的资源限制可以使其在整体上调整资源分配,花序结构的完整性使植株依旧按照固有模式分配资源;另一方面,本研究采用的2种橐吾都具有克隆繁殖的习性,可以通过分株与基株间资源的共享来消弱叶片去除所带来的负面影响。
3.2 雌全同株的选择优势
3.2.1 资源的灵活分配 对于雌雄同体的植物来说,其中一个选择优势就是两种花类型可以把资源灵活的分配到雌性和雄性功能[8-9]。在雌雄同株异花和雄全同株系统中,人们发现资源条件较好的情况下,植株更多的偏向雌性功能[29,34]。本研究同样发现了这一现象:较高的个体会有更大的花展示(较长的舌状花瓣),产生更多的雌花和雌花生物量投入;叶片被去除的个体的花展示和雌花生物量投入均明显下降。尽管对于雌全同株的16种紫菀属物种[1]和6种一枝黄花属物种[2]的野外调查和温室实验中,并没有发现资源可以灵活分配到两种花类型中的证据,但这些研究的一个缺陷就是,单纯的用雌花数量代表雌性功能的总投入,这很有可能掩盖一些真相。因此,本实验中关于雌花生物量投入的描述弥补了前人研究中的不足。一般认为,雌雄同体的植物之所以在资源条件较好的情况下偏雌性分配,是因为雌性为产生果实或种子更易受到资源的限制,而雄性更易受花粉输出的限制[35]。
3.2.2 提高异交率与减少雌雄功能间的冲突 Willson[9]认为,如果传粉者先访问外围的舌状花,然后再访问中心的管状花,那么外围的舌状花可以促进异交。对于自交亲和的物种欧洲千里光(Seneciovulgaris),舌状花的确有更高的异交率[36]。然而在自交不亲和的橐吾属中,传粉者似乎并没有优先访问外围花的习惯,因此舌状花在提高异交率上意义不大。例如,Collin 和 Shykoff[37]在对石竹樟子松(Dianthussylvestris)的研究中发现,在雌花两性花同株的植株上反而是两性花的异交率较高, 原因是每个小花都是单独的传粉单位,并且两性花比雌花更有吸引力。
虽然提高异交率和避免雌雄功能干扰一般很难被区分开[38],但研究表明,植物的性功能在时间和空间上的分离并非为了提高异交率,而是为了避免雌雄功能间的冲突和提高传粉的精确度[5]。在自交不亲和物种中,所有小花都是异交的,所以自体授粉不会产生后代。正如通过对比部分紫菀属和一枝黄花属物种的异交花粉成功率和自体受粉后再进行异交授粉的成功率,发现自身花粉的确干扰了外来花粉的正常结实[1-2]。在3种橐吾属植物中,边缘的舌状花与雌蕊首先成熟,其柱头先于管状花的花粉成熟时伸出,从减少雌雄功能冲突的角度来说,雌性先熟比雄性先熟更有效[39],因为雌花不产生花粉,而两性花即产生雌蕊又产生花粉。
3.2.3 传粉者吸引 边缘花的舌片可以增加头状花序对传粉者的吸引力。在其他菊科植物中,有舌片的基因型比无舌片的基因型具有更高的异交率,这可能是由于前者能吸引更多传粉者[40],当然,这种解释只适用于虫媒传粉的植物。本研究中的3种橐吾物种均属于虫媒植物,并且在黄帚橐吾中,被去除了舌片的个体,访花率明显下降。这暗示了黄帚橐吾雌花的舌片作为吸引传粉者的重要性。
[1] Bertin R I, Kerwin M A. Floral sex ratios and gynomonoecy inAster(Asteraceae). American Journal of Botany, 1998, 85: 235-244.
[2] Bertin R I, Gwisc G M. Floral sex ratios and gynomonoecy inSolidago(Asteraceae). Biological Journal of the Linnean Society, 2002, 77: 413-422.[3] Zhang G F, Xie T P, Du G Z. Variation in floral sex allocation, female success, and seed predation within racemiform synflorescence in the gynomonoeciousLigulariavirgaurea(Asteraceae). Journal of Plant Research, 2012, 125: 527-538.
[4] Yampolsky C, Yampolsky H. Distribution of sex forms in the phanerogamic flora. Bibliotheca Genetica, 1922, 3: 1-62.
[5] Lu Y, Huang S Q. Adaptive advantages of gynomonoecious species. Acta Phytotaxonomica Sinica, 2006, 44(2): 231-239.
[6] Leppik E E. The evolution of capitulum types of the Compositae in the light of insect-flower interaction. In: Heywood V H, Harbone J B, Turner B L. The Biology and Chemistry of the Compositae[M]. London: Academic Press, 1977: 61-89.
[7] Mani M S, Saravanan J M. Pollination Ecology and Evolution in Compositae (Asteraceae)[M]. New Hampshire: Science Publishers, 1999.
[8] Charnov E L, Bull J. When is sex environmentally determined. Nature, 1977, 266: 828-830.
[9] Willson M F. Plant Reproductive Ecology[M]. New York: John Wiley and Sons, 1983.
[10] Vallius E. Position-dependent reproductive success of flowers inDactylorhizamaculate(Orchidaceae). Functional Ecology, 2000, 14: 573-579.[11] Hiraga T, Sakai S. The effects of inflorescence size and flower position on biomass and temporal sex allocation inLobeliasessiliflora. Plant Ecology, 2007, 188: 205-214.
[12] Zhao Z G, Meng J L, Fan B L,etal. Reproductive patterns within racemes in protandrousAconitumgymnandrum(Ranunculaceae): potential mechanism and among-family variation. Plant Systematics and Evolution, 2008, 273: 247-256.
[13] Ashman T L, Hitchens M S. Dissecting the causes of variation in intra-inflorescence allocation in a sexually polymorphic speciesFragariavirginiana(Rosaceae). American Journal of Botany, 2000, 87: 197-204.
[14] Buide M L. Intra-inflorescence variation in floral traits and reproductive success of the hermaphroditeSileneacutifolia. Annals of Botany, 2004, 94: 441-448.
[15] Buide M L. Disentangling the causes of intra-inflorescence variation in floral traits and fecundity in the hermaphroditeSileneacutifolia. American Journal of Botany, 2008, 95: 490-497.
[16] Guitián J, Navarro L. Allocation of reproductive resources within the inflorescences ofPetrocoptisgrandiflora(Caryophyllaceae). Canadian Journal of Botany, 1996, 74: 1482-1486.
[17] Medrano M, Guitián P, Guitián J. Patterns of fruit and seed set within inflorescences ofPancratiummaritimum(Amaryllidaceae): nonuniform pollination, resource limitation, or architectural effects. American Journal of Botany, 2000, 87: 493-501.
[18] Susko D J, Lovett-Doust L. Patterns of seed mass variation and their effects on seeding traits inAlliariapetiolata(Brassicaceae). American Journal of Botany, 2000, 87: 56-66.
[19] Ishii H S, Sakai S. Temporal variation in floral display size and individual floral sex allocation in racemes ofNarthecimasiaticum(Liliaceae). American Journal of Botany, 2002, 89: 441-446.
[20] Guitián J, Guitián P, Medranol M. Causes of fruit set variation inPolygonatumodoratum(Liliaceae). Plant Biology, 2001, 3: 637-641.
[21] Obeso J R. Seed mass variation in the perennial herbAsphodelusalbus: sources of variation and position effect. Oecologia, 1993, 93: 571-575.[22] Diggle P K, Miller J S. Architectural effects mimic floral sexual dimorphism inSolanum(Solanaceae). American Journal of Botany, 2004, 91: 2030-2040.
[23] Miller J S, Diggle P K. Diversification of andromonoecy inSolanumsectionLasiocarpa(Solanaceae): the roles of phenotypic plasticity and architecture. American Journal of Botany, 2003, 90: 707-715.
[24] Narbona E, Dirzo R. Experimental defoliation affects male but not female reproductive performance of the tropical monoecious plantCrotonsuberosus(Euphorbiaceae). Annals of Botany, 2010, 106: 359-369.
[25] Lin L, Li Y K, Zhang F W,etal. A study on carbon storage administration in alpineKobresiahumilismeadow in relation to influence of human acitivity. Acta Prataculturae Sinica, 2013, 22(1): 308-314.
[26] Wang J B, Zhang D G, Cao G M,etal. Regional characteristics of the alpine meadow degradation succession on the Qinghai-Tibetan Platean. Acta Prataculturae Sinica, 2013, 22(2): 1-10.
[27] Chen W Y, Zhang J, Qi D C,etal. Desertification dynamic change trend and quantitative analysis of driving factors of alpine meadow in Maqu County in the First Meander of the Yellow River. Acta Prataculturae Sinica, 2013, 22(2): 11-21.
[28] Ma R J, Du G Z, Lu B R,etal. Reproductive modes of threeLigulariaweeds (Asteraceae) in grasslans in Qinghai-Tibet Plateau and their implications for grassland management. Ecology Research, 2006, 21: 246-254.
[29] Bertin R I. The ecology of sex expression in red buckeye. Ecology, 1982, 63: 445-456.
[30] Torices R, Méndez M, Gómez J M. Where do monomorphic sexual systems fit in the evolution of dioecy? Insights from the largest family of Angiosperms. New Phytologist, 2011, 190: 238-248.
[31] Diggle P K. Architectural effects and the interpretation of patterns of fruit and seed development. Annual Review of Ecology and Systematics, 1995, 26: 531-552.
[32] Berry P E, Calvo R N. Pollinator dependence and position dependent fruit set in the high Andean orchidMyrosmodescochleare(Orchidaceae). Plant Systematics and Evolution, 1991, 174: 93-101.
[33] Brunet J, Charlesworth D. Floral sex allocation in sequentially blooming plants. Evolution, 1995, 49: 70-79.
[34] Emms S K. Andromonoecy inZigadenuspaniculatus(Liliaceae): spatial and temporal patterns of sex allocation. American Journal of Botany, 1993, 80: 914-923.
[35] Lloyd D G. Sexual strategies in plants. I. An hypothesis of serial adjustment of maternal investment during one reproductive session. New Phytologist, 1980, 86: 69-79.
[36] Abbott R J, Schmitt J. Effect of environment on percentage female ray florets per capitulum and outcrossing potential in a self-compatible composite (SeneciovulgarisL. var.hibernicusSyme). New Phytologist, 1985, 101: 219-229.
[37] Collin C L, Shykoff J A. Outcrossing rates in the gynomonoecious-gynodioecious speciesDianthussylvestris(Caryophyllaceae). American Journal of Botany, 2003, 90: 579-585.
[38] Bertin R I, Newman C M. Dichogamy in angiosperms. The Botanical Review, 1993, 59: 112-152.
[39] Zhang D Y. Plant Life-history Evolution and Reproductive Ecology[M]. Beijing: Science Press, 2003.
[40] Marshall D F, Abbott R J. Polymorphism for outcrossing frequency at the ray floret locus inSeneciovulgarisL. III. Causes. Heredity, 1984, 53: 145-149.
参考文献:
[5] 卢洋, 黄双全. 论雌花两性花同株植物的适应意义. 植物分类学报, 2006, 44(2): 231-239.
[25] 林丽, 李以康, 张法伟, 等. 人类活动对高寒矮嵩草草甸的碳容管理分析. 草业学报, 2013, 22(1): 308-314.
[26] 王建兵, 张德罡, 曹广民, 等.青藏高原高寒草甸退化演替的分区特征. 草业学报, 2013, 22(2): 1-10.
[27] 陈文业, 张瑾, 戚登臣, 等. 黄河首曲-玛曲县高寒草甸沙化动态演变趋势及其驱动因子定量分析. 草业学报, 2013, 22(2): 11-21.
[39] 张大勇. 植物生活史进化与繁殖生态学[M]. 北京: 科学出版社, 2003.
Floral sex allocation and gynomonoecy ofLigularia(Asteraceae) in the eastern Qinghai-Tibet Plateau
XIE Tian-Peng, DU Guo-Zhen*, BU Hai-Yan
StateKeyLaboratoryofGrasslandandAgro-Ecosystems,LanzhouUniversity,Lanzhou730020,China
Gynomonoecy is the sexual system in which female and bisexual flowers occur on the same plant. Little attention has been paid to the adaptive significance of this sexual system. In this paper, we investigated 3 common species of the genusLigularia(Asteraceae) in the eastern part of the Tibetan Plateau and examined the effects of flower head position, plant height and leaf removal on floral sex allocation. The results showed that plants of these threeLigulariagenera were self-incompatible, and the intra-inflorescence variations in floral traits were significant. Regardless of whether the racemes developed from top to bottom or in the opposite direction, the early-formed flowers within a raceme were larger and displayed female-biased sex allocation. The later-formed flowers had more ovules and displayed a male-biased sex allocation. Taller plants have a lager flower display and invest more resources in the female state. Raceme size and investment in ray floret biomass were significantly decreased in plants with leaves removed. However, plant height and leaf removal did not change the variation of floral traits within inflorescences. The adaptive significance of gynomonoecy inLigularialies in permitting flexibility in allocation of resources to male and female functions. Ecologically this behavior may link seed set to resource availability and may assist with attracting pollinators, and may also reduce conflict between male and female functions.
gynomonoecy; ray flowers;Ligularia; sex allocation; sexual systems
10.11686/cyxb20150520
http://cyxb.lzu.edu.cn
2014-03-04;改回日期:2014-03-31
国家自然科学基金(41171214,41201285,41171046)资助。
谢田朋(1985-),女,山东蓬莱人,博士。E-mail: xietianpeng@163.com *通讯作者Corresponding author. E-mail: guozdu@lzu.edu.cn
谢田朋, 杜国祯, 卜海燕. 青藏高原东部橐吾属植物的花性分配和雌全同株系统. 草业学报, 2015, 24(5): 167-174.
Xie T P, Du G Z, Bu H Y. Floral sex allocation and gynomonoecy ofLigularia(Asteraceae) in the eastern Qinghai-Tibet Plateau. Acta Prataculturae Sinica, 2015, 24(5): 167-174.
——植物学教材质疑(六)

