不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响
姚佳,刘信宝,崔鑫,李志华
(南京农业大学动物科技学院,江苏 南京 210095)
不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响
姚佳,刘信宝,崔鑫,李志华*
(南京农业大学动物科技学院,江苏 南京 210095)
采用盆栽法研究不同浓度NaCl(0, 50, 100, 150, 200, 250, 300 mmol/L)胁迫对扁蓿豆苗期有机渗透调节物质及光合参数的影响。结果表明,相同胁迫天数下,随盐浓度的升高。扁蓿豆可溶性蛋白含量、可溶性糖含量呈降低趋势,脯氨酸含量呈升高趋势。各个观测期和浓度之间存在差异,胁迫第7 和14天,300 mmol/L浓度下可溶性蛋白含量显著低于对照(P<0.05);胁迫第7,14和21天,50~100 mmol/L浓度下,可溶性糖含量明显高于对照,但胁迫第28天,250~300 mmol/L浓度处理显著低于对照(P<0.05)。胁迫第7天,150~300 mmol/L浓度处理、胁迫第14天,200~300 mmol/L浓度处理、胁迫第21天,250~300 mmol/L浓度处理扁蓿豆脯氨酸含量均分别显著高于对照及其他处理(P<0.05)。可见,盐胁迫下,扁蓿豆产生的3 种渗透调节物质调节方式不同,盐胁迫对扁蓿豆幼苗的抑制程度与盐浓度、胁迫时间呈正比。不同的胁迫浓度和胁迫时间,扁蓿豆3 个观测期光合参数变化不尽相同。胁迫第14天,叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)随盐浓度的升高呈先上升后降低的趋势。50~100 mmol/L浓度处理Pn、Tr和Gs显著高于对照,但300 mmol/L浓度处理Pn和Tr显著低于对照及其他处理(P<0.05)。胁迫第28天,4 个光合参数随盐浓度的升高而降低。叶片气孔限制值(Ls)和水分利用效率(WUE)在胁迫14 和28 d时,变化规律一致,随盐浓度的升高呈上升趋势。
扁蓿豆;盐胁迫;光合生理;渗透调节
土壤盐渍化严重影响了农业生产和生态环境,已是一个全球性难题[1]。我国盐渍化土地具有分布广,面积大的特点,盐渍化面积高达0.35 亿hm2[2],如果能进行科学合理的开发和利用,将会带来巨大的社会、经济和生态价值[3]。顾峰雪等[4]多年研究证实,以生物措施对盐渍化的治理最为有效且可治本。在盐渍地上种植碱茅(Puccinelliadistans)能够明显改善盐渍化土壤的结构,降低土壤表层盐分含量,提高土壤的保肥和供肥能力,促进后茬牧草的生长与优质高产[5]。李富宽等[6]研究发现盐渍化土地上种植苜蓿(Medicagosativa)可增加土壤氮肥,获得高产牧草。赵芸晨和秦嘉海[7]研究老芒麦(Elymussibiricus)、扁穗冰草(Agropyroncristatum) 两种优质牧草对河西走廊盐渍化土壤改土培肥的效应,得出两种牧草对盐渍化土壤均有一定的改良效果。
扁蓿豆(Melilotoidesruthenica)为多年生豆科苜蓿属植物,又名花苜蓿、野苜蓿、扁豆草等,具有营养价值高,适口性好,耐寒,耐旱,耐贫瘠,耐盐碱等优点,是一种优质的蛋白质饲料[8]。在黑钙土、栗钙土和中度盐碱土上均能良好生长。近年来,有关扁蓿豆的研究已取得了一定的进展,前人对扁蓿豆的研究主要集中于种质资源和生态型的研究,但对扁蓿豆抗性生理的研究还十分薄弱,且集中于抗寒、抗旱生理的研究[9]。李鸿雁等[10]提出遗传多样性的量化与分类是收集和利用种质资源的重要前提,运用SSR和ISSR技术分析了3种扁蓿豆种质资源的遗传多样性。李志勇[11]和宁红梅[12]通过研究扁蓿豆种质资源遗传多样性,揭示了扁蓿豆种质资源的遗传多样性水平及遗传结构,并对野生扁蓿豆种质资源进行了鉴定与评价。张宇等[13]从基因水平揭示了扁蓿豆的抗寒机理,为苜蓿属牧草的抗寒育种研究提供理论依据。石凤翎等[14]通过分析扁蓿豆叶片的抗旱形态解剖结构,筛选出抗旱性较强的品种。崔秀妹等[15]在前人的基础上研究不同水分梯度胁迫下,外施水杨酸对扁蓿豆抗旱的调控作用。盐胁迫可引起植物多方面的生理生化反应,如降低细胞水势,改变离子分配与运输,降低光合速率等。在盐碱胁迫下,植物体由于大量失水而产生渗透胁迫,植物细胞的渗透调节作用是植物适应环境, 提高抗性的基础[16]。光合作用是植物生长发育过程中物质和能量的来源,是植物生长发育的基础[17]。同时,一般认为渗透胁迫可能是盐胁迫抑制植物光合作用的原因之一,即盐胁迫导致叶片水势及气孔导度降低,阻碍CO2进入光合细胞,而抑制光合作用[18]。因此,研究盐害对扁蓿豆渗透调节及光合作用的影响对其抗盐性机理的深入研究具有重要意义。本试验在南京高温、高湿条件下就不同浓度NaCl对苗期扁蓿豆渗透调节物质及光合生理的影响进行了研究,初步探讨扁蓿豆的耐盐机制,旨在为扁蓿豆耐盐机制的深入研究提供基础数据,并为今后开发扁蓿豆种质资源应用于江苏沿海滩涂改良和利用提供理论参考。
1 材料与方法
1.1 试验地概况
盆栽试验于2013年5-7月在南京农业大学牌楼试验基地的大棚内进行。南京属亚热带季风湿润气候区,雨热同季,试验期间,大棚内月平均气温大于30℃,月平均湿度大于60%。
1.2 试验材料
扁蓿豆品种为‘土默特’,由中国农业科学院草原研究所提供。扁蓿豆种子硬实率较高,为了提高出苗率,播种前采用砂纸打磨的方法破除硬实,处理后扁蓿豆发芽率为93.41%。盆钵规格为上径35 cm×下径20 cm×高24 cm。培养基质为蛭石,维持植株生长的养分为1/2 Hoagland 营养液。所用盐处理为分析纯NaCl。
1.3 试验设计与方法
1.3.1 幼苗培养 2013年5月3日进行播种,在盆底垫两层纱布,确保基质不外渗,用台秤称取等量的蛭石装入盆钵中。选取大小均等,籽粒饱满的扁蓿豆种子进行播种,5次重复,共播种35 盆,每盆80 粒。隔天定量浇水,出苗两周后浇灌等量的1/2 Hoagland营养液,三叶龄间苗,每盆定苗40 株。
1.3.2 盐胁迫处理 于6月13日开始盐胁迫。盐浓度梯度为S0(0 mmol/L)、S50(50 mmol/L)、S100(100 mmol/L)、S150(150 mmol/L)、S200(200 mmol/L)、S250(250 mmol/L)、S300(300 mmol/L), NaCl质量分数分别为0,0.29%,0.59%,0.88%,1.17%,1.46%,1.76%。把同一盐浓度处理的盆钵放入对应周转箱中培养,每个周转箱中加入4 L 1/2 Hoagland营养液和不同浓度NaCl溶液,标记液面高度,每天观察补充水分,保持盐浓度不变,7 d换1次培养液。分别在盐处理7,14,21,28 d后采样,并测定各处理天数对应的可溶性糖、可溶性蛋白和脯氨酸的含量。
1.4 测定项目及方法
1.4.1 生理指标的测定 采集同一生长部位完全展开的叶片,放入冰盒保存,同时进行生理指标的测定。可溶性蛋白含量采用考马斯亮蓝G-250染色法测定[19];可溶性糖含量采用蒽酮比色法测定[19];游离脯氨酸含量采用酸性茚三酮比色法测定[19]。
1.4.2 光合指标的测定 分别于盐胁迫0,14,28 d,选择晴朗无云的天气进行测定。测量时间为上午9:00-12:00,每盆选4 株同一生长部位完全展开的叶片各1片,并测定出叶片的叶面积,用Li-6400(Li-COR,USA)便携式光合仪测定叶片光合速率(Pn,μmol CO2/m2·s)、蒸腾速率(Tr,mmol H2O/m2·s)、气孔导度(Gs,mmol H2O/m2·s)、胞间CO2浓度(Ci,μmol CO2/mol)。气孔限制值(Ls)由公式1-Ci/Ca计算,叶片水分利用效率(WUE,μmol CO2/mmol)由公式WUE=Pn/Tr计算。
1.5 数据处理与统计分析
利用Excel 2003和SPSS 20.0软件进行实验数据的统计与分析。
2 结果与分析
2.1 NaCl胁迫对扁蓿豆可溶性蛋白含量、可溶性糖含量、脯氨酸含量的影响
2.1.1 可溶性蛋白 同一胁迫天数下,扁蓿豆可溶性蛋白含量随盐浓度的增加总体呈降低的趋势,但各个观测期的变化规律不同(表1)。胁迫第7天, S300处理扁蓿豆可溶性蛋白含量与对照S0相比显著降低47.09%;胁迫第14天,S100、S150处理可溶性蛋白含量高于对照;胁迫第21天,S100、S150处理可溶性蛋白含量高于对照,但S300处理可溶性蛋白含量显著低于S0~S150处理;胁迫第28天,各浓度处理与对照相比差异均不显著。同一盐浓度下, S200~ S300处理第28天可溶性蛋白显著高于第7天。
2.1.2 可溶性糖 胁迫第14,21,28天,扁蓿豆可溶性糖含量随盐浓度的增加呈降低趋势(表1)。胁迫第7 和14天,S50处理可溶性糖含量明显高于对照及其他处理;胁迫第21天,S50处理可溶性糖含量显著高于对照,S300处理显著低于S50~S200处理;胁迫第28天,S250和S300处理可溶性糖含量显著低于对照,S300处理与对照相比降低31.25%。同一盐浓度下,随胁迫天数的增加,S100~S250处理胁迫第28天可溶性糖含量显著高于第7天。可溶性糖含量呈曲折上升的趋势,增长比例依次为42.96%,57.69%,209.52%,212.30%,100.38%。
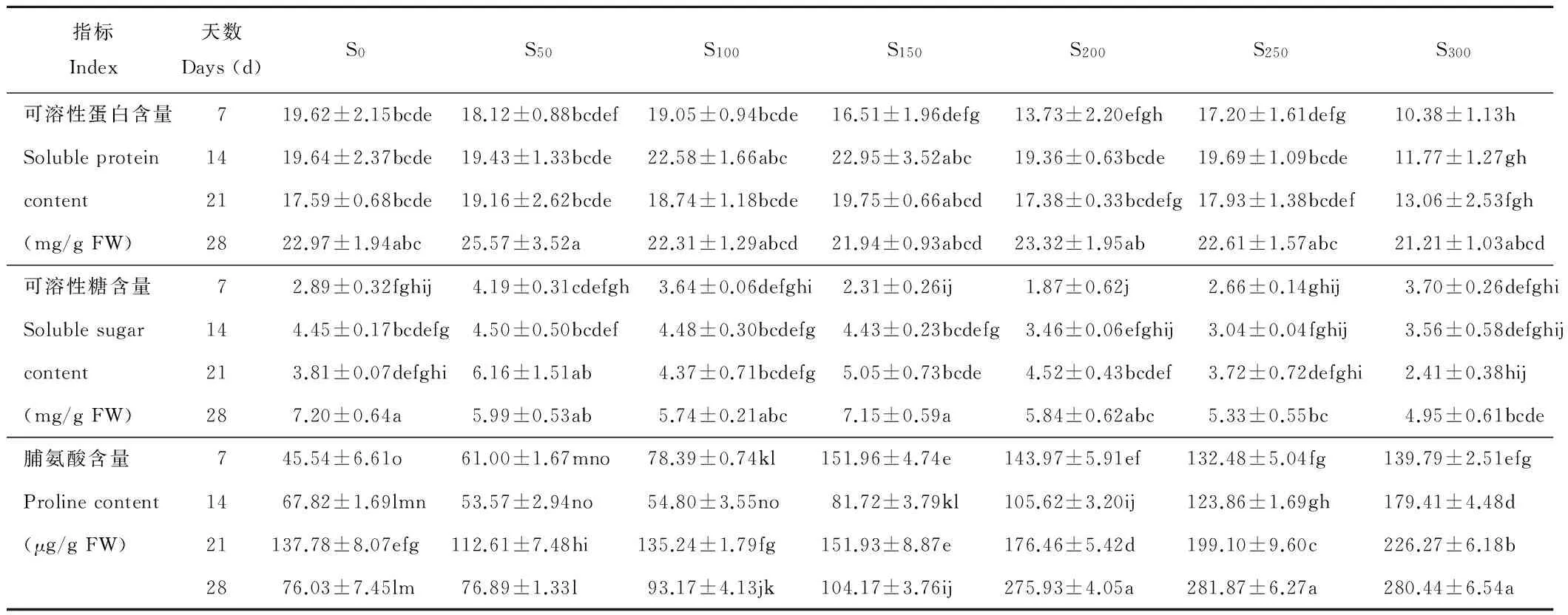
表1 不同浓度NaCl胁迫对扁蓿豆可溶性蛋白含量、可溶性糖含量、脯氨酸含量的影响
注:不同小写字母表示不同胁迫时间和浓度下差异显著(P<0.05).
Note: Different small letters indicate significant differences among treatment groups with different stress days under the different salt concentration at 0.05 level.
2.1.3 脯氨酸 同一胁迫天数下,扁蓿豆脯氨酸含量随盐浓度的增加而增加(表1)。胁迫第7天,S100~S300处理的脯氨酸含量显著高于对照;胁迫第14天,S200~S300处理显著高于对照及其他处理,S300处理是对照的2.65 倍;胁迫第21天,S200~S300处理显著高于对照;胁迫第28天,S100~S300处理显著高于对照及其他处理,S300处理脯氨酸含量是对照的3.69 倍。比较同一盐浓度不同观测期扁蓿豆脯氨酸含量变化发现,低浓度盐处理S50~S150,脯氨酸含量在4个观测期之间表现出降低-升高-降低的起伏变化,即第21天的脯氨酸含量显著高于7,14和28 d。高浓度盐S300处理下,脯氨酸含量依次递增,28 d的脯氨酸含量显著高于7,14和21 d。
2.2 NaCl胁迫对扁蓿豆光合特性的影响
2.2.1 光合速率(Pn) 同一胁迫天数下,随盐浓度的增加,扁蓿豆光合速率总体呈降低趋势(图1)。胁迫第0天,各浓度处理的光合速率基本一致;胁迫第14天,S300处理的光合速率显著小于对照(S0)及其他处理,但S50、S100、S150处理光合速率明显高于对照(S0);胁迫第28天,S100~S300处理扁蓿豆的光合速率显著低于对照,且下降幅度逐渐增大,分别为25.10%,30.35%,30.48%和41.47%。同一盐浓度下,随胁迫天数的增加,扁蓿豆光合速率变化规律基本一致。S100~S250处理下,28 d的光合速率显著低于0 和14 d。
2.2.2 蒸腾速率(Tr) 同一胁迫天数下,胁迫0 d时叶片,扁蓿豆各浓度处理的蒸腾速率差异不显著;胁迫14 d时,蒸腾速率表现出先升高后降低的趋势,S50、S100处理显著大于对照,S200~S300处理显著低于对照及其他处理;胁迫28 d,扁蓿豆蒸腾速率随盐浓度的增加而显著降低,S150~S300处理与对照相比分别降低41.04%,48.21%,58.43%和62.95%(图2)。同一盐浓度下,扁蓿豆蒸腾速率随胁迫天数的增加变化不同。S50、S100处理,14 d的蒸腾速率显著高于0和28 d,S100~S300处理,第28天蒸腾速率显著低于0 d。
2.2.3 气孔导度(Gs) 同一胁迫天数下,扁蓿豆各处理气孔导度变化不一致(图3)。胁迫0 d时,各浓度处理气孔导度值与对照差异不显著;胁迫第14天,S50、S100处理的气孔导度显著高于对照;胁迫第28天,S250和S300处理气孔导度显著低于对照,且分别降低28.57%和38.10%。同一盐浓度下,S50、S100处理第14天的气孔导度显著高于0和28 d;S250、S300处理第28天气孔导度显著低于0和14 d,且S150~S300处理随胁迫时间的增加,气孔导度分别降低5.26%,5.56%,21.05%和31.58%。
2.2.4 胞间CO2浓度(Ci) 同一胁迫天数下,随盐浓度的增加,扁蓿豆胞间CO2浓度总体为下降趋势(图4)。胁迫0 d时,各处理胞间CO2浓度值与对照差异不显著;胁迫第14天,S50处理胞间CO2浓度显著高于对照;胁迫第28天,S100~S300处理显著低于对照。同一盐浓度水平下,S50处理下14和28 d的胞间CO2浓度值显著高于0 d,但S200~S300处理下14和28 d的胞间CO2浓度值显著低于0 d。
2.2.5 气孔限制值(Ls) 同一胁迫天数下,随盐浓度的增加,扁蓿豆气孔限制值有增大的趋势(图5)。胁迫0 d时,各处理气孔限制值与对照相比差异不显著;胁迫第14天,S150~S300处理与对照相比差异均显著,且与对照相比依次增加69.57%,100.00%,121.74%和152.17%。胁迫第28天,扁蓿豆气孔限制值变化规律与第14天趋势一致。同一盐浓度下,随胁迫天数的增加,S100~S300处理,28 d的气孔限制值显著大于0 d;S150、S250、S300处理下,3个观测期气孔限制值差异均显著。

图1 不同浓度NaCl胁迫对扁蓿豆净光合速率的影响Fig.1 Effect of NaCl stress on photosynthesis rate (Pn) of M. ruthenica

图2 不同浓度NaCl胁迫对扁蓿豆蒸腾速率的影响Fig.2 Effect of NaCl stress on transpiration rate (Tr) of M. ruthenica
不同小写字母表示不同胁迫时间和浓度下差异显著(P<0.05),下同。
Different small letters indicate significant differences among treatment groups with different stress days under the different salt concentration at 0.05 level, the same below.

图3 不同浓度NaCl胁迫对扁蓿豆气孔导度的影响Fig.3 Effect of NaCl stress on stomatal conductance (Gs) of M. ruthenica

图4 不同浓度NaCl胁迫对扁蓿豆胞间CO2浓度的影响Fig.4 Effect of NaCl stress on intercellular CO2concentration (Ci) of M. ruthenica

图5 不同浓度NaCl胁迫对扁蓿豆气孔限制值的影响Fig.5 Effect of NaCl stress on stomatal limitation (Ls) of M. ruthenica

图6 不同浓度NaCl胁迫对扁蓿豆水分利用效率的影响Fig.6 Effect of NaCl stress on water use efficiency (WUE) of M. ruthenica
2.2.6 水分利用效率(WUE) 同一胁迫天数下,随盐浓度的增加,扁蓿豆水分利用效率呈上升趋势(图6)。胁迫0 d时,各处理水分利用效率差异不显著;胁迫第14天,S250和S300处理水分利用效率显著高于对照及其他处理,且与对照相比分别提高54.68%和73.40%;胁迫第28天,仅有S250、S300处理显著高于对照,与对照相比分别提高67.54%和59.69%。同一盐浓度,S250、S300处理下,14和28 d水分利用效率显著高于0 d。
3 讨论
3.1 NaCl胁迫对扁蓿豆可溶性蛋白含量、可溶性糖含量、脯氨酸含量的影响
渗透调节被认为是植物在盐碱胁迫下抵抗盐伤害的重要且有效的耐盐机理。研究不同植物种的渗透调节机理,对改进植物耐盐性有重要作用[20]。这种作用主要表现为抑制植物细胞在盐胁迫下的渗透失衡[21],稳定亚细胞组织及清除抗氧化系统[22]。游离脯氨酸、可溶性糖、可溶性蛋白是植物体内重要的渗透调节物质[23]。可溶性蛋白具有较强的亲水性,它能明显增强细胞的持水力,而可溶性蛋白含量的增加可以束缚更多的水分,降低细胞渗透势。同时,肖强等[24]研究得出可溶性蛋白含量与植物体内新陈代谢相关,盐胁迫可使细胞中蛋白质的合成代谢增强,合成蛋白质,以降低细胞的渗透势。本研究中,扁蓿豆叶片可溶性蛋白含量总体随盐浓度的提高而降低,胁迫7和14 d,S300处理可溶性蛋白含量显著低于对照及其他处理,但胁迫14和21 d,S50、S100处理可溶性蛋白含量高于对照,与方志红和董宽虎[25]研究NaCl胁迫对碱蒿(Artemisiacnethifolia)可溶性蛋白含量的影响结果一致,即可溶性蛋白含量在低浓度胁迫下高于对照,随着NaCl质量分数的提高而降低。低浓度盐胁迫下,扁蓿豆可溶性蛋白含量增加,这可能是机体对盐环境适应的表现,而高浓度盐胁迫导致了蛋白质的降解。胁迫第28天,扁蓿豆各浓度胁迫下的可溶性蛋白含量与对照相比差异不显著,证明盐胁迫能诱导机体产生新的蛋白,增加了可溶性蛋白含量,有利于提高扁蓿豆的耐盐性。肖雯等[26]研究证实可溶性糖是非盐生植物的重要渗透调节剂。冯毓琴等[27]研究得出可溶性糖是逆境条件下植物的主要渗透调节剂,可以作为逆境下能量储存的一种形式,同时研究表明[28-29],在逆境胁迫下,植物积累的可溶性糖越多,其抗逆性就越强。本研究中扁蓿豆胁迫7,14,21 d后,叶片可溶性糖含量在中浓度(50~150 mmol/L)盐浓度胁迫时积累较多,明显高于对照,这可能与扁蓿豆抗盐性增强有关。随胁迫浓度和时间的增加,可溶性糖含量逐渐减小,在高浓度(300 mmol/L)盐胁迫下,可溶性糖含量显著低于对照。李源等[30]研究认为脯氨酸积累的快慢能体现植物对盐胁迫反应的敏感程度,而脯氨酸含量的高低不能反映其耐盐程度。而汪贵斌和曹福亮[31]研究发现脯氨酸含量的提高是植物在逆境条件下的自卫反应之一,细胞脯氨酸含量增加,维持了细胞的膨压,同时可以保护酶和膜系统免受毒害。本研究中,扁蓿豆叶片脯氨酸含量随盐浓度的增加而增加,高浓度胁迫促进了脯氨酸的大量积累,且随着胁迫时间的延长,积累越多。张永锋等[16]研究发现随盐碱胁迫的增加,苗期紫花苜蓿(Medicagosativa)叶片中脯氨酸含量呈升高趋势,且随着胁迫时间的延长,各处理下的脯氨酸含量总体变化也呈升高趋势,本研究结果与其一致。
3.2 NaCl胁迫对扁蓿豆光合特性的影响
光合作用是植物进行生命活动的基础,所以研究盐胁迫下光合作用的响应,对扁蓿豆抗逆性研究具有重要的意义。研究表明,盐胁迫既可以直接影响植物的生长[32-33],也可以通过抑制为其生长提供物质基础的光合作用而间接影响植物生长,且盐度越大,作用时间越长越明显[34]。Munns[35]认为盐胁迫引起的光合作用下降是因为盐分造成植物生长势减弱,从而降低单株植物的光合作用面积。本研究得出,胁迫早期,低盐胁迫下扁蓿豆净光合速率、蒸腾速率、气孔导度、胞间CO2均高于对照,随着胁迫时间及盐浓度的增加而显著降低。原因可能是短期胁迫下植物光合作用产生的能量可用于植物生长,还可用于适应盐胁迫,植物为了抵抗盐胁迫需要加快自身光合速率[36],但随着盐浓度及处理时间延长这种适应能力下降,光合速率降低。与Kurban等[37]对豆科植物骆驼刺(Alhagipseudoalhagi)的研究结论及Parida等[38]的研究结论一致,低盐处理使Pn和Gs升高,随着盐浓度的升高转而出现抑制作用。王怡丹等[39]认为,光合作用降低的原因是NaCl抑制CO2的吸收,即胞间CO2浓度降低,破坏叶绿体色素的平衡,降低叶绿体色素的含量,最终导致光合作用的降低。
李荣生等[40]研究表明,水分利用效率(WUE)与植物生理因子如叶水势、气孔、光合速率、蒸腾速率等有关,且WUE随着气孔导度下降反而上升。本研究中,扁蓿豆WUE随胁迫时间及盐浓度的提高而显著高于对照,胁迫14和28 d,S250、S300处理水分利用效率显著高于0 d。研究[41]表明,在干旱生境中生长的植物具有较高的水分利用效率,且当植物水势降低时,气孔导度降低,气孔导度值的降低可以增加植物的水分利用效率。可见,扁蓿豆水分利用效率的增大可能与扁蓿豆具有较强的抗旱性有关[8],同时张振平等[42]研究表明,干旱胁迫下,叶片主要通过降低其蒸腾速率来提高水分利用效率,与本实验研究结果相同。气孔限制值(Ls)主要表现为限制叶片气孔大小及气孔开闭状态。盐胁迫下,引起植物叶片光合速率降低的自身因素主要有气孔的部分关闭导致的气孔限制和叶肉细胞光合活性的下降导致的非气孔限制两类[43]。但有关盐胁迫对植物光合特性的影响归因于气孔因素还是非气孔因素至今也未形成统一的认识[44]。根据Farquhar和Sharkey[45]提出的光合作用气体交换模型,如果Pn的降低伴随着Gs和Ci的降低及Ls的升高则是气孔因素引起的,而Pn下降伴随着Ci的升高则证明是由叶肉细胞光合活性的降低引起的。对拟南芥(Arabidopsisthaliana)[46]的研究表明,气孔因素是引起其光合速率下降的主要原因,而对玉米(Zeamays)的研究表明,非气孔因素导致了光合速率下降。海滨锦葵(Kosteletzlyavirginica)叶片的光合速率在盐处理的初期下降,下降至最低点后又会有一定程度的回升,随着处理时间的延长,盐浓度越高光合速率下降越明显[47]。本研究中,随胁迫浓度和胁迫时间的增加,扁蓿豆光合速率、气孔导度、胞间CO2浓度降低,而气孔限制值增大,表明气孔限制是扁蓿豆光合速率下降的主要原因。范方等[48]研究盐胁迫对紫花苜蓿生长及光合生理特性得出使紫花苜蓿光合降低的主要因素有早期的气孔限制因素和后期的非气孔限制因素,本研究结论与其有差异。这可能与不同植物或植物的不同发育阶段,其光合作用对盐胁迫的敏感度各不相同有关。
4 结论
盐胁迫下,扁蓿豆产生的3 种渗透调节物质变化规律不一致,但对其耐盐性的提高均有一定的调节作用。胁迫早期(7,14 d),可溶性蛋白对高浓度(300 mmol/L)盐胁迫刺激敏感,含量显著低于对照。第7,14,21天,50~150 mmol/L处理下,可溶性糖含量明显高于对照,但第28天,250~300 mmol/L处理,含量显著低于对照。胁迫第7天,100~300 mmol/L浓度处理、第14和28天,200~300 mmol/L浓度处理均分别使扁蓿豆脯氨酸含量显著高于对照及其他处理。
不同的胁迫浓度和时间,扁蓿豆3个观测期光合参数变化不尽相同,胁迫第14天,Pn、Tr、Gs、Ci随盐浓度的升高呈先上升后降低的趋势。50~100 mmol/L盐浓度Pn、Tr和Gs显著大于对照,300 mmol/L浓度处理Pn和Tr显著低于对照及其他处理。胁迫第28天,4个光合参数均随盐浓度的升高而降低。Ls和WUE在胁迫14和28 d时,均随盐浓度的升高而升高。综合盐胁迫对6个光合参数的影响得出气孔限制是扁蓿豆光合速率下降的主要原因。
[1] Mao P S, Chang S J, Wang Y H. Effect of artificially ageing treatments on the membrane permeability ofLeymuschinensisseed. Acta Prataculturae Sinica, 2008, 17(6): 66-70.
[2] Han W B, Sheng Z B, Tang F L. The research progress of using salt-tolerant forage restore salinization meadow. Heilongjiang Animal Science and Velerinary Medicine, 2013, (9): 32-35.
[3] Zhang G, Zhou Z Y, Zhang C P. The effect of land use on the levels of salt and organic matter in saline soil. Acta Prataculturae Sinica, 2007, 16(4): 15-20.
[4] Gu F X, Zhang Y D, Liu Y Q. Analysis on the relationship between soil salinisation and fertility in Fukang oasis. Journal of Arid Land Resources and Environment, 2003, 17(2): 78-82.
[5] Guo X, Li M, Xiao S G. Studies on effect of alkaligrass (PucclnelliachinampoensisOhwi). Journal of Anhui Agricultural Science, 2008, 36(16): 6866-6867.
[6] Li F K, Zhai G Y, Shen Y X. Effect of superphosphate application and rhizobia inoculation on growth and forage quality ofMedicagosativain the Yellow River Delta. Acta Prataculturae Sinica, 2005, 14(3): 87-93.
[7] Zhao Y C, Qin J H. The effects on forage to ameliorate and fertilize saline-alkali soil in the Hexi area. Acta Prataculturae Sinica, 2005, 14(6): 63-66.
[8] Zhang Z W. The Flora of China[M]. The Chinese Academy of Sciences, China Flora Editorial Board. Beijing: Science Press, 1998: 467.
[9] Han H B, Shi W G, Li Z Y. Research progress of resistance ofMedicagoruthenica. Pratacultural Science, 2011, 28(4): 631-635.
[10] Li H Y, Li Z Y, Shi W G. The genetic diversity of three ecologicalMedicagoruthenicagermplasms revealed by ISSR and SSR. Acta Prataculturae Sinica, 2012, 21(5): 107-113.
[11] Li Z Y. The Mechanism Studies on Genetic Diversity inMedicagoruthenicaGermplasm Resources[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011: 142.
[12] Ning H M. Studies of Identification and Evaluation on 6 WildMedicagoruthenicaGermplasm Resources[D]. Hohhot: Inner Mongolia Agricultural University, 2008: 55.
[13] Zhang Y, Shi F L, Gao X. Establishment of cDNA-AFLP Reaction system of cold-induced genes transcript difference forMedicagoruthenica. Chinese Journal Grassland, 2013, 35(2): 13-18.
[14] Shi F L, Guo X X, Li H. Examination and analysis of drought-resisting morphology and anatomy ofMelilotoidesruthenica. Agricultural Research in the Arid Areas, 2005, 23(2): 115-118.
[15] Cui X M, Liu X B, Li Z H. Effects of salicy acid on growth photosynthetic characteristics ofMelilotoidesruthenicain branching stage under different water stress. Acta Prataculturae Sinica, 2012, 21(6): 82-93.
[16] Zhang Y F, Liang Z W, Sui L. Effect on physiological characteristic ofMedicagosativaunder saline-alkali stress at seeding stage. Acta Prataculturae Sinica, 2009, 18(4): 230-235.
[17] Zhu X G, Zhang Q D. Advances in the research on the effects of NaCl on photosynthesis. Chinese Bulletin Botany, 1999, 16(4): 332-338.
[18] Han Z P, Guo S R, Jiao Y S. Effect of NaCl stress on growth and photosynthetic gas exchange of watermelon seedlings. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(4): 745-751.
[19] Wang X K. Principle and Technology of Plant Physiological and Biochemical Experiments[M]. Beijing: High Education Press, 2006: 298.
[20] Ma L. Study on Effects and Assessments of NaCl Stress on Seed Germination and Physiological Biochemical of Seedling of Herbages[D]. Taian: Shandong Agricultural University, 2010: 82.
[21] Heuer B. Influence of exogenous application of proline and glycinebetaine on growth of salt-stressed tomato plants. Plant Science, 2003, 165(4): 693-699.
[22] Ashraf M, Foolad M A. Improving plant abiotic-stress resistance by exogenous application of osmoprotectants glycine betaine and proline. Environmental and Experimental Botany, 2007, 59: 206-216.
[23] Xu F L, Luo L J, Gao C H. Inducing effects of plant growth regulators on the chilling resistance of sweet pepper(Capsicumannuum). Chinese Journal of Pesticide Science, 2011, 13(1): 33-39.
[24] Xiao Q, Zheng H L, Chen Y. Effects of salinity on the growth and proline, soluble sugar and protein contents contents ofSpartinaalterniflora. Chinese Journal of Ecology, 2005, 24(4): 373-376.
[25] Fang Z H, Dong K H. Effects of NaCl stress on soluble protein contents and soluble carbohydrate contents ofArtemisiacnethifolia. Chinese Agricultural Science Bulletin, 2010, 26(16): 147-149.
[26] Xiao W, Jia H X, Pu L M. Studies on physiological index of some halophytes. Acta Botanica Boreali-Occidentalia Sinica, 2000, 25(5): 818-825.
[27] Fong Y Q, Cao Z Z, Jia Y Q. Study on salt tolerance of wild black medic germplasm. Pratacultural Science, 2007, 24(5): 27-33.
[28] Singh N K, Handa A K, Hasegawa P M,etal. Proteins associated with adaptation of cultured tobacco cells to NaCl. Plant Physiology, 1985, 79(1): 126-137.
[29] Munns R, Termaat A. Whole-plant responses to salinity. Functional Plant Biology, 1986, 13(1): 143-160.
[30] Li Y, Liu G B, Gao H W. A comprehensive evaluation of salt-tolerance and the physiological response ofMedicagosativaat the seedling stage. Acta Prataculturae Sinica, 2010, 19(4): 79-86.
[31] Wang G B, Cao F L. Effects of salinity on growth and physiology of bald cypress seedlings. Journal of Nanjing Forestry University (Natural Sciences Edition), 2003, 27(3): 11-14.
[32] Qin F M, Zhang H X, Wu W. Effects of salt stress on germination and seedling growth ofMedicagofalcata. Acta Prataculturae Sinica, 2010, 19(4): 71-78.
[33] Jing Y X, Yuan Q H. Effects of salt stress on seedling growth of alfalfa (Medicagosativa) and ion distribution in different alfalfa organs. Acta Prataculturae Sinica, 2011, 20(2): 134-139.
[34] Sultana N, Ikeda T, Itoh R. Effect of NaCl salinity on photosynthesis and dry matter accumulation in developing rice grains. Environmental and Experimental Botany, 1999, 42(3): 211-220.
[35] Munns R. Comparative physiology of salt and water stress. Plant, Cell & Environment, 2002, 25(2): 239-250.
[36] Flexas J, Bota J, Galmes J,etal. Keeping a positive carbon balance under adverse conditions: responses of photosynthesis and respiration to water stress. Physiologia Plantarum, 2006, 127(3): 343-352.
[37] Kurban H, Saneoka H, Nehira K,etal. Effect of salinity on growth, photosynthesis and mineral composition in leguminous plant Alhagi pseudoalhagi (Bieb.). Soil Science and Plant Nutrition, 1999, 45(4): 851-862.
[38] Parida A K, Das A B, Mittra B. Effects of salt on growth, ion accumulation, photosynthesis and leaf anatomy of the mangrove, bruguiera parviflora. Trees, 2004, 18(2): 167-174.
[39] Wang Y D, Quan B W, Piao J Z. Comparison about drought resistance of 4 forages at seedling stage under water stress. Journal of Agricultural Science Yanbian University, 2007, 29(2): 101-106.
[40] Li R S, Xu H C, Yin G T. Advances in the water use efficiency of plant. Forest Research, 2003, 16(3): 366-371.
[41] Cheng T, Fong H Y, Xu S J. Stable Carbon isotope composition of desert plant leaves and water-use efficiency. Journal of Desert Research, 2002, 22(3): 87-90.
[42] Zhang Z P, Qi H, Zhang Y. Effects of water stress on photosynthetic rate and water use efficiency of Maize. Acta Agriculturae Boreali-Sinica, 2009, 24(S1): 155-158.
[43] Wang D M, Jia Y, Cui J Z. Advances in research on effects of salt stress on plant and adaptive mechanism of the plant to salinity. Chinese Agricultural Science Bulletin, 2009, 25(4): 124-128.
[44] Steduto P, Albrizio R, Giorio P,etal. Gas-exchange response and stomatal and non-stomatal limitations to carbon assimilation of sunflower under salinity. Environmental and Experimental Botany, 2000, 44(3): 243-255.
[45] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(1): 317-345.
[46] Zhao X, Wu Y X, Zhao M G. Reaponse of photosynthesis function of salt cress and arabidopsis to NaCl salt stress. Chinese Bulletin of Botany, 2007, 24(2): 154-160.
[47] Lin Y, Li W, Fan H. Photosynthetic response ofKosteletzlyavirginicaL. presl to salt stress. Journal of Shandong Normal University (Natural Science), 2006, 21(2): 118-120.
[48] Fan F, Zhang Y X, Jiang J. Effects of salt stress on the growth and photosynthetic physiological characteristics of alfalfa. Chinese Agricultural Science Bulletin, 2013, 29(17): 14-18.
参考文献:
[1] 毛培胜, 常淑娟, 王玉红. 人工老化处理对羊草种子膜透性的影响. 草业学报, 2008, 17(6): 66-70.
[2] 韩微波, 申忠宝, 唐凤兰. 我国利用耐盐牧草恢复盐渍化草地的研究进展. 黑龙江畜牧兽医, 2013, (9): 32-35.
[3] 张冈, 周志宇,张彩萍. 利用方式对盐渍化土壤中有机质和盐分的影响. 草业学报, 2007, 16(4): 15-20.
[4] 顾峰雪, 张远东, 刘永强. 阜康绿洲土壤盐渍化特征及其与肥力的相关性分析. 干旱区资源与环境, 2003,17(2): 78-82.
[5] 郭孝, 李明, 肖曙光. 碱茅改良黄河滩区盐渍化土壤的效果. 安徽农业科学, 2008, 36(16): 6866-6867.
[6] 李富宽, 翟桂玉, 沈益新. 施磷和接种根瘤菌对黄河三角洲紫花苜蓿生长及品质的影响. 草业学报, 2005, 14(3): 87-93.
[7] 赵芸晨, 秦嘉海. 几种牧草对河西走廊盐渍化土壤改土培肥的效应研究. 草业学报, 2005, 14(6): 63-66.
[8] 张振万.中国科学院中国植物志编辑委员会.中国植物志[M]. 北京: 科学出版社, 1998: 467.
[9] 韩海波, 师文贵, 李志勇. 扁蓿豆的抗性研究进展. 草业科学, 2011, 28(4): 631-635.
[10] 李鸿雁, 李志勇, 师文贵. 3种生态型野生扁蓿豆种质资源ISSR与SSR遗传多样性分析. 草业学报, 2012, 21(5): 107-113.
[11] 李志勇. 扁蓿豆种质资源遗传多样性机理的研究[D]. 北京: 中国农业科学院, 2011: 142.
[12] 宁红梅. 6份野生扁蓿豆种质资源鉴定与评价研究[D]. 呼和浩特: 内蒙古农业大学, 2008: 55.
[13] 张宇, 石凤翎, 高霞. 扁蓿豆冷诱导基因转录差异cDNA-AFLP反应体系的构建. 中国草地学报, 2013, 35(2): 13-18.
[14] 石凤翎, 郭晓霞, 李红. 扁蓿豆抗旱形态解剖结构观察与分析. 干旱地区农业研究, 2005, 23(2): 115-118.
[15] 崔秀妹, 刘信宝, 李志华. 不同水分胁迫下水杨酸对分枝期扁蓿豆生长及光合生理的影响. 草业学报, 2012, 21(6): 82-93.
[16] 张永锋, 梁正伟, 隋丽. 盐碱胁迫对苗期紫花苜蓿生理特性的影响. 草业学报, 2009, 18(4): 230-235.
[17] 朱新广, 张其德. NaCl对光合作用影响的研究进展. 植物学通报, 1999, 16(4): 332-338.
[18] 韩志平, 郭世荣, 焦彦生. NaCl胁迫对西瓜幼苗生长和光合气体交换参数的影响. 西北植物学报, 2008, 28(4): 745-751.
[19] 王学奎.植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006: 298.
[20] 马琳.NaCl胁迫对牧草种子萌发与幼苗生理生化的影响及耐盐性评价[D]. 泰安: 山东农业大学, 2010: 82.
[23] 徐福乐, 罗立津, 高灿红. 植物生长调对甜椒的抗寒性诱导效应研究. 农药学学报, 2011, 13(1): 33-39.
[24] 肖强, 郑海雷, 陈瑶. 盐度对互花米节剂草生长及脯氨酸、可溶性糖和蛋白质含量的影响. 生态学杂志, 2005, 24(4): 373-376.
[25] 方志红, 董宽虎. NaCl胁迫对碱蒿可溶性糖和可溶性蛋白含量的影响. 中国农学通报, 2010, 26(16): 147-149.
[26] 肖雯, 贾恢先, 蒲陆梅. 几种盐生植物抗盐生理指标的研究. 西北植物学报, 2000, 25(5): 818-825.
[27] 冯毓琴, 曹致中, 贾蕴琪. 天蓝苜蓿野生种质的耐盐性研究. 草业科学, 2007, 24(5): 27-33.
[30] 李源, 刘贵波, 高洪文. 紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应. 草业学报, 2010, 19(4): 79-86.
[31] 汪贵斌, 曹福亮. 盐胁迫对落羽杉生理及生长的影响. 南京林业大学学报(自然科学版), 2003, 27(3): 11-14.
[32] 秦峰梅, 张红香, 武祎. 盐胁迫对黄花苜蓿发芽及幼苗生长的影响. 草业学报, 2010, 19(4): 71-78.
[33] 景艳霞, 袁庆华. NaCl胁迫对苜蓿幼苗生长及不同器官中盐离子分布的影响. 草业学报, 2011, 20(2): 134-139.
[39] 王怡丹, 全炳武, 朴京珠. 水分胁迫对4种牧草苗期的抗旱性比较. 延边大学农学学报, 2007, 29(2): 101-106.
[40] 李荣生, 许煌灿, 尹光天. 植物水分利用效率的研究进展. 林业科学研究, 2003, 16(3): 366-371.
[41] 陈拓, 冯虎元, 徐世建. 荒漠植物叶片碳同位素组成及其水分利用效率. 中国沙漠, 2002,22 (3): 87-90.
[42] 张振平, 齐华, 张悦. 水分胁迫对玉米光合速率和水分利用效率的影响. 华北农学报, 2009, 24(S1): 155-158.
[43] 王东明, 贾媛, 崔继哲. 盐胁迫对植物的影响及植物盐适应性研究进展. 中国农学通报, 2009, 25(4): 124-128.
[46] 赵昕, 吴雨霞, 赵敏桂, 等. NaCl胁迫对盐芥和拟南芥光合作用的影响. 植物学通报, 2007, 24(2): 154-160.
[47] 林莺, 李伟, 范海. 海滨锦葵光合作用对盐胁迫的响应. 山东师范大学学报(自然科学版), 2006, 21(2): 118-120.
[48] 范方, 张玉霞, 姜健. 盐胁迫对紫花苜蓿生长及光合生理特性的影响. 中国农学通报, 2013, 29(17): 14-18.
Effects of NaCl stress on substances linked to osmotic adjustment and on photosynthetic physiology ofMelilotoidesruthenicain the seedling stage
YAO Jia, LIU Xin-Bao, CUI Xin, LI Zhi-Hua*
AnimalScienceandTechnologyCollegeofNanjingAgriculturalUniversity,Nanjing210095,China
The effects of various levels of NaCl stress [0 (control), 50, 100, 150, 200, 250, 300 mmol/L] on the osmotic adjustment matters and photosynthetic physiology ofMelilotoidesruthenicaseedlings were investigated in pot experiments. Soluble protein and sugar contents of seedlings decreased with increasing NaCl concentration. However, proline content increased with increased NaCl concentration. The contents of soluble protein, sugars, and proline differed under different salt concentrations and stress exposure times. On the 7thday and 14thday after imposing stress, soluble protein contents of seedlings exposed to 300 mmol/L NaCl concentrations were significantly lower than those of controls (P<0.05). On the 7th, 14thand 21stday after imposing stress, soluble sugar contents of seedlings exposed to 50 or 100 mmol/L NaCl concentration were higher than those of the controls, while on 28thday after stress, soluble sugar contents of seedlings exposed to 250 or 300 mmol/L NaCl concentrations were significantly lower than those of the controls (P<0.05). On the 7thday after imposing stress (150-300 mmol/L NaCl), the 14thday after imposing stress (200-300 mmol/L NaCl) and on the 28thday after imposing stress (250 or 300 mmol/L NaCl), the proline content was significantly higher than that of the control and other treatments (P<0.05). Hence under salt stress, three indicators of osmotic adjustment had different time signatures. With increases in both NaCl concentration and stress exposure time, the physical damage toM.ruthenicaseedlings became more serious, while photosynthetic parameters varied with NaCl concentration and stress exposure time. On the 14thday after imposing stress, photosynthetic rate (Pn), transpiration rate (Tr), stomatal conductance (Gs) and intercellular CO2concentration (Ci) increased at low, and decreased at high salt concentration.Pn,Tr, andGsof seedlings under 50-100 mmol/L concentrations were significantly higher than those of control plants, whilePnandTrof seedlings under 300 mmol/L were significantly lower than those of control plants and of other treatments (P<0.05). On 28thday after imposing stress,Pn,Tr,GsandCiwere decreased with increasing of salt concentrations. On the 14thand 28thdays after imposing stress, stomatal limitation (Ls) and water use efficiency (WUE) increased with increasing NaCl concentration.
Melilotoidesruthenica; salt-stress; osmosis adjustment; photosynthetic physiology
10.11686/cyxb20150511
http://cyxb.lzu.edu.cn
2014-03-04;改回日期:2014-09-02
“十二五”农村领域国家科技计划项目(2011BAD17B03)资助。
姚佳(1987-),女,云南玉溪人,在读硕士。E-mail:freeyj2013@163.com *通讯作者Corresponding author. E-mail: lizhihua@njau.edu.cn
姚佳,刘信宝,崔鑫,李志华. 不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响. 草业学报, 2015, 24(5): 91-99.
Yao J, Liu X B, Cui X, Li Z H. Effects of NaCl stress on substances linked to osmotic adjustment and on photosynthetic physiology ofMelilotoidesruthenicain the seedling stage. Acta Prataculturae Sinica, 2015, 24(5): 91-99.

