淹水对紫花苜蓿南北方品种抗氧化酶和无氧呼吸酶的影响
全瑞兰,玉永雄
(1.西南大学动物科技学院,重庆 400716;2.信阳市农业科学院,河南 信阳 464000)
淹水对紫花苜蓿南北方品种抗氧化酶和无氧呼吸酶的影响
全瑞兰1,2,玉永雄1*
(1.西南大学动物科技学院,重庆 400716;2.信阳市农业科学院,河南 信阳 464000)
以紫花苜蓿南方育成品种渝苜1号和北方地方品种新疆紫泥泉为材料,在幼苗长出4片真叶时进行淹水处理,在淹水的第10天测定植株的生物量,并分别在淹水的第0,2,4,6,8,10天测定叶片中的丙二醛(MDA)含量以及叶片抗氧化酶和根系无氧呼吸酶的活性,以探明两个品种对淹水胁迫的耐受性差异及其生理响应机制。结果表明,淹水胁迫使紫花苜蓿的生物量减少,但与新疆紫泥泉相比,渝苜1号生物量的降幅小。淹水时渝苜1号叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶活性比新疆紫泥泉的高,而叶片MDA含量比新疆紫泥泉的低;根系无氧呼吸酶活性在淹水胁迫中均增强,但渝苜1号的乙醇脱氢酶(ADH)和丙酮酸脱羧酶(PDC)活性增加明显,乙醇发酵更强;而新疆紫泥泉的乳酸脱氢酶(LDH)的活性增加更为突出,乳酸发酵强。淹水影响紫花苜蓿正常生长,但南方品种渝苜1号比北方品种新疆紫泥泉对淹水胁迫更具耐受性,因为前者具有比较高的抗氧化酶活性和比较强的乙醇发酵途径,有利于增强植株抗淹水胁迫能力。
淹水胁迫;紫花苜蓿;品种;抗氧化酶;无氧呼吸酶
紫花苜蓿生态适应性广,营养十分丰富,素有“牧草之王”的美誉,从西域传入我国至今已有2000多年的栽培历史,现在主要分布在华北、西北地区[1-2]。近年来,我国南方畜牧业快速发展,对优质豆科牧草的需求也越来越大[3]。而南方地区的多雨气候条件造成土壤容易渍水,影响到紫花苜蓿的正常生长和发育[4]。渝苜1号紫花苜蓿是我国南方地区第一个紫花苜蓿育成品种,该品种在弱酸性、中性或碱性砂壤土上生长良好,在耐湿、耐热、直立性、再生力、持久性等方面表现良好,杂草危害也相对较小。随着紫花苜蓿南方品种渝苜1号的育成与推广,将有利于解决南方地区优质豆科牧草不足的问题。淹水使植株根系周围形成嫌气环境,严重限制了植物的生长和产量[5-7]。湿涝胁迫引起细胞产生自由基,破坏细胞膜系统,造成离子渗漏和细胞死亡,高水平的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性对长时间淹水时多种植物的存活具有重要作用[8-9]。淹水条件下,植物根系缺氧,无氧呼吸增强,乙醇脱氢酶(ADH)、丙酮酸脱羧酶(PDC)和乳酸脱氢酶(LDH)活性增加,增强植株根系对缺氧环境的适应性[10-12]。目前,紫花苜蓿耐湿性的研究报道较少,关于紫花苜蓿耐湿机理的研究比较缺乏。本研究以耐旱能力很强的我国新疆维吾尔自治区的地方品种新疆紫泥泉作为参照,以抗氧化酶和无氧呼吸酶活性变化为切入点,分析紫花苜蓿南方育成品种渝苜1号对淹水胁迫的耐受性及其生理响应机制,为紫花苜蓿耐湿性的后续研究及解决紫花苜蓿在南方的推广利用提供一定的理论参考。
1 材料与方法
1.1 试验材料
以在南方湿热地区(重庆)育成的紫花苜蓿品种渝苜1号(Yumu No.1)和北方干旱地区地方品种新疆紫泥泉(Xinjiangziniquan)为试验材料。渝苜1号种子是西南大学动物科技学院牧草研究室委托在新疆库尔勒繁育的种子,新疆紫泥泉种子由甘肃农业大学草业学院曹致中老师提供。
1.2 试验设计与淹水处理
试验在西南大学牧草实验室的玻璃温室内进行。种子经消毒、催芽后,于露白时播于直径为16 cm的装有河沙的聚乙烯花盆中,每个花盆定苗10株,放入温室培养。从真叶开始长出时,每3 d浇灌1次1/2 Hoagland营养液,中间浇1次清水。待幼苗长出4片真叶时进行淹水处理,将花盆放入40 cm×30 cm×30 cm的装满自来水的玻璃缸内,保持水面高于河沙表面1 cm。未进行淹水处理的为对照。1个花盆1个重复,试验重复3次。
处理0,2,4,6,8,10 d时,分别取各个处理的叶片和根系进行酶活性的测定;并于处理10 d时测定植株的生物量。
1.3 测定项目与测定方法
1.3.1 鲜重、根冠比的测定 淹水10 d后,将生物量测定的材料,用水轻轻冲洗花盆中的河沙,将幼苗从花盆中完整取出并洗净,用滤纸吸干表面的水分后用天平称取花盆中所有植株的鲜重,然后将植株的地上和地下部分分开并称重,计算根冠比及相对抑制率。
根冠比=植株根系鲜重(g)/植株地上部分鲜重(g)
相对抑制率=(1-处理组/对照组)×100%
1.3.2 MDA含量的测定 用TCA-TBA法[13]。取新鲜叶片0.2 g置于研钵中,加5%(W/V)三氯乙酸(TCA) 5 mL研磨,研磨后12000 r/min离心10 min,取上清液2 mL,加入用10%TCA配制成的0.67%(W/V)2-硫代巴比妥酸(TBA)溶液2 mL,混合液100℃水浴煮沸30 min后在冰上迅速冷却,冷却后12000 r/min离心10 min,取上清液分别测定其在450,532和600 nm处的吸光值。MDA浓度(C,μmol/L)=6.45(A532-A600)-0.56A450。式中,C为MDA浓度,A450、A532、A600分别代表450,532和600 nm波长下的吸光值。样品MDA含量用nmol/g FW(鲜重)表示。MDA含量(nmol/g)=MDA浓度(C,μmol/L)×提取液总体积(0.005 L)×稀释倍数(2)÷质量(0.2 g)×103。
1.3.3 SOD、POD和CAT活性的测定 参照Wang等[14]的方法提取酶液。分别称取淹水处理和相应对照的叶片0.3 g放于研钵中,加入1.5 mL蛋白提取液[内含100 mmol/L 磷酸盐缓冲液(phosphate buffered saline, PBS)(pH 7.5)、1 mmol/L EDTA和1%(W/V)聚乙烯吡咯烷酮],在冰上将叶片研磨成匀浆,又在4℃,12000 r/min离心20 min,上清液即是粗酶液,取上清液转入1.5 mL EP管中,用于酶活性的测定。SOD活性测定用NBT法[13], 以抑制氮蓝四唑(NBT)光还原50%为1个酶活性单位(U)。POD活性测定用愈创木酚法[13],以OD470每min增加0.1为1个酶活性单位(U)。CAT活性测定参照Yang等[15]的方法, 以OD240每min减少0.1为1个酶活性单位(U)。每个酶活性测定重复3次,酶活性以U/g FW(鲜重)表示。
1.3.4 乳酸脱氢酶(lactate dehydrogenase, LDH)、丙酮酸脱羧酶(pyruvate decarboxylase, PDC)和乙醇脱氢酶(alcohol dehydrogenase, ADH)活性的测定 参照Mustroph和Albrecht[10]的方法提取酶液。分别称取淹水处理和相应对照的根0.5 g于研钵中,加入1.5 mL预冷的提取液(内含50 mmol/L Tris-HCl、5 mmol/L MgCl2、5 mmol/L β-巯基乙醇、15%甘油、1 mmol/L EDTA、1 mmol/L EGTA和0.1 mmol/L 苯甲基磺酰氟,pH 6.8),冰浴研磨成匀浆,4℃,12000 r/min离心20 min,上清液即是粗酶液,取上清液转入1.5 mL EP管中,用于酶活性的测定。乳酸脱氢酶(LDH)活性测定参照Wang等[16]的方法,乙醇脱氢酶(ADH)和丙酮酸脱羧酶(PDC)活性测定参照Li等[17]的方法,蛋白质含量测定参照Bradford[18]的考马斯亮兰G250法。以OD340每min底物减少1 μmol为1个酶活性单位(U),酶活性以U/g蛋白表示。
1.4 统计分析
采用SPSS 13.0,Duncan多重比较法进行统计分析,Excel作图。
2 结果与分析
2.1 淹水胁迫对紫花苜蓿幼苗生长的影响
对淹水胁迫第10天的幼苗生物量测定结果表明,2个苜蓿品种的鲜重、根冠比均显著低于对照(表1)。渝苜1号生长受抑制程度明显低于新疆紫泥泉。淹水胁迫下,渝苜1号植株的鲜重和根冠比为对照的68.7%和53.4%,而新疆紫泥泉仅为对照的62.7%和44.1%;淹水对渝苜1号鲜重和根冠比的相对抑制率分别为31.2%和46.6%,明显低于新疆紫泥泉的37.2%和56.0%(表1),表明淹水对渝苜1号的影响较新疆紫泥泉小,渝苜1号比新疆紫泥泉具有更强的淹水耐受性。

表1 淹水第10天对紫花苜蓿幼苗生长量的影响
表中数据表示平均值±标准差,不同大写字母表示同一品种对照和处理间差异显著(P<0.05),同列不同小写字母表示同一测定项目不同品种间差异显著(P<0.05)。
The data in the Table were expressed as Mean±SD, different capital letter means significant difference at 0.05 level between control and waterlogging test in the same vatiety, different small letters in a line mean significant differences at 0.05 level between different varieties under the same test.
2.2 淹水胁迫对叶片MDA含量的影响

图1 淹水对紫花苜蓿幼苗叶片MDA含量的影响Fig.1 Effect of waterlogging on MDA content in the leaves of alfalfa seedlingsT:淹水Waterlogging;CK:对照Control; *和**:分别表示淹水条件下两个品种间差异显著(P<0.05)和极显著(P<0.01)。下同。*and**mean the significant differences at 0.05 and 0.01 level, respectively. The same below.
淹水胁迫下叶片MDA含量如图1所示。在整个试验阶段,对照植株中的MDA含量变化不大。淹水条件下,植株的MDA含量显著增加,且新疆紫泥泉的MDA含量一直高于渝苜1号。从图1还可以看出,新疆紫泥泉叶片MDA含量在第6天达到最大值,为对照的3.3倍,是渝苜1号的1.6倍,随后开始下降,但淹水第10天仍显著高于渝苜1号(P<0.05)。整个淹水阶段渝苜1号MDA含量增加较新疆紫泥泉少,说明渝苜1号受淹水胁迫的影响较小,受到的伤害也比较小。
2.3 淹水胁迫对叶片中SOD、POD和CAT活性的影响
试验过程中,对照植株的抗氧化酶活性变化不大,一直在小范围波动,而淹水处理植株的酶活性变化比较大。淹水情况下,两个品种SOD活性在淹水第2天稍微下降之后开始明显增加,并在淹水第6天达到最大值,其中渝苜1号为544.5 U/g FW,新疆紫泥泉为406.8 U/g FW,二者差异显著(P<0.01)。随后,两个品种SOD活性都迅速降低,在第10天降到对照水平以下,但渝苜1号仍高于新疆紫泥泉(图2)。
两个品种POD活性在淹水后开始增加,并在第4天达到最大值,随后新疆紫泥泉中的POD活性开始迅速下降,而渝苜1号中的POD活性下降速度较慢,在淹水第8天渝苜1号中的POD活性是新疆紫泥泉的1.4倍,差异极显著(P<0.01)(图2)。
淹水处理后,两个品种CAT活性明显增强,在淹水第2天渝苜1号的CAT活性迅速达到峰值,是对照的2.3倍,是新疆紫泥泉的1.5倍。新疆紫泥泉的CAT活性在第4天达到最大值,随后降低,而渝苜1号在淹水第6天依然保持着较高的CAT活性。在整个淹水处理过程中,渝苜1号的CAT活性明显高于新疆紫泥泉(图2)。
2.4 淹水胁迫对根系ADH、LDH和PDC活性的影响
整个淹水胁迫阶段,两个品种ADH活性都呈先增加后减小的趋势,且都在第6天达到峰值,随后,两个品种ADH活性都降低。在淹水第8天,渝苜1号ADH活性是新疆紫泥泉的2.3倍,二者差异极显著(P<0.01)。第10天,渝苜1号仍高于新疆紫泥泉(图3)。
淹水处理后两个品种植株中LDH活性都增加。淹水胁迫第2天,渝苜1号中的LDH活性达到最大值(5 U/g),是对照的1.7倍,但与新疆紫泥泉(4.4 U/g)差异不显著。随后,渝苜1号中的LDH活性一直在较小的范围内波动,缓慢下降,而新疆紫泥泉中的LDH活性显著增加,在第6天达到峰值(9.4 U/g),是对照的3.9倍,是渝苜1号的2.1倍,随后新疆紫泥泉中的LDH活性显著降低(图3)。
两个品种淹水胁迫后PDC活性增加,其中新疆紫泥泉的PDC活性在第2天达到最大值,随后下降。而渝苜1号在淹水第6天才达到峰值,是新疆紫泥泉的1.5倍,两者差异极显著(P<0.01),随后渝苜1号PDC活性也降低,总体来看,渝苜1号PDC活性比新疆紫泥泉高,持续时间长(图3)。
3 讨论
本研究结果表明,淹水胁迫显著抑制了紫花苜蓿的生长,但渝苜1号比新疆紫泥泉具有更强的淹水耐受性(表1)。渝苜1号是在南方湿热地区(重庆)育成的品种,而新疆紫泥泉则是北方干旱地区的地方品种。许多研究表明品种育成地气候与品种特性密切相关[19-21]。在湿热地区育成的品种渝苜1号应表现出更具耐湿性。
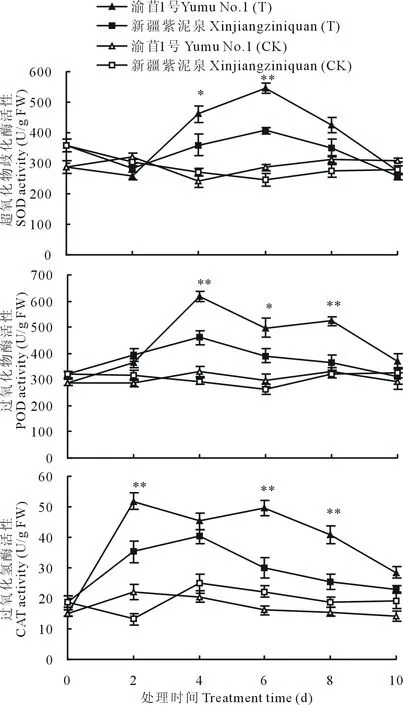
图2 淹水胁迫对紫花苜蓿幼苗叶片SOD、POD和CAT活性的影响Fig.2 Effect of waterlogging on the activity of SOD, POD and CAT in the leaves of alfalfa seedlings

图3 淹水胁迫对紫花苜蓿幼苗根系ADH、LDH和PDC活性的影响Fig.3 Effect of waterlogging on the activity of ADH, LDH and PDC in the leaves of alfalfa seedlings
土壤淹水时,缺氧是最主要的胁迫因素。缺氧时,植物根系依靠氧的反应过程被抑制,ATP供不应求,植物通过启动无氧呼吸,进入发酵代谢,依靠NAD+氧化底物生成ATP(底物水平磷酸化)来维持植物的生长发育[22]。LDH是植物缺氧进行乳酸发酵不可缺少的一种酶。旱生植物淹水之后缺氧诱导LDH活性迅速升高,淹水很短的时间之后就以乳酸发酵为主,这是不耐低氧植物的显著特征[23]。PDC与ADH是植物缺氧进行乙醇发酵不可缺少的酶,抗淹水植物的淹水耐性与ADH活性的变化呈正比,在淹水条件下,ADH活性迅速升高,将有毒物质乙醛转化成乙醇,帮助植物躲避缺氧根系的主要毒害物质之一乙醛的伤害[8]。在拟南芥中发现PDC是乙醇发酵的限速酶,过量表达丙酮酸脱羧酶基因pdc1和pdc2的拟南芥植株在淹水条件下的成活率明显增加[24]。可见淹水之后以乙醇发酵为主,是耐低氧植物的显著特征。本研究的两个品种在淹水2 d以后各个阶段,渝苜1号根系无氧呼吸酶ADH和PDC的活性均高于新疆紫泥泉,而LDH的活性则低于新疆紫泥泉(图3),说明在淹水条件下渝苜1号NAD+产生的主要途径不是乳酸发酵而是乙醇发酵。因此,乙醇发酵是渝苜1号耐缺氧的一种战略,是渝苜1号比新疆紫泥泉耐水淹的重要理由之一。
淹水胁迫下,植物体内氧化代谢紊乱,产生过多的活性氧类物质(ROS),产生氧化胁迫,但植物体内的抗氧化酶保护系统能够清除自由基的损伤,保护植物免受氧化伤害[25-26]。研究表明,SOD、POD和CAT活性高能够保护植物在长时间水淹时免受活性氧的伤害,对维持植物存活具有重要意义[7-8]。淹水条件下,渝苜1号比新疆紫泥泉能够维持更高的SOD、POD和CAT活性水平(图2),这就使它能够更好地消除活性氧,保护植株免受更严重的氧化伤害,这也是说明渝苜1号比新疆紫泥泉更耐淹水胁迫的理由之一。
4 结论
淹水胁迫下,紫花苜蓿生长受到严重抑制,抑制幅度与品种耐湿强弱有关。在湿热地区育成的品种渝苜1号耐淹水能力比新疆紫泥泉强,因为渝苜1号抗氧化酶活性更高,而且在缺氧条件下主要通过乙醇发酵途径,具有耐低氧植物特征。
[1] Liu T. The role of alfalfa in agri-ecological systems. Jilin Animal Husbandry and Veterinary Medicine, 2005, (7): 21-23.
[2] Yue Y H, Qi X, Wang Y R,etal. Persistence of 35Medicagosativavarieties at the 10th year after establishment. Acta Prataculturae Sinica, 2014, 23(1): 58-64.
[3] He Z Q, Huan H F, He H X,etal. Problems and solutions of the grass industry in south China. Tropical Agricultural Engineering, 2009, 33(3): 83-86.
[4] An Y, Cheng F Y, Wang J,etal. Studies on waterlogging tolerance of semi-fall and non-fall dormant alfalfa cultivars. Grassland of China, 2004, 26(4): 31-36.
[5] Zhou G S, Zhu X T. Changes of physiological characters of wheat after waterlogging and relations between physiological characters and waterlogging tolerance of different varieties. Scientia Agricultura Sinica, 2002, 35(7): 777-783.
[6] Li L, Zou D S, Liu D W,etal. Research progress on waterlogging in peanut and other crops. Chinese Journal of Oil Crop Sciences, 2004, 26(3): 105-110.
[7] Liu W G, Yan Z H, Wang C,etal. Response of antioxidant defense system in watermelon seeding subjected to waterlogged stress. Journal of Fruit Science, 2006, 23(6): 860-864.
[8] Chen L Z, Lin P, Wang W Q. Mechanisms of mangroves waterlogging resistance. Acta Ecologica Sinica, 2006, (2): 586-593.
[9] Ahmed S, Nawata E, Hosokawa M,etal. Alterations in photosynthesis and some antioxidant enzymatic activities of mungbean subjected to waterlogging. Plant Science, 2002, 163(1): 117-123.
[10] Mustroph A, Albrecht G. Tolerance of crop plants to oxygen deficiency stress: fermentative activity and photosynthetic capacity of entire seedlings under hypoxia and anoxia. Acta Physiologiae Plantarum, 2003, 117(4): 508-520.
[11] Ismail A M, Ella E S, Vergara G V,etal. Mechanisms associated with tolerance to flooding during germination and early seedling growth in rice (Oryzasativa). Annals of Botany, 2009, 103(2): 197-209.
[12] Kang Y Y, Guo S R, Li J,etal. Effect of root applied 24-epibrassinolide on carbohydrate status and fermentative enzyme activities in cucumber (CucumissativusL.) seedlings under hypoxia. Plant Growth Regulation, 2009, 57: 259-269.
[13] Wang X K. The Principle and Technology of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2006: 228-281.
[14] Wang Q F, Yi Q, Hu Q Q,etal. Simultaneous overexpression of citrate synthase and phosphoenolpyruvate carboxylase in leaves augments citrate exclusion and Alresistance in transgenic tobacco. Plant Molecular Biology Reporter, 2012, 30: 992-1005.
[15] Yang J H, Gao Y, Li Y M,etal. Salicylic acid-induced enhancement of cold tolerance through activation of antioxidative capacity in watermelon. Scientia Horticultrae, 2008, 118: 200-205.
[16] Wang K, Bian S, Jiang Y. Anaerobic metabolism in roots ofKentuckybluegrassin response to short-term waterlogging alone and in combination with high temperatures. Plant and Soil, 2009, 314: 221-229.
[17] Li C Y, Bai T H, Ma F W,etal. Hypoxia tolerance and adaptation of anaerobic respiration to hypoxia stress in twoMalusspecies. Scientia Horticulturae, 2010, 124(2): 274-279.
[18] Bradford M M. A rapid and sensitive method for the quantitation of icrogram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72: 248-254.
[19] Liu J, Cai H, Liu Y,etal. A study on physiological characteristics and comparison of salt tolerance of twoMedicagosativaat the seeding stage. Acta Prataculturae Sinica, 2013, 22(2): 250-256.
[20] Li Y, Liu G B, Gao H W,etal. A comprehensive evaluation of salt-tolerance and the physiological response ofMedicagosativaat the seeding stage. Acta Prataculturae Sinica, 2010, 19(4): 79-86.
[21] Wu J, Cai H, Bai X,etal. An analysis of salt tolerance of transgenic alfalfa with theGsGST13/SCMRPgene. Acta Prataculturae Sinica, 2014, 23(1): 257-265.
[22] Li Z, Mei S F, Liu X L,etal. Research progress in waterlogging and submergence tolerance of crops. Hubei Agricultural Sciences, 2009, 48(11): 2866-2868.
[23] Nada K, Iwatani E, Doi T,etal. Effect of putrescine pretreatment to roots on growth and lactate metabolism in the root of tomato (LycopersiconesculentumMill.) under root-zone hypoxia. Journal of the Japanese Society for Horticultural Science, 2004, 73(4): 337-339.
[24] Ismond K P, Dolferus R, Pauw M,etal. Enhanced lowoxygen survival inArabidopsisthrough increased metabolic flux in the fermentative pathway. Plant Physiology, 2003, 132(3): 1292-1302.
[25] Mittler R. Oxidative stress, antioxidants and stress tolerance.Trends in Plant Science, 2002, 7(9): 405-410.
[26] Yin D M, Chen S M, Chen F D,etal. Morpho-anatomical and physiological responses of twoDendranthemaspecies to waterlogging. Environmental and Experimental Botany, 2010, 68: 122-130.
参考文献:
[1] 刘婷. 紫花苜蓿在农业生态系统中的作用. 吉林畜牧兽医, 2005, (7): 21-23.
[2] 岳彦红, 齐晓, 王彦荣, 等. 35个10龄紫花苜蓿品种的持久性比较. 草业学报, 2014, 23(1): 58-64.
[3] 何忠曲, 郇恒福, 何华玄, 等.我国南方草业发展存在的问题与对策. 热带农业工程, 2009, 33(3): 83-86.
[4] 安渊, 陈凡毅, 王俊, 等.半秋眠和非秋眠紫花苜蓿品种耐涝性能研究. 中国草地, 2004, 26(4): 31-36.
[5] 周广生, 朱旭彤.湿害后小麦生理变化与品种耐湿性的关系. 中国农业科学, 2002, 35(7): 777-783.
[6] 李林, 邹冬生, 刘登望, 等.花生等农作物耐湿涝性研究进展.中国油料作物学报, 2004, 26(3): 105-110.
[7] 刘文革, 阎志红, 王川, 等.西瓜幼苗抗氧化系统对淹水胁迫的响应. 果树学报, 2006, 23(6): 860-864.
[8] 陈鹭真, 林鹏, 王文卿.红树植物淹水胁迫响应研究进展. 生态学报, 2006, (2): 586-593.
[13] 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006: 228-281.
[19] 刘晶, 才华, 刘莹, 等. 两种紫花苜蓿苗期耐盐生理特性的初步研究及其耐盐性比较. 草业学报, 2013, 22(2): 250-256.
[20] 李源, 刘贵波, 高洪文, 等.紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应. 草业学报, 2010, 19(4): 79-86.
[21] 吴婧, 才华, 柏锡, 等. 转GsGST13/SCMRP基因双价苜蓿的耐盐性分析. 草业学报, 2014, 23(1): 257-265.
[22] 李真, 梅淑芳, 刘向蕾, 等.作物耐湿涝性研究进展. 湖北农业科学, 2009, 48(11): 2866-2868.
Effect of waterlogging on antioxidant and anaerobic respiratory enzymesinMedicagosativavarieties from southern and northern China
QUAN Rui-Lan1,2, YU Yong-Xiong1*
1.CollegeofAnimalScienceandTechnology,SouthwestUniversity,Chongqing400716,China; 2.XinyangCityAcademyofAgriculturalSciences,Xinyang464000,China
TwoMedicagosativavarieties, Yumu No.1 (southern China) and Xinjiangziniquan (northern China), were compared. Six waterlogging treatments; 0, 2, 4, 6, 8 and 10 days of waterlogging were imposed on seedlings at the 4-leaf stage. The malondialdehyde (MDA) content, superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) activity in the leaves and lactate dehydrogenase (LDH), pyruvate (PDC) and alcohol dehydrogenase (ADH) activity in the roots were evaluated in all treatments. Biomass was measured after 10 days of waterlogging. Waterlogging stress reduced the biomass of both varieties but Yumu No.1 was less affected than Xinjiangziniquan. The activities of SOD, POD and CAT in leaves of Yumu No.1 were higher than those of Xinjiangziniquan under waterlogging stress, but the MDA content in the leaves was lower than that of Xinjiangziniquan. The activity of respiratory enzymes in the roots was influenced by waterlogging; In Yumu No.1 ADH and PDC activity increased more than LDH activity with stronger alcohol dehydrogenaseactivity, while in Xinjiangziniquanwaterlogging resulted in increased LDH and lactic dehydrogenase activity. It was concluded that the greater tolerance of waterlogging observed in Yumu No.1 was primarily due to higher antioxidant enzyme and anaerobic respiratory enzyme activity.
waterlogging stress;Medicagosativa; variety; antioxidant enzyme; anaerobic respiratory enzyme
10.11686/cyxb20150510
http://cyxb.lzu.edu.cn
2014-03-11;改回日期:2014-11-03
973计划课题(2007CB108901),948项目(2014-Z31)和国家“十一五”支撑计划项目(2011BAD36B02,2011BAD36B03)资助。
全瑞兰(1985-),女,河南平顶山人,硕士。E-mail:qrlhe@163.com *通讯作者Corresponding author. E-mail:yuyongxiong8@126.com
全瑞兰, 玉永雄. 淹水对紫花苜蓿南北方品种抗氧化酶和无氧呼吸酶的影响. 草业学报, 2015, 24(5): 84-90.
Quan R L, Yu Y X. Effect of waterlogging on antioxidant and anaerobic respiratory enzymesinMedicagosativavarieties from southern and northern China. Acta Prataculturae Sinica, 2015, 24(5): 84-90.

